利用枯草芽孢杆菌发酵鱿鱼内脏的工艺探讨
2018-05-16魏薇薇闻正顺
李 怡,魏薇薇,闻正顺
(浙江海洋大学食品与医药学院,浙江舟山 316022)
微生物发酵技术得益于其条件温和,充足的原产物来源,以及价格低廉、专一的产物、还有对环境污染小等特点,使得微生物发酵在诸多领域应用广泛,比如在食品工业、医药工业、农业、环境保护等方面。形成了规模较大的发酵工业。在很多发达国家,国民生产总值的百分之五左右为发酵工业[1]。查阅相关文献可知,纤维素酶、植酸酶、蛋白酶、果胶酶、葡聚糖酶、淀粉酶和木聚糖酶约十几种酶类枯草芽孢杆菌都可以产生[2]。枯草芽孢杆菌属于一种安全菌株,美国食品药品监督管理局调查发现枯草芽孢杆菌的使用无安全隐患的存在。美国有关部门已经批准将其作为饲料的成分去饲养动物。我国农业部也允许将枯草芽孢杆菌作为饲料添加剂[3-4]。
随近年来捕捞技术的改进,我国鱿鱼的捕捞量也随即增加。在鱿鱼的处理过程中会产生大部分的废物,鱿鱼内脏就占其中的很大比例,虽然是鱿鱼加工过程中产生的废物,但是其所含营养却是相当丰富的,光鱿鱼内脏所含的蛋白质就达到了百分二十左右,脂肪含量和蛋白质相当。除此之外,还富含人体所需的氨基酸、牛磺酸以及一些微量元素,因此将鱿鱼内脏进行加工处理后再投放市场能达到不错的经济效益,还能够缓解因鱿鱼加工所产生的大量废物带来的环境压力。据了解,目前把鱿鱼内脏加工制作成饲料的较多,因为其含有丰富的氨基酸。另外,也将鱿鱼内脏制成酱油和天然调味品等[5]。但在我国,让消费者接受内脏产品是一个不小的挑战[6],在我国将鱿鱼内脏做成酱油的研究比较多,段杉等[7]、徐伟等[8]在这方面做了不少研究工作。早在上个世纪末就有学者发现研究鱿鱼内脏具有很大的市场价值[9],国外学者SATOH et al[10]研究发现鱿鱼内脏作为饲料对黑岩鱼具有很好的饲养效果。利用枯草芽孢杆菌产生的酶类发酵鱿鱼内脏下脚料,将蛋白质降解为小分子肽类,其可作为鱼饲料的辅助添加剂,也可混以其他物质作为农作物肥料,易被吸收[11]。试验通过研究枯草芽孢杆菌发酵鱿鱼内脏的工艺优化,用鱿鱼内脏作为发酵底物,测定发酵液中的可溶性肽含量来衡量发酵效果,目的是为了提高鱿鱼内脏的高值化利用以及为今后用枯草芽孢杆菌发酵海产品下脚料提供可供参考的文献资料。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与培养基
枯草芽孢杆菌(保存于实验室),菌种扩大培养基为:葡萄糖(碳源)、蛋白胨、酵母浸粉、磷酸二氢钾、碳酸钙、无菌水。发酵培养基组成为鱿鱼内脏,无菌水,碳源。
1.1.2 主要试剂
Na2CO3、NaOH、无水CuSO4、酒石酸钾钠等试剂。(均为分析纯)
1.2 仪器与设备
UV-1600型紫外分光光度计,上海美谱达仪器有限公司;HH-2数显恒温水浴锅,国华电器有限公司;THZ-82B气浴恒温震荡器,金坛市医疗仪器厂;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;DGG-9140A型电热鼓风恒温干燥箱,上海森信实验仪器有限公司;YC-260L 4℃冰箱,中科美菱;FA1004N分析天平,上海民桥精密科学仪器有限公司;TG20-WS离心机,长沙湘智离心机仪器有限公司等。
1.3 试验方法
1.3.1 菌种的扩大培养
根据1.1.1配方按比例制作枯草芽孢杆菌扩大培养基,制备好后放入灭菌锅中121℃灭菌30 min,灭菌完成后于超净工作台中冷却至室温,用接种环挑取保存于斜面的菌种一环接种于扩大培养基中,进行扩大培养,得到种子液,保存备用。
1.3.2 发酵工艺
将保存在冰箱的下脚料流水解冻后称取2 g作为发酵底物,然后加入一定比例的无菌水和碳源,最后将扩大培养的发酵种子液在无菌环境下接种到下脚料底物中进行单因素以及正交试验。发酵结束后利用福林酚法测定发酵液中可溶性肽的含量,并计算出结果。
1.3.3 单因素试验设计
在确定单因素水平之前做预实验,选取多个水平进行单因素试验,通过试验结果分析确定最后的各个因素水平范围,试验将选取碳源添加量、菌种接种量、料水比以及培养时间这4个因素作为试验的单因素,根据发酵液中可溶性肽含量来判断各因素对发酵效果的影响[12]。
1.3.4 正交试验设计
正交试验设计建立在前期单因素试验结果上,分析各因素对发酵效果的影响大小选取碳源接种量、料

表1 正交试验设计Tab.1 Orthogonal experimental design
水比例、菌液接种量此三因素来设计正交试验,设计表见表1。
1.4 检测指标及方法
发酵液中可溶性肽含量采用Folin-酚法进行测定[13]。
2 结果与讨论
2.1 枯草芽孢杆菌发酵试验结果
2.1.1 枯草芽孢杆菌单因素试验结果
2.1.1.1 料水比单因素试验结果
考察料水比单因素对发酵效果的影响是因为水分对微生物的生长也起到了关键的作用,将料水比设定为1:1、1:3、1:5、1:7、1:10,发酵液中菌液接种量为10%,发酵温度37℃,放入恒温培养中发酵1 d。采用福林酚法测定发酵液中可溶性肽的含量。实验结果如图1。
从图1中可知,1:5和1:10的料水比得到可溶性肽含量值较高,综合考虑,选择料水比为1:5.
2.1.1.2 碳源接种量单因素试验结果
将发酵料水比设定为1:5,发酵液中菌液接种量为10%,发酵温度37℃,放入恒温培养中发酵1 d,将碳源添加量设定为2%、5%、7%、10%、12%,发酵结束后测定发酵液中可溶性肽含量,结果如下图2所示。
从图2中可知,添加10%和12%的碳源的时候可溶性肽含量几乎相同,考虑到节约成本,试验采用10%的碳源添加量。
2.1.1.3 菌液接种量单因素试验结果
菌液接种量是发酵实验中一个重要的因素,接种过多或过少都会对发酵液中的可溶性肽含量有影响。因此为了确定合适的菌液接种量,本次试验将接种量定为5%、7%、10%、12%、15%进行发酵,结果如图3。
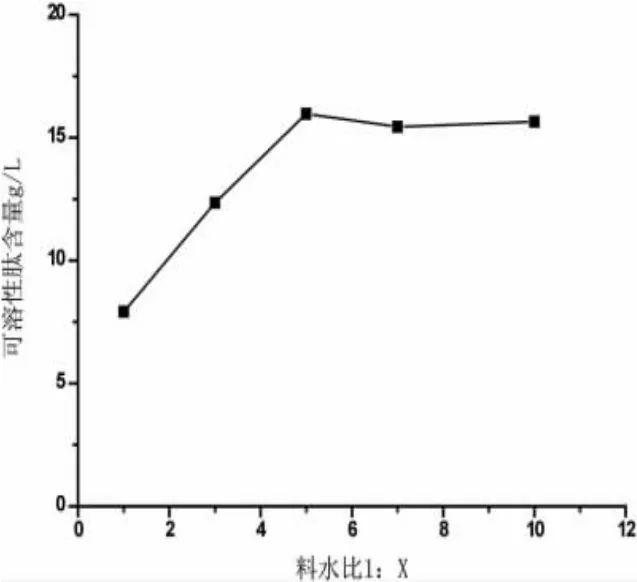
图1 料水比对发酵液中可溶性肽含量的影响Fig.1 Effect of feed water ratio on soluble peptide content in fermentation broth
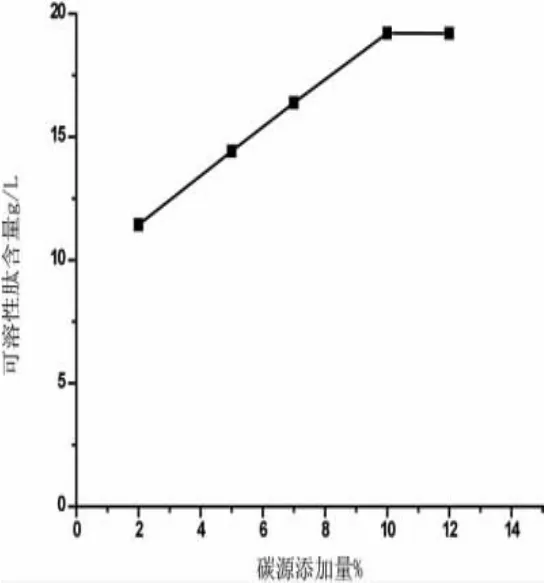
图2 碳源添加量对发酵液中可溶性肽含量的影响Fig.2 Effect of carbon addition on soluble peptide content in fermentation broth
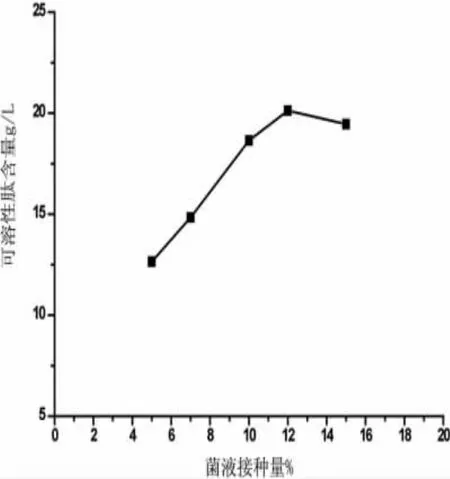
图3 接种量对发酵液中可溶性肽含量的影响Fig.3 Effect of inoculum size on solublepeptide content in fermentation broth
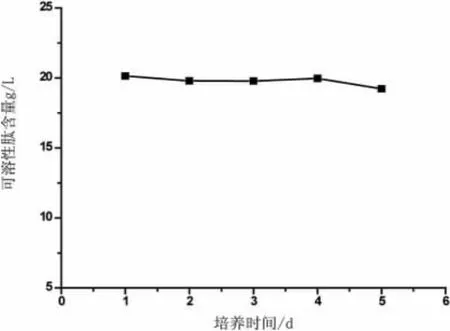
图4 培养时间对发酵液中可溶性肽含量的影响Fig.4 Effect of culture time on soluble peptide content in fermentation broth
从图3中可知,可溶性肽的含量先是随着接种量的增加而上升的,当接种量达到12%时出现峰值,含量最高;5%的时候最低,分析其原因有可能是因为接种量太少时没有充分与底物结合,所以发酵效果较次,接种量太多导致菌种间生长竞争,生长过快导致营养缺乏,所以发酵液中可溶性肽含量也不高;故采用12%的接种量。
2.1.1.4 发酵时间单因素试验结果
为了探讨最佳的发酵时间,试验将发酵培养时间设定为1 d、2 d、3 d、4 d、5 d进行发酵,结果如图4所示。
从图4中可以看出发酵前4 d里发酵液中可溶性肽含量的变化不是很大,第5 d有较为明显的下降,考虑到实际的需求,发酵时间越短越好,因此确定发酵时间为1 d。
2.1.2 枯草芽孢杆菌工艺优化试验结果
2.1.2.1 正交试验设计及结果
由表2极差R分析结果可知,发酵液中可溶性肽含量的影响因素主次顺序为:料水比>接种量>碳源添加量,也就是料水比是影响枯草芽孢杆菌发酵鱿鱼内脏发酵液中可溶性肽含量的重要因素,其次是接种量和碳源添加量。最优组合为A2,B2,C3,即发酵的最佳条件:料水比为1:5,碳源添加量为10%,菌液接种量为12%,发酵时间为1 d。
2.2 讨论
通过单因素试验和正交试验可以看出,枯草芽孢杆菌发酵鱿鱼内脏试验过程中,单因素试验结果和正交试验结果基本一致。对枯草芽孢杆菌单因素和正交试验结果的进一步分析,发现发酵产物可溶性肽含量可达到20.87 g/L。这主要是因为枯草芽孢杆菌能够产生一系列酶系,产生的酶能够将鱿鱼内脏里面的一些成分降解,使得一些不可溶和难以吸收消化的大分子物质降解为可吸收的小分子的多肽类,小分子蛋白类;从而使得发酵液中的可溶性肽含量会有所增加。已有的研究表明枯草芽孢杆菌可提高奥尼罗非鱼[14]、凡纳滨对虾[15]和印度明对虾的消化酶活性和饲料转化率[16]。与此同时,其代谢过程中还能合成B族维生素及VE、VK等营养素,还能促进Ca、P的吸收,提高动物的生长性能[17]。
3 结论
将微生物发酵技术应用在处理海产品下脚料中,用单因素和正交试验对发酵工艺进行优化,根据正交试验分析得到了各因素对枯草芽孢杆菌发酵鱿鱼内脏下脚料的影响,获得了最佳发酵工艺条件:菌液接种量为12%,料水比为1:5,碳源添加量为10%,发酵时间为1 d。枯草芽孢杆菌在此组合下发酵鱿鱼内脏,发酵液中可溶性肽含量达到20.871 8 g/L。由此可知,利用微生物对海产品加工过程中剩下的废料进行回收处理,不仅可以对其加工成具有经济价值的生物制品,同时也对环境起到一定的保护作用,符合现在的绿色环保发展理念;同时也丰富了微生物的研究内容,对这一项技术所能应用的领域及对象得到扩大并提供相应的资料文献用以参考。
参考文献:
[1]燕平梅.微生物发酵技术[M].北京:中国农业科学技术出版社,2010:11-12.
[2]MAURIELLO E M F,DUC L H,ISTICATO R,et al.Display of heterologous antigens on the Bacillus subtilis spore coat using CotC as a fusion partner[J].Vaccine,2004,22(10):1 177-1 187.
[3]王晓云.高产蛋白酶枯草芽孢杆菌的筛选与诱变选育研究[D].泰安:山东农业大学,2015.
[4]王 琦.耐高温α-淀粉酶基因改造研究进展[J].食品研究与开发,2013,34(5):133-136.
[5]张开强.鱿鱼(Todarodes pacificus)内脏自溶液的体外抗氧活性及内源性蛋白酶的提取和应用[D].舟山:浙江海洋大学,2016.
[6]童军锋,张 英.加强鱿鱼资源的加工和综合利用技术研究[J].东海海洋,2001,19(4):46-50.
[7]段 杉,司伟兰,何宝欣.以鱿鱼内脏为原料酿制鱿鱼酱油的工艺研究[J].农产品加工:学刊,2012(5):52-55.
[8]徐 伟,石海英,朱 奇,等.鱿鱼加工废弃物鱼酱油发酵过程中的生物胺变化研究[J].安徽农业科学,2010,38(4):2 055-2 057.
[9]王建中,吕玉英,徐正琪.鱿鱼内脏的综合利用研究[J].中国海洋药物,1999(1):55-58.
[10]SATOH N,NOBUTA S,WAKASUGI M,et al.Availability of squid viscera meal with cadmium removal treatment as a feed ingredient for fingerling black rockfish Sebastes schlegeli[J].Fisheries Science,2013,79(2):259-267.
[12]魏薇薇,姚利阳,曲有乐,等.微生物发酵鱿鱼加工副产物的工艺优化[J].浙江海洋学院学报:自然科学版,2016,35(5):410-416.
[13]陈 荫.四株不同来源海洋微生物胞外多糖的结构及抗氧化活性研究[D].青岛:中国海洋大学,2012.
[14]江永明,付天玺,张 丽,等.微生物制剂对奥尼罗非鱼生长及消化酶活性的影响[J].水生生物学报,2011,35(6):998-1 004.
[15]丁 贤,李卓佳,陈永青,等.芽孢杆菌对凡纳对虾生长和消化酶活性的影响[J].中国水产科学,2004,11(6):580-584.
[16]ZIAEI-EJAD S,REZAEI M H,TAKAMI G A,et a1.The effect of Bacillus spp.bacteria used as probiotics on digestive enzyme activity,survival and growth in the Indian white shrimp Fenneropenaeus iudicu[J].Aquaculture,2006,252(2/4):516-524.
[17]万阜昌.微生态药物研究与应用[M].北京:化学工业出版社,2009:68-69.
