干扰miRNA-183表达对食管癌细胞凋亡的影响及机制研究
2018-05-16常国涛杨玉伦宋国趁万清廉
常国涛,杨玉伦,宋国趁,万清廉
郑州人民医院胸外科,郑州 450000
食管癌是一种常见的食管鳞状上皮或腺上皮发生病变的消化道恶性肿瘤。2015年中国癌症统计数据显示,中国食管癌的发病人数和死亡人数大约分别为47.8万和37.5万,占全国恶性肿瘤的11.1%和13.3%[1]。食管癌根据组织病理学分为食管腺癌和食管鳞癌,其中食管鳞癌在中国占90%左右。食管癌的恶性程度较高,早期病情隐匿,多数患者就诊时已错过最佳治疗时机。目前,针对食管癌的治疗以外科手术治疗和放化疗为主,但往往出现预后效果差和生存率低等现象。微小RNA(miRNA)是一类可调控基因表达的内源性非编码单链小分子RNA,不仅与多种肿瘤疾病的诊断、预后和治疗密切相关,还可以作为致癌或抑癌基因参与肿瘤细胞的增殖、分化和凋亡等生物学行为[2-4]。食管癌的发生是一个多基因调控的复杂过程,由于治疗手段的局限性,miRNA对食管癌的治疗越来越受到关注和重视。近年来的研究显示,miRNA-183在多种肿瘤中异常表达,通过不同的作用机制参与肿瘤细胞的增殖、侵袭和凋亡等生理过程[5-7]。目前,关于miRNA-183在食管癌中的作用机制尚未完全清楚。本文研究了miRNA-183对食管癌细胞凋亡的影响,并对其可能的作用机制进行初步探讨,旨在了解食管癌的发病机制,并为食管癌的诊断和治疗提供参考,现报道如下。
1 材料与方法
1.1 材料
选取2012—2017年于郑州人民医院接受食管癌切除术并经病理检查确诊的食管鳞癌患者96例。手术切除时均经患者同意,取其食管癌组织及距离癌组织5 cm以外的正常食管组织。患者术前均无放疗或化疗史。96例患者中,男62例,女34例;年龄43~76岁,平均(62.35±5.22)岁。正常食管上皮细胞株HEEC和食管鳞癌细胞株Eca109由郑州大学实验室提供。
高糖DMEM培养基、胎牛血清、青链霉素、胰蛋白酶、磷酸盐缓冲溶液(PBS)、Lipofectamine 2000和Trizol均购自美国Gibico公司;膜联蛋白-V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡试剂盒购自南京凯基生物科技发展有限公司;BCA蛋白检测试剂盒、荧光定量PCR试剂盒和逆转录试剂盒均购自宝生物工程(大连)有限公司 ;miRNA-183 inhibitor、miRNA-183 inhibitor negative control和PCR引物均购自上海生博生物医药科技有限公司;B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)单克隆抗体、β肌动蛋白(β-actin)单克隆抗体、p53单克隆抗体和辣根过氧化物酶标记的抗鼠或抗兔IgG(IgG-HRP)二抗均购自上海Beyotime公司;流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 荧光定量PCR检测 取保存于液氮罐中的正常食管组织和食管癌组织,在预冷的研钵中研成粉末,取粉末40 mg置于含有1 ml Trizol的试管中,采用电动匀浆器获得匀浆,加入预冷的氯仿200 μl,充分反应后,5000 rpm离心10 min。取上清液,加入等量异丙醇,反应30 min后,以75%乙醇沉淀RNA。加入适量的无RNA酶的水溶解RNA,紫外吸收法检测RNA的浓度。采用逆转录试剂盒反转录获得cDNA,以cDNA为模板链进行荧光定量 PCR。每管反应体系为 20 μl,其中模板 2 μl,上下游引物各 0.5 μl,SYBR Green PCR Master Mix 10 μl,ddH2O 7 μl。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸300 s,共35个循环;72℃延伸5 min。以U6作为内参,采用2-△△Ct法计算miRNA-183的表达量。
1.2.2 细胞培养 将正常食管上皮HEEC细胞和食管鳞癌Eca109细胞培养于含有青链霉素双抗和10%胎牛血清的DMEM培养基中,并置于37℃、5%CO2饱和湿度的培养箱中培养。待细胞生长面积占培养瓶面积的70%以上时,加入0.25%胰蛋白酶,使用培养液终止消化后,按照1∶4的比例传代培养。取对数生长期的两种细胞,按照1.2.1中的步骤检测miRNA-183的表达情况。
1.2.3 细胞转染及分组 转染前1 d,收集对数生长期的食管鳞癌Eca109细胞,以1×106/ml的细胞浓度接种于6孔培养板中,按照Lipofectamine 2000说明书进行转染。以加入脂质体和miRNA-183 inhibitor的细胞为miRNA-183 inhibitor组,以加入脂质体和miRNA-183 inhibitor negative control的细胞为阴性对照组,以加入等量脂质体的细胞为空白对照组。其中,miRNA-183 inhibitor的终浓度为250 nmol/L。转染48 h后,收集细胞,检测各组细胞中miRNA-183的表达情况,操作步骤同1.2.1。
1.2.4 流式细胞仪检测细胞凋亡率 收集上述融合度为70%以上的各组细胞,调整细胞浓度为1×105/ml,用PBS洗涤细胞后,加入结合缓冲液(binding buffer)500 μl重悬细胞,然后分别加入5 μl Annexin V-FITC和5 μl PI,于避光条件下室温反应30 min后,采用流式细胞仪检测各组细胞的凋亡率。
1.2.5 蛋白质印迹法(Western blot)检测Bcl-2和p53蛋白的表达水平 收集1.2.3中转染48 h后的各组细胞,加入RIPA裂解液提取细胞总蛋白,以BCA蛋白检测试剂盒定量总蛋白。将样品蛋白与加样缓冲液混合后,沸水浴3 min。取变性蛋白30 μg,上样,先用8 V/cm电压,待染料进入10%的聚丙烯酰胺分离胶后,电压增大至15 V/cm,电泳至染料抵达分离胶底部。电泳完成后,取下凝胶,采用半干式法转印至硝酸纤维素膜上,洗膜后,置于封闭液中,4℃下封闭1 h。加入Bcl-2(1∶500稀释)、p53(1∶200稀释)和β-actin抗体(1∶1000稀释),于4℃下孵育一抗过夜,洗膜后加入IgG-HRP二抗(1∶2000稀释),室温下孵育2 h,ECL显影,采用图像分析软件分析Bcl-2和p53蛋白的表达水平。
1.3 统计学分析
采用SPSS 19.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P﹤0.05为差异有统计学意义。
2 结果
2.1 miRNA-183在食管癌及正常食管组织和细胞中的表达
荧光定量PCR检测结果显示,转染48 h后,空白对照组、阴性对照组和miRNA-183 inhibitor组细胞的miRNA-183相对表达量分别为(0.98±0.15)、(0.86±0.22)和(0.16±0.22)。空白对照组和阴性对照组细胞的miRNA-183相对表达量比较,差异无统 计 学 意 义(t=0.781,P﹥0.05);miRNA-183 inhibitor组细胞的miRNA-183相对表达量低于空白对照组,差异有统计学意义(t=5.334,P﹤0.05)。
2.2 转染后各组细胞miRNA-183表达水平的比较
荧光定量PCR检测结果显示,食管癌组织中miRNA-183的相对表达量为(0.769±0.089),高于正常食管组织的(0.402±0.057),差异有统计学意义(t=6.015,P﹤0.05)。食管鳞癌Eca109细胞中miRNA-183的相对表达量为(1.95±0.45),高于正常食管上皮HEEC细胞的(1.06±0.28),差异有统计学意义(t=2.909,P﹤0.05)。
2.3 干扰miRNA-183表达对食管癌细胞凋亡的影响
流式细胞仪检测结果显示,空白对照组、阴性对照组和miRNA-183 inhibitor组的细胞凋亡率分别 为(7.58±1.18)% 、(9.36±1.25)% 和(23.45±3.62)%。空白对照组和阴性对照组的细胞凋亡率比较,差异无统计学意义(t=1.794,P﹥0.05);miRNA-183 inhibitor组的细胞凋亡率高于空白对照组,差异有统计学意义(t=7.219,P﹤0.05)。(图1)
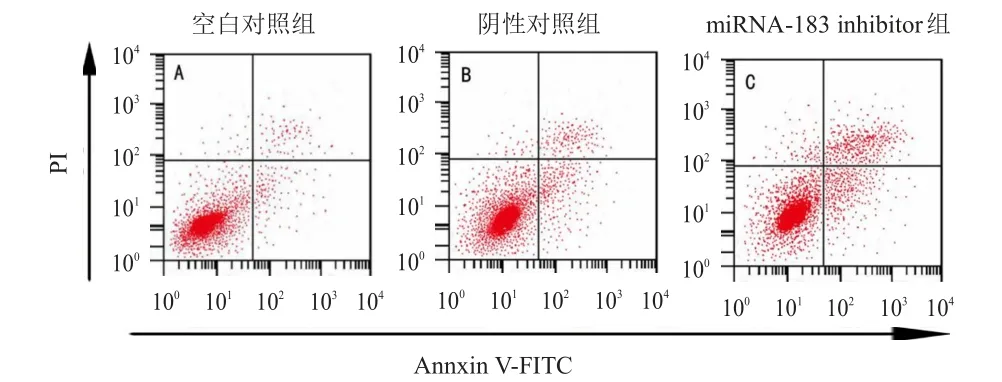
图1 转染后3组细胞的凋亡情况
2.4 干扰miRNA-183表达对Bcl-2和p53蛋白表达的影响
Western blot检测结果显示,miRNA-183 inhibitor组的Bcl-2蛋白表达水平低于空白对照组,p53蛋白表达水平高于空白对照组,差异均有统计学意义(t=18.074、6.971,P﹤0.05);阴性对照组与空白对照组的Bcl-2和p53蛋白表达水平比较,差异均无统计学意义(t=0.887、1.441,P﹥0.05)。(图2、表1)

图2 Western blot检测结果图
表1 3组细胞中Bcl-2和p53蛋白相对表达量的比较(±s)

表1 3组细胞中Bcl-2和p53蛋白相对表达量的比较(±s)
注:*与空白对照组比较,P<0.05
空白对照组阴性对照组miRNA-183 inhibitor组F值P值Bcl-2 0.92±0.06 0.88±0.05 0.22±0.03*198.686<0.01 p53 0.25±0.02 0.28±0.03 0.43±0.04*28.862<0.01
3 讨论
miRNA-183是miRNA-183家族中具有高度保守性的重要一员,位于人染色体7q32.3上。研究证实,miRNA-183与肿瘤细胞的增殖、凋亡、侵袭、转移及多种肿瘤的预后较差密切相关[8-9]。miRNA-183在多种肿瘤中呈高表达或低表达,而干扰miRNA-183表达后,可调控细胞的增殖和凋亡。Gu等[10]研究发现,miRNA-183在胃癌组织中的表达较癌旁正常组织明显上升,采用脂质体转染miRNA-183 mimic和miRNA-183 inhibitor干扰miRNA-183表达后,证实miRNA-183在胃癌中发挥着致癌基因的作用。曾宪一等[11]研究发现,miRNA-183在胶质母细胞瘤细胞株中低表达,通过上调miRNA-183表达能够明显抑制胶质母细胞瘤的增殖、迁移和侵袭。细胞凋亡异常是多种肿瘤发生和发展的重要原因之一。目前,食管癌的发生机制尚不明确,探讨食管癌细胞凋亡的作用机制,从而有效地诱导细胞凋亡,对食管癌的治疗具有重要意义。为探讨miRNA-183在食管癌发生和发展中的作用,本研究首先采用荧光定量PCR检测食管癌及正常食管组织和细胞中miRNA-183的表达情况,结果发现,miRNA-183在食管癌组织和细胞中均呈高表达,提示miRNA-183可能与食管癌的发生和发展有关。通过脂质体转染miRNA-183 inhibitor下调miRNA-183表达后,采用流式细胞仪检测食管鳞癌Eca109细胞的凋亡率,结果发现下调miRNA-183表达后,细胞凋亡率升高,表明下调miRNA-183的表达可诱导食管鳞癌Eca109细胞凋亡。
细胞凋亡是机体内程序性死亡清理多余细胞和受损细胞的重要方式。正常情况下,细胞凋亡在机体内受到严格控制以维持内环境的稳定性,一旦调控失衡,则会引起食管癌等疾病的发生。内部线粒体途径是细胞凋亡的重要途径之一,Bcl-2家族蛋白在调节线粒体外膜释放细胞色素c的过程中发挥着重要作用[12]。p53是一种公认的抑癌基因,在抑制血管生成和DNA修复、阻滞细胞周期和促进细胞凋亡等方面发挥着细胞应激和肿瘤抑制的重要作用[13]。研究表明,抗凋亡蛋白Bcl-2和突变型p53蛋白与食管癌的发生密切相关[14-16]。查阅文献发现,miRNA-183对Bcl-2和p53蛋白的表达有一定的调控作用。Lu等[17]采用miRNA-183调节胰腺癌SW1990细胞增殖,结果发现,抑制miRNA-183表达可导致Bcl-2表达水平明显下降。底建敏等[18]研究发现,miRNA-183可能通过抑制p53蛋白的表达从而抑制子宫内膜癌细胞增殖,促进细胞凋亡。为探讨miRNA-183在食管癌中的作用机制,本研究采用Western blot法检测下调miRNA-183的表达对食管鳞癌Eca109细胞中Bcl-2和p53蛋白表达的影响,结果发现下调miRNA-183表达后,Bcl-2蛋白表达明显降低,p53蛋白表达明显升高,提示miRNA-183可能通过下调Bcl-2蛋白和上调p53蛋白的表达促进细胞凋亡。
综上所述,miRNA-183在食管癌中呈高表达,可能在食管癌的发生和发展中发挥重要作用,有可能成为食管癌诊断和预后评估的新靶点。抑制miRNA-183表达可通过上调p53蛋白和下调Bcl-2蛋白的表达促进食管癌细胞凋亡,为食管癌发生机制的研究及治疗提供了新的参考依据。
参考文献
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CACancer J Clin,2016,66(2):115-132.
[2]杨志平,张芳,杨志英,等.食管癌肿瘤标记物miRNA的研究进展[J].中国老年学,2013,33(13):3270-3272.
[3]Xia JT,Chen LZ,Jian WH,et al.MicroRNA-362 induces cell proliferation and apoptosis resistance in gastric cancer by activation of NF-κB signaling[J].J Transl Med,2014,12:33.
[4]Kureel J,Dixit M,Tyagi AM,et al.miR-542-3p suppresses osteoblast cell proliferation and differentiation,targets BMP-7 signaling and inhibits bone formation[J].Cell Death Dis,2014,5(2):e1050.
[5]Yang M,Liu R,Li X,et al.miRNA-183 suppresses apoptosis and promotes proliferation in esophageal cancer by targeting PDCD4[J].Mol Cells,2014,37(12):873-880.
[6]张群,罗艳,张士璀.MiR-183基因簇对动物感觉器官功能和发育及肿瘤发生的调控[J].中国生物化学与分子生物学报,2012,28(7):593-602.
[7]Lu YY,Zheng JY,Liu J,et al.miR-183 induces cell proliferation,migration,and invasion by regulating PDCD4 expression in the SW1990 pancreatic cancer cell line[J].Biomed Pharmacother,2015,70:151-157.
[8]Yuan D,Li K,Zhu K,et al.Plasma miR-183 predicts recurrence and prognosis in patients with colorectal cancer[J].Cancer Biol Ther,2015,16(2):268-275.
[9]Zhang L,Quan H,Wang S,et al.MiR-183 promotes growth of non-small cell lung cancer cells through FoxO1 inhibition[J].Tumour Biol,2015,36(10):8121-8126.
[10]Gu W,Gao T,Shen J,et al.MicroRNA-183 inhibits apoptosis and promotes proliferation and invasion of gastric cancer cells by targeting PDCD4[J].Int J Clin Exp Med,2014,7(9):2519-2529.
[11]曾宪一,陈嘉荣,任陈,等.MiR-183抑制胶质母细胞瘤放射抵抗等恶性行为[J].实用医学杂志,2015,31(24):3999-4002.
[12]Czabotar PE,Lessene G,Strasser A,et al.Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J].Nat Rev Mol Cell Biol,2014,15(1):49-63.
[13]Muller PA,Vousden KH.p53 mutations in cancer[J].Nat Cell Biol,2013,15(1):2-8.
[14]Steccanella F,Costanzo A,Petrelli F.Editorial on role of p53 in esophageal cancer from a meta-analysis of 16 studies by Fisher et al[J].J Thorac Dis,2017,9(6):1450-1452.
[15]Song HY,Deng XH,Yuan GY,et al.Expression of bcl-2 and p53 in induction of esophageal cancer cell apoptosis by ECRG2 in combination with cisplatin[J].Asian Pac J Cancer Prev,2014,15(3):1397-1401.
[16]袁丽,郭硕,曹颖,等.Bcl-2基因多态性与食管癌及癌前病变发病风险的相关性[J].肿瘤,2015,35(12):1322-1328.
[17]Lu YY,Zeng Y,Zheng JY,et al.MiR-183 regulates proliferation of SW1990 pancreatic cancer cell line by targeting PDCD4[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2016,47(5):691-696.
[18]底建敏,王梵,赵欢,等.miR-183在子宫内膜癌Ishikawa细胞中的表达及其对p53蛋白的调节作用[J].中国妇幼保健,2016,31(24):5476-5479.
