CD34+造血干细胞移植在大鼠缺氧缺血性脑病中的神经保护机制
2018-05-15周露丹范海玲王丽珍梁国安
周露丹 范海玲 王丽珍 梁国安
台州恩泽医疗中心(集团)台州医院儿内科,浙江临海 317000
新生儿缺氧缺血性脑损伤(hypoxic ischemic encephalopathy,HIE),又称新生儿缺氧缺血性脑病,主要是指围生期新生儿由各种因素导致的缺氧缺血性脑损伤综合征。新生儿缺氧缺血性脑损伤可以诱发临床新生儿的早期死亡、智能障碍、脑性瘫痪者和癫痫等不同程度的脑损伤综合征,可以造成儿童中枢神经系统严重的损害[1,2]。所以如何改善预后,提高儿童生存质量,已引起了各国政府和学者的高度重视。目前国内临床多采用维持脑内能量代谢平衡、促进神经营养因子分泌和抗神经元细胞凋亡等药物治疗结合高压氧、亚低温等综合治疗方案,并强调早期干预的重要性[3,4]。然而,这些药物虽达到了一定治疗HIE的效果,但当中枢神经系统神经元大面积损伤时,神经元的再生与突触联系明显减弱,中枢神经系统的功能难以修复。实验发现,CD34+造血细胞可以用来治疗新生儿缺氧缺血性脑病,但限于CD34+造血细胞数量限制,不能广泛应用[5,6]。本研究基于目前最新研究成果,以脐带血为研究对象,建立体外人造血干细胞(CD34+)增殖模型,筛选出能够在体外未分化状态下促进其扩增的新型小分子,以期最终获得一系列对体外扩增人CD34+造血干细胞行之有效的化合物,探讨脐血CD34+干细胞治疗新生儿缺氧缺血性脑病的效果和机制,为临床应用提供可行性依据。
1 材料与方法
1.1 扩增CD34+造血干细胞的化合物筛选与鉴定
采用密度梯度离心法结合免疫磁珠分选法获得单个核细胞,再采取MACS技术分离得CD34+造血干细胞,用FACScan检测CD34+比例,加入合成的化合物,进行体外培养14 d,继续用FACScan检测增殖水平。选取扩增倍数高、分化低的化合物SR1处理后的CD34+造血干细胞的培养,采用FACScan检测培养后细胞生物学表型变化情况,然后与缺血缺氧后的神经元细胞共培养,检测神经元细胞增殖、迁移等方面的能力。
1.2 新生鼠缺氧缺血性脑病模型的建立
选取90只7日龄SD大鼠构建大鼠缺氧缺血动物模型并随机分为三组(每组30只):对照组、模型组和治疗组。通过改良后的Rice法建立新生大鼠缺氧缺血性脑损伤模型。用6%水合氯醛腹腔麻醉新生SD大鼠(5 mL/kg),颈正中切口,结扎右侧颈总动脉,造成缺血。术后约恢复2 h将新生SD大鼠置于恒温密闭的缺氧箱中,并给予持续2 h通入 8%O2+92%N2的混合气体(气流量2 L/min),构建新生大鼠缺氧缺血性脑损伤模型。对照组给予新生SD大鼠颈总动脉分离,但不结扎,直接缝合切口并不给予缺氧处理。治疗组术后第5天行CD34+细胞移植,移植细胞数量为5×105cells/kg,选用左侧腋中线及第二乳头水平线交界点向上平移2 mm作为穿刺点,于吸气相向下向左倾斜60°进针约5 mm,回抽血液顺利,可缓慢、间歇性注入CD34+细胞。模型组大鼠经左心室注射等量的生理盐水作为对照。
1.3 HE染色和TUNEL原位凋亡细胞检测
大鼠用10%水合氯醛腹腔注射麻醉,留取脑组织常规脱水、透明及石蜡包埋,切片(5 μm/张)。常规进行苏木精和伊红液染色,观察脑组织切片HE染色结果。其余切片按照TUNEL凋亡试剂盒说明书严格操作,进行凋亡细胞检测。细胞核中有棕黄色颗粒者即为凋亡细胞,选择6个高倍镜视野进行计数凋亡细胞数平均值。
1.4 免疫组织化学法检测BDNF和NGF蛋白表达
取大鼠脑组织石蜡切片标本,室温封闭40 min(5%血清),加入单克隆抗体BDNF和NGF,碱性磷酸酶二抗4℃孵育。PBS清洗后加入SP,DAB恒温显色封片。用10×、40×物镜显微镜进行观察。BDNF和NGF的主要阳性表达表现:棕黄色颗粒在乳腺癌细胞内出现。计算乳腺癌组织中BDNF和NGF蛋白表达的平均光密度。
1.5 统计学处理
采用SPSS 22.0统计学软件进行数据处理,计量资料以均数±标准差(x±s)表示,组间差异采用单因素方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 脐血CD34+细胞的检测
用流式细胞术检测所得的脐血CD34+干细胞,结果显示CD34+干细胞的表面标志CD34的表达有明显上升,从扩增前2.9%升高到扩增后99.2%,见图1。
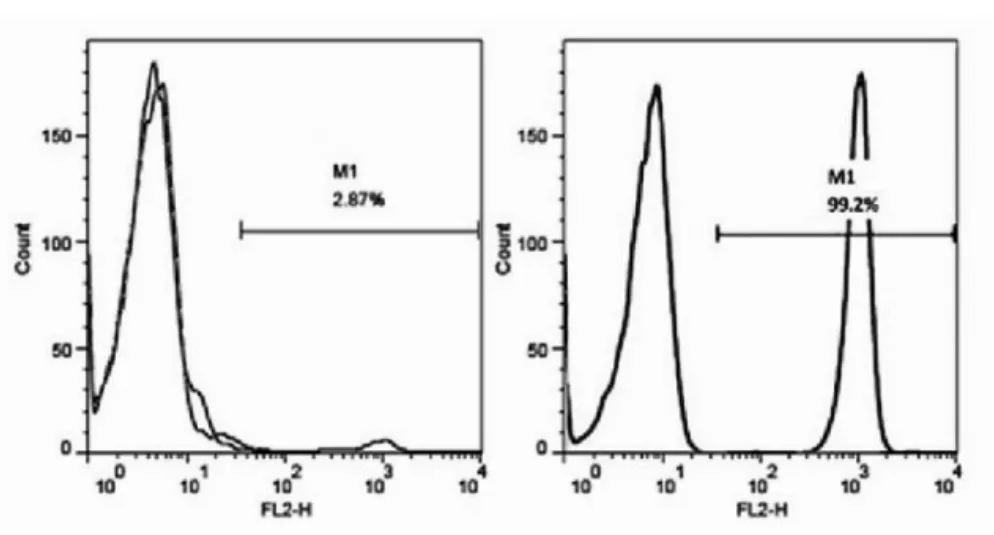
图1 流式细胞术检测所得的脐血CD34+干细胞
2.2 动物造模行为学表现
对照组新生大鼠动作正常、反应灵敏且呼吸规律,未见行为学的异常表现。模型组新生大鼠5~10 min出现明显的烦躁不安、呼吸加快加深;30 min逐渐出现四肢抖动、站立不稳、翻滚、肌肉颤动、夹尾左旋;1 h后大鼠的自主活动明显减少,皮肤发绀出现紫癜,反应差处于精神抑制状态,出现自发的左旋或夹尾左旋;眼睛延迟张眼,眼裂较小,上睑下垂。治疗组大鼠给予CD34+干细胞移植后,上述症状减轻,动物吸吮能力和精神状态恢复,四肢活动逐渐增多协调。
2.3 HE染色结果
对照组:神经细胞层次清晰,排列紧密整齐,细胞形态正常完整,结构清晰。神经细胞数量较多,细胞胞浆丰富,胞核和核仁清楚居中。模型组:术后12~48 h出现明显的细胞肿胀,形态结构不清晰,神经细胞排列紊乱,细胞间隙增宽增大;空泡变性神经元增多,胞体皱缩溶解,胞质深染核固缩;72 h出现大量神经细胞片状坏死,形成疏松空网状空洞;大量炎性细胞和胞浆嗜伊红样细胞浸润,有大量胶质细胞增生。治疗组:与相同时间点模型组相比,神经细胞损伤程度明显减轻,细胞排列尚且规则,多数神经细胞形态结构清晰正常,少量神经细胞变性坏死且存活数量较多,炎性细胞和嗜伊红样细胞浸润减少,见图2。

图2 HE染色结果(200×)
2.4 TUNEL染色结果
对照组:仅有少量凋亡阳性神经细胞散在分布,细胞核着色淡。模型组:神经细胞阳性凋亡明显增多,呈片状分布,细胞核内有棕褐色颗粒沉积,细胞体积缩小、形态不规则。治疗组:阳性神经元凋亡细胞明显减少,细胞核染色稍浅。与对照组大鼠脑组织内凋亡神经元数量(14.37±2.35)相比,模型组大鼠脑组织内凋亡神经元数量(54.62±6.38)和治疗组大鼠脑组织内凋亡神经元数量(33.19±4.23)显著上升,具有明显的统计学差异(P<0.05)。与模型组相比,治疗组大鼠脑组织内凋亡神经元数量明显降低,具有明显的统计学差异(P<0.05) ,见图 3。
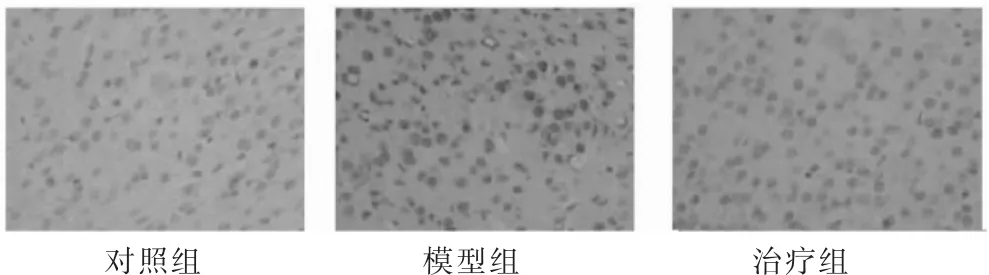
图3 TUNEL检测细胞凋亡结果(200×)
2.5 免疫组化染色结果
与对照组相比,模型组和治疗组大鼠脑组织内BDNF和NGF含量显著下降,具有明显的统计学差异(P<0.05);与模型组相比,治疗组大鼠脑组织内BDNF和NGF含量明显上升,具有明显的统计学差异(P<0.05),见图4和表1。
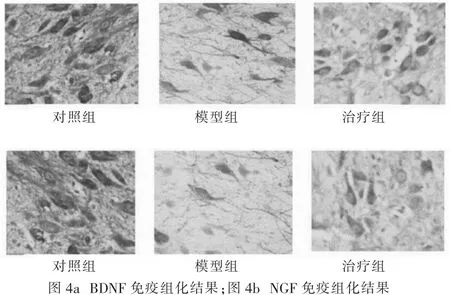
图4 免疫组织化学染色结果(400×)
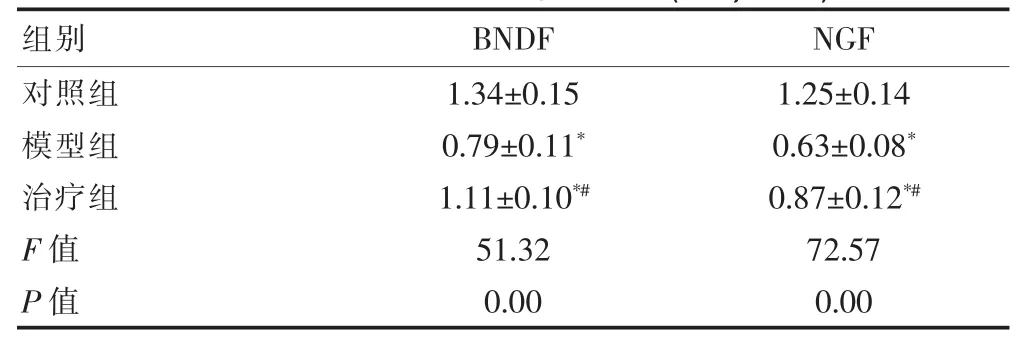
表 1 免疫组化蛋白表达含量结果(x±s,n=30)
3 讨论
近年来,随着不断深入研究神经干细胞、胚胎干细胞和造血干细胞等干细胞移植,发现干细胞移植能够在中枢神经系统缺血、变性及损伤性疾病中可发挥显著的神经再生、修复和功能重建作用,为治疗此类疾病带来了新的希望[7,8]。然而,由于胚胎干细胞和神经干细胞的安全性受到质疑、来源困难及法律、伦理学问题等原因,其进一步临床应用受到很大限制。相比之下,造血干细胞移植具备以下优势:①采集方便,给患者带来的损伤小;②来源丰富;③免疫排斥概率相对小、安全性好;④可自体移植,基本不涉及伦理问题;⑤适宜条件下能向神经元和神经胶质细胞转化;⑥能在脑组织中成活、迁移和分化[9,10]。
国内外学者已通过如密度梯度离心法、流式细胞仪分选法、磁珠分离法和细胞贴壁筛选法等各种分离培养方法培养出CD34+造血干细胞,并且把培养出的CD34+造血干细胞分化为多种组织细胞,如脂肪、骨、软骨、肌肉、肌腱和韧带、血管内皮细胞、神经元细胞、神经胶质细胞、肝细胞、皮肤干细胞、表皮细胞,用于多种疾病自体化治疗[11,12]。CD34+造血干细胞移植可以有效增强局部缺血大脑的神经可塑性效应,促进新血管的生成,增加局部缺血部位的皮质血供,参与神经组织的修复等[13,14]。本研究结果表明,模型组大鼠出现明显的烦躁不安、四肢抖动、站立不稳、夹尾左旋、眼睛延迟张眼、眼裂较小等神经和精神抑制症状。给予大鼠CD34+干细胞移植后,上述行为和精神症状减轻,动物四肢活动和精神状态明显改善,说明CD34+干细胞移植可以通过促进神经元和神经胶质细胞的分化、增殖和改善大脑内的缺血缺氧症状来有效缓解大鼠的神经和精神障碍体征。同时,本研究HE染色和TUNEL凋亡染色结果表明,给予缺血缺氧新生大鼠CD34+干细胞移植后,可以有效减少缺血缺氧新生大鼠体内神经元的损伤和凋亡发生,促进神经元细胞的再生,产生显著的抗神经细胞凋亡的作用,有效缓解神经元损伤。
脑源性神经营养因子(BDNF)属于神经性营养因子家族,主要分布在中枢神经系统,在大脑海马和皮质内的含量最高[15]。BDNF可具有维持和促进5-羟色胺(5-HT)和多巴胺(DA)能神经元细胞的生长、增殖和分化,增加神经突触的生理可塑性,修复受损神经元,改善患者学习、记忆和认知的功能作用[16,17]。神经生长因子(NGF)是一种可以调节周围和中枢神经元生长发育的神经生长因子,主要维持神经元的生存和存活、营养及促突起生长,能显著调控中枢及周围神经元的分化、发育和再生,促进神经元生理功能的特性表达,NGF具有促进再生神经功能恢复的作用[18-20]。本研究结果表明,给予缺血缺氧新生大鼠CD34+干细胞移植后,可有效增加促进脑源性神经营养因子和神经生长因子的含量表达,说明CD34+干细胞移植可以促进神经元细胞的分化、生长和再生,改善神经损伤的过程,维持神经元的生存和存活、营养,调控神经元的功能,起到神经保护作用。
综上所述,CD34+造血干细胞移植可改善脑内微环境,促进神经细胞再生,促进神经营养因子等的表达,恢复损伤的神经功能。但CD34+造血干细胞的体外扩增能力是否可控、是否产生致瘤性等都是目前研究尚没有解决的问题,仍需要临床进一步研究。
[参考文献]
[1]杨彩云,李小梅.缺氧缺血性脑病新生儿血清IL-23、IL-17水平的变化及其临床意义[J].中南医学科学杂志,2014,42(3):290-291,294.
[2]安娜,徐涛,孙清,等.电针对缺氧缺血性脑病模型大鼠mdm2表达干预研究[J].中华中医药学刊,2016,34(2):289-292.
[3]黄向东,王丹,符振立.曲克芦丁脑蛋白水解物和脑苷肌肽治疗新生儿缺氧缺血性脑病的疗效比较[J].现代药物与临床,2016,31(2):195-198.
[4]丁玉红,闫俊梅,闫静.三磷酸胞苷二钠联合鼠神经生长因子治疗新生儿缺氧缺血性脑病的疗效观察[J].现代药物与临床,2015,30(10):1268-1271.
[5]胡洁,姜藻.Endostatin基因转染人脐带血CD34+造血干细胞的实验研究[J].现代医学,2005,(3):158-161.
[6]明静,汪健,叶勖,徐慧,等.MicroRNA-214对骨髓间充质干细胞诱导脐血CD34+细胞迁移的影响[J].中国实验血液学杂志,2017,25(3):661-667.
[7]何志裕,陆东风.急性心肌梗死大鼠移植入人脐带血间充质干细胞后心肌组织检测[J].血栓与止血学,2015,21(5):262-265,269.
[8]汪亚群,刘芳洁,陈惠珍,等.EP4受体激动剂可通过激活Wnt/β-catenin信号途径促进人CD34+细胞体外增殖[J].中国实验血液学杂志,2017,25(3):656-660.
[9]孙超楠,李廷荃,王雁彬.芪芍复脉汤对大鼠下肢缺血模型CD34+细胞比例的影响[J].世界中西医结合杂志,2017,12(2):206-210.
[10]周晨虹,徐丽丽,郝秀仙,等.外周血CD34+细胞自体移植促进老年动脉粥样性缺血肢体的血管新生:前瞻性、单中心、开放性、随机对照临床试验方案[J].中国组织工程研究,2017,21(13):1998-2002.
[11]范方毅,邓锐,苏毅.CD34+自体干细胞移植联合DCCIK细胞免疫治疗复发难治性淋巴瘤疗效观察[J].解放军医药杂志,2017,29(3):15-17.
[12]张旭峰,赵琳,徐培.从p38MAPK通路探讨复方参鹿颗粒对较低危MDS骨髓患者CD34+细胞凋亡的影响[J].中国实验方剂学杂志,2017,23(16):152-157.
[13]向立丽,邱国强,谢晓宝,等.CD34+/CD38~(low/-)/CD123+细胞表达水平对急性髓系白血病预后的意义[J].中国实验血液学杂志,2017,25(1):61-65.
[14]曾晓春,高兴翠,伍伟锋,等.血管黏附分子1(VCAM-1)介导急性病毒性心肌炎小鼠CD34+VLA-4+骨髓来源细胞迁移至心肌组织[J].细胞与分子免疫学杂志,2017,33(7):881-885.
[15]蒋艳.脑出血康复期患者认知护理干预后血清中MIF和BDNF含量的影响[J].标记免疫分析与临床,2017,24(9):985-987.
[16]李春江,於国军,王晶,等.老年烧伤患者康复期抑郁评分与血清BDNF、MIF、NPY的相关性分析[J].标记免疫分析与临床,2017,24(6):673-675.
[17]姜秀云,杨帆,岳贝贝,等.中西医结合对急性脑梗死患者疗效及血清MCP-1、BDNF水平的影响[J].陕西中医,2017,38(4):423-424.
[18]王雁.CT对原发性中枢神经系统淋巴瘤的诊断价值及与病理检查的对照研究[J].检验医学与临床,2016,13(18):2653-2656.
[19]牟荣芳,张荣艳,贾智育.3种不同方式治疗小儿难治性癫痫的临床疗效及安全性分析[J].检验医学与临床,2017,14(1):77-79.
[20]窦超,张敏,赵源征,等.甲状腺激素T3对大鼠脑缺血再灌注损伤后NGF和BDNF表达的影响研究[J].重庆医学,2017,46(15):2030-2033.
