艾司西酞普兰对MPTP诱导的帕金森病小鼠模型的神经保护作用及其机制研究
2018-05-15程招弟刘清华
程招弟 刘清华
1.山西医科大学,山西太原 030001;2.山西省大同市第五人民医院神经内科,山西大同 037000
帕金森病是继阿尔茨海默病后第二位常见的神经退行性疾病,主要的病理学特征是黑质致密部多巴胺能神经元不可逆的丢失和路易小体的形成。至今所有的治疗手段都仅限于控制症状,不能阻止或延缓多巴胺能神经元的退行性改变[1,2]。5-羟色胺(5-HT)由肠道中的肠嗜铬细胞合成,其受体在脑中分布广泛,张淑静等[3]及Lindenbach D等[4]均研究证实,5-HT微量注射可以增强神经元的兴奋性,缓解PD的行为异常,Nicholson SL等[5]研究结果显示,5-HT受体与PD的治疗密切相关。但5-HT无法透过血脑屏障,脑中的5-HT几乎完全来源于中缝核的神经细胞所分泌,此产生量有限。所以,寻求一种外源性可以激活黑质及纹状体区5-HT受体的药物非常重要。
艾司西酞普兰是一个高选择性5-HT受体再摄取抑制剂,可以通过血脑屏障,主要被用来治疗抑郁症,王燕娟等[6]在艾司西酞普兰对AD的研究中发现,艾司西酞普兰可促进受损脑区神经元的增生、迁移,支持新生神经细胞的发育,同时具有抗炎、抑制tua蛋白的形成,从而延缓AD的进展。张建斌等[7]对大鼠脑缺血再灌注损伤模型进一步研究显示,草酸艾司西酞普兰可以明显减轻脑缺血再灌注大鼠的神经损伤和改善神经功能,具有神经保护作用。在帕金森病模型中尚未有研究,推测其在帕金森病小鼠模型中同样具有神经保护作用,为帕金森病的治疗提供可能的思路。
1 材料与方法
1.1 材料来源
40只8周龄的SPF级雄性C57BL/6小鼠(SCXC-2014-004),动物房温度维持在20℃~22℃,湿度 30%,小鼠保持12 h昼夜节律,自由饮食。
1.2 实验试剂
MPTP 购于 Sigma公司,兔抗鼠 TH、BDNF、IL-1β一抗及BSA试剂盒、BCA封闭液、ECL化学发光液、二抗等均购于博士德公司。
1.3 实验仪器
疲劳式转棒仪购于山东科技有限公司;采用莱卡自动组织脱水机;BIO-RAD的电泳仪、转膜仪;美国Themro酶标仪;Bio-Rad凝胶成像系统等。
1.4 实验方法
1.4.1 实验分组及模型制备 将小鼠随机分为4个组:生理盐水组 [0.9%NaCl 0.2 mL/(只·d)ip];MPTP模型组[MPTP 25 mg/(kg·d) ip];艾司西酞普兰组[艾司西酞普兰 10mg/(kg·d) ip];治疗组[MPTP 25 mg/(kg·d),半小时后注射艾司西酞普兰 10 mg/(kg·d)]。 所有的注射均开始于每天清晨8时,连续注射7 d。
1.4.2 行为学检测 滚轮实验:滚轮实验主要用于检测小鼠的运动平衡能力,设置转速为 20 r/min,时间为3 min,适应 3次后,将小鼠放于静止的转轴上,启动转棒仪并开始计时,从转轴开始转动到小鼠掉落计为总时间。
1.4.3 免疫组化 每组选取6只小鼠用4%的多聚甲醛进行心脏灌注,切取中脑脑组织,进行梯度脱水,石蜡包埋。黑质区连续冠状切片,片厚设置为 5 μm,脱蜡,高压抗原修复,滴加抗体TH(1:200),4℃孵育过夜,后进行二抗孵育,37℃,30 min。DAB显色,苏木素浸染1~2 min,盐酸酒精分化2 s,流水冲洗返蓝。梯度酒精脱水,二甲苯透明,甘油封片。使用Scanscope数字病理扫描系统,在放大200倍视野下,分别随机选取黑质区6张非重叠区域的脑片进行拍摄,后采用Image,Proplus图像分析软件进行阳性细胞计数,外侧部和腹内侧部随机选择3个高倍视野,计数TH阳性细胞数目,取平均值。
1.4.4 Western blot每组剩余的4只小鼠采用颈椎脱臼法处死小鼠,开颅取脑留中脑部分用于Western blot检测,组织剪碎后加入RIPA裂解组织,4℃离心,取上清,蛋白浓度测定。计算上样量,配制等浓度、等体积蛋白液,金属浴100℃煮蛋白(10 min),冷却后电泳。电泳完成后半干转转膜,设置电流为膜面积×2.5 mA,恒流转膜30~45 min。5%脱脂奶粉室温封闭1 h。加一抗BDNF、IL-1β于4℃冰箱摇床孵育过夜。次日,二抗室温摇床孵育2 h。将ECL显色液1:1混合后,反应1 min后放入显像仪中显影。
1.5 统计学方法
应用SPSS17.0软件对所得实验数据进行统计学分析,计量资料均采用均数±标准差(x±s)表示,符合正态分布的多组间比较采用单因素方差分析。显著性检验水准取ɑ=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 行为检测
小鼠在3 min滚轮实验中记录到的第一次掉落的时间,并重复三次的平均值。腹腔注射MPTP后,小鼠在滚轮上的时间明显减少(49.5±19.2)s,与对照组相比差异显著(P=0.000),单纯注射艾司西酞普兰组与对照组相比无差异,艾司西酞普兰治疗组与MPTP组相比,时间延长至(91.0±16.4)s (P=0.000)。说明艾司西酞普兰可以部分逆转MPTP所造成的C57小鼠平衡能力的缺损(图1)。
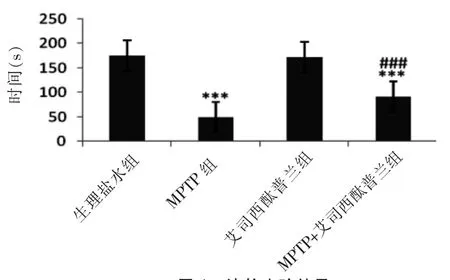
图1 滚轮实验结果
2.2 免疫组化检测黑质致密部区TH的表达
2.2.1 TH的表达 生理盐水对照组,黑质区见大量TH阳性表达,腹腔注射MPTP后,黑质区TH阳性细胞数量明显减少,差异显著(57±18.12)(P=0.001)。 注射艾司西酞普兰后TH阳性细胞数明显高于MPTP组(73.2±14.85)(P=0.016),说明艾司西酞普兰可以增加黑质区TH的表达(图2)。
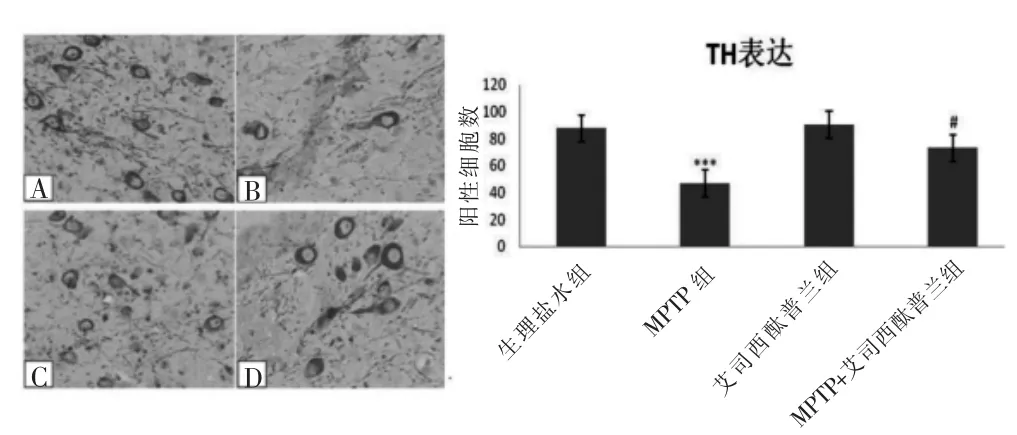
图2 黑质区TH阳性表达免疫组化染色及统计分析结果
2.2.2 Westernblot检测BDNF、IL-1β的表达 Western blot检测结果如图3所示,经Image lab软件扫描处理并进行统计学分析后,结果显示:与对照组相比,MPTP组黑质区的BDNF的表达显著降低,同时IL-1β的表达显著升高。而与MPTP组相比,艾司西酞普兰组BDNF的表达显著增高,IL-1β的表达显著降低,该结果表明,在 MPTP诱导的PD模型,应用艾司西酞普兰可通过上调脑源性神经营养因子、下调IL-1β炎性因子的表达来发挥神经保护作用。

图3 中脑IL-1β及BDNF表达Western blot及统计分析结果
3 讨论
目前帕金森病的治疗主要以补充外源性多巴胺为主要手段,但副作用大,且不能延缓黑质区多巴胺能神经元退行性变,故寻求新的具有神经保护作用的药物尤为重要。MPTP是目前公认的制备帕金森病小鼠模型的药物[8],本实验采用MPTP腹腔注射制备C57小鼠PD模型,具有明显的行为学改变,免疫组化结果显示,MPTP注射后,黑质区TH的表达下调明显,说明MPTP可造成多巴胺能神经元缺失,并且Western blot结果显示,黑质区IL-1β的含量增多,分析MPTP造成的多巴胺能神经元的损伤与炎症反应增多有关。
以往研究表明,增加5-HT的表达,可以改善帕金森病的症状[9-11]。脑内微量注射5-羟色胺可以增加神经元兴奋性,缓解PD的行为异常[12]。并且5-HT受体在脑内广泛分布,其中 5-HT1A、5-HT1B及5-HT2C受体与PD的发病及治疗具有相关性[13],但由于脑部合成量少,又难通过血脑屏障,故应用受限。
本实验研究的艾司西酞普兰是一个高选择性5-HT受体再摄取抑制剂,可以通过血脑屏障,具有神经保护作用。王燕娟等[6]在艾司西酞普兰对AD的研究中发现,在阿尔茨海默病的动物中,SSRI可促进神经元的增生,支持新生神经细胞的发育,并且研究发现可以促神经营养因子的表达。本次实验中,艾司西酞普兰治疗组与MPTP模型组相比,脑源性神经营养因子BDNF的表达上调明显,与以往研究结果相一致,说明艾司西酞普兰具有促神经营养因子分泌的功能。
BDNF是NGF家族的一种,可以增加纹状体GABA神经元的存活,并且可以调节突触活性和神经递质的合成,其减少可导致PD的发病[14]。给予外源性BDNF可以改善阿尔茨海默病及帕金森病的临床症状。本研究结果显示,艾司西酞普兰可促进BDNF分泌,为PD的治疗提供了一个新的可能。
Avraham SL等[15]的研究显示,在大鼠脑缺血再灌注损伤模型中草酸艾司西酞普兰可以明显减轻脑缺血再灌注大鼠的神经损伤和改善神经功能,且药物干预的效果随着时间的推移而逐步增强。本实验结果显示,在滚轮实验中,经艾司西酞普兰治疗后,小鼠在滚轮上停留的时间明显延长,说明给予艾司西酞普兰腹腔注射后可以部分逆转由MPTP所致的PD小鼠的行为异常。黑质区TH免疫组化染色显示,与MPTP模型组相比,艾司西酞普兰组上调TH的表达,TH是合成多巴胺的关键的限速酶,说明艾司西酞普兰通过促进TH的表达从而进一步促进多巴胺的合成。此外,本次研究结果显示艾司西酞普兰可以下调促炎因子IL-1β的表达,说明其具有抗炎作用。
综上所述,艾司西酞普兰对MPTP诱导的帕金森病小鼠模型具有神经保护作用,其作用是通过抑制炎症、促进营养因子分泌来实现的。
[参考文献]
[1]Orimo S.New development of diagnosis and treatment for Parkinson's disease.Rinsho shinkeigaku[J].Clinical Neurology,2017,57(6):259.
[2]Moors TE,Hoozemans JJ,Ingrassia A,et al.Therapeutic potential of autophagy-enhancing agents in Parkinson’s disease[J].Molecular Neurodegeneration,2017,12(1):11.
[3]张淑静,陈蕾.苍白球微量注射5-HT对帕金森病模型大鼠旋转行为影响[J].青岛大学医学院学报,2009,45(4):319-321,324.
[4]Lindenbach D,Palumbo N,Ostock CY,et al.Side effect profile of 5-HT treatments for Parkinson's disease and L-dopa-induced dyskinesia in rats[J].British Journal of Pharmacology, 2015,172(1):119-130.
[5]Nicholson SL,Brotchie JM.5-hydroxytryptamine(5-HT,serotonin)and Parkinson's disease-opportunities for novel therapeutics to reduce the problems of levodopa therapy[J].European Journal of Neurology,2015,9(s3):1-6.
[6]王燕娟,任庆圃,张志祇.SSRI类抗抑郁剂在阿尔茨海默病中的应用研究进展[J].东南大学学报(医学版),2014,33:504-508.
[7]张建斌,李晓慧.草酸艾司西酞普兰对大鼠脑缺血再灌注损伤的 神经保护作用[J].中国生化药物杂志,2014,34(7):9-13.
[8]Langston JW.The MPTP story[J].Journal of Parkinsons Disease,2017,7(Suppl 1):S11.
[9]Huot P,Sgambato-Faure V,Fox SH,et al.Serotonergic approaches in Parkinson's disease:Translational perspectives,an update[J].Acs Chemical Neuroscience,2017,8(5):973.
[10]Rampello L,Chiechio S,Raffaele R,et al.The SSRI,citalopram,improves bradykinesia in patients with Parkinson's disease treated with L-dopa[J].Clinical Neuropharmacology,2002,25(1):21-24.
[11]Huot P,Sgambatofaure V,Fox SH,et al.Serotonergic approaches in Parkinson’s disease: Translational perspectives, an update[J].Acs Chemical Neuroscience, 2017,8(5):973.
[12]Wang S,Zhao Y,Gao J,et al.In vivo effect of a 5-HT receptor agonist on 5-HT neurons and GABA interneurons in the dorsal raphe nuclei of sham and PD rats[J].American Journal of Alzheimers Disease&Other Dementias,2017,32(2):73.
[13]Andrzejewski K,Kaczyńska K,Zaremba M.Serotonergic system in hypoxic ventilatory response in unilateral rat model of Parkinson’s disease[J].Journal of Biomedical Science,2017, 24(1):24.
[14]Tome D,Fonseca CP,Campos FL,et al.Role of neurotrophic factors in Parkinson's disease[J].Current Pharmaceutical Design,2017,23(5):809-838.
[15]Avraham Y,Davidi N,Lassri V,et al.Leptin induces neuroprotection neurogenesis and angiogenesis after stroke.[J].Current Neurovascular Research,2011,8(4):313-322.
(收稿日期:2017-11-17)
