不同标本保存条件对人类免疫缺陷病毒核酸鉴别试验的影响
2018-05-14黄力勤刘正敏
孙 婧 黄力勤 刘正敏 王 瑞
核酸检测(nucleic acid amplification testing,NAT)因其对病毒检测的高度特异性和灵敏度,目前已成为采供血机构血液筛查中最为有效的检测技术,并得到了广泛的推广和应用。根据国家卫生计生委颁布的“血站技术操作规程(2015版)”[1]中对核酸检测的规定,进行核酸检测的标本应在72 h内进行检测。然而,由于Ultrio Plus核酸检测试剂的特殊性,分为人类免疫缺陷病毒(human immunodeficiency virus,HIV)、丙型肝炎病毒(hepatitis C virus,HCV)和乙型肝炎病毒(hepatitis B virus,HBV)联合检测和鉴别检测,血站实验室一般可在72 h内完成联合检测并发放报告,但对于鉴别检测,各血站进行检测的时限不尽相同,有时会因为一些特殊原因需要将标本保存较长时间才能进行核酸鉴别检测。然而,目前尚未对于核酸鉴别检测前标本保存条件的研究,尤其缺乏低病毒载量标本的保存条件的研究,因此,本研究选取3倍检测限(limit of detection,LOD)和0.5倍LOD两种浓度的HIV-1弱阳性标本,通过评估不同保存温度和保存时间下鉴别检测的阳性率,来确定核酸鉴别检测前合理的标本保存条件。
1 材料和方法
1.1 检测试剂
Ultrio Plus HIV-1鉴别检测试剂(美国Grifols公司,批号:156796,有效期:2018.02.15)。
1.2 标本来源
采用60 IU/ml(3倍LOD)和5 IU/ml(0.5倍LOD)的两组HIV-1阳性样本各6支,每支3 ml。样本为世界卫生组织(World Health Organization,WHO)10/152标准品稀释(北京康彻斯坦公司)。
1.3 实验仪器
TIGRIS核酸检测系统(美国Grifols公司)。
1.4 实验方法
按照常规血液检测流程对60 IU/ml和5 IU/ml的HIV-1 WHO标本进行核酸HIV-1 RNA鉴别检测,每支样品检测5次,每种浓度的样品共检测30次,计算两组标本的HIV-1阳性检出率。再将两组标本分别放置在在4 ℃、-20 ℃和-80 ℃冰箱内,分别在保存1 d、3 d和7 d时取出,进行与上述方法相同的30次核酸检测,并计算HIV-1阳性检出率,以0 d保存标本的阳性检出率作为对照。
1.5 统计学方法
利用SPSS 19.0统计软件对标本保存温度和时间对HIV-1鉴别检测阳性检出率的影响进行x2检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 保存条件对3倍LOD HIV阳性标本鉴别检出率的影响
结果显示,3倍LOD HIV阳性标本即在4 ℃、-20 ℃和-80 ℃条件下保存7 d,可以100%检出。
2.2 保存条件对0.5倍LOD HIV阳性标本鉴别检出率的影响
(1)0.5倍LOD HIV-1阳性标本在3种不同温度下保存1 d后,阳性检出率基本保持不变;保存3 d后,4 ℃和-20 ℃条件下的标本阳性检出率已明显开始下降,下降程度达5%以上,甚至4 ℃条件的标本检出率已降至50%以下,而此时-80 ℃条件的标本阳性检出率仍未出现明显改变;到了第7 d,只有-80 ℃条件下的标本阳性检出率仍维持在50%以上,而其余两种温度条件下标本阳性检出率已降至50%以下。
(2)在4 ℃、-20 ℃和-80 ℃下保存0.5倍LOD HIV-1阳性标本7 d,3种温度条件下标本的阳性检出率均明显下降,仅-80 ℃条件下阳性检出率与0 d对照一致,仍为56.67%,并且以4 ℃条件下标本阳性检出率下降最为显著,该保存温度保存7 d相对于0 d对检出率的影响差异有统计学意义(x2=4.34,P<0.05);而-20 ℃和-80 ℃两个温度下标本检出率虽有不同程度的下降,但差异无统计学意义(x2=1.67,x2=0.00;P>0.05),见表1。
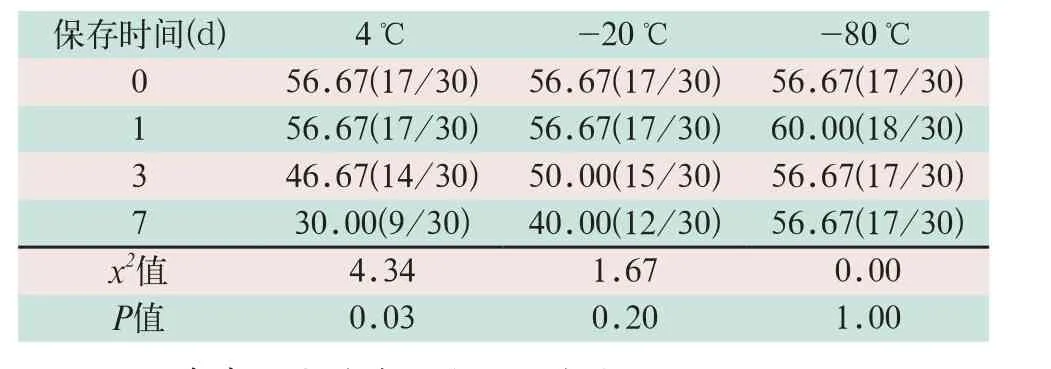
表1 5 IU/ml(0.5倍LOD)HIV阳性标本在不同保存温度和时间下检出率[%(次)]
3 讨论
血液核酸检测是直接对病原体核酸进行提取、扩增和检测等一系列检测技术的总称,具有对病原体检测灵敏度和特异性高,且能有效缩短病毒感染后检测“窗口期”等特点[2-4]。根据国家标准“全血及成分血质量要求”[5]的规定,对临床用血进行HBV、HCV和HIV等病原体的筛查检测时,除常规的免疫学检测外还需进行病毒的核酸检测。由于血液在离开人体后,血液内的病毒核酸物质经过长时间放置之后会逐渐降解,当病毒载量降至核酸检测试剂的最低LOD甚至更低时,有可能会被漏检[6-8]。因此“血站技术操作规程(2015版)”[1]规定,核酸检测应在72 h内进行。但是在实际的血液筛查工作中,应用Ultrio Plus试剂的实验室,需在72 h内完成核酸联检后,还需进行鉴别检测才能最终判定标本所携带的病原体类型。而对于鉴别检测前的保存条件却无统一的认识,血站根据其试剂使用和联检阳性率选择进行鉴别检测间隔时间。此外,虽然核酸联检阳性标本将进行报废处理,但最终的鉴别检测结果将影响后续对献血者的追踪工作。目前,对核酸标本检测前保存条件的研究报道仅限于对联检检测前的研究,尚无对鉴别检测前保存条件的研究和报道[9-11]。
本研究以HIV RNA为代表研究标本保存条件对鉴别检测的影响,其原因为:①HIV RNA相对HCV RNA和HBV DNA稳定性差,易受环境因素的影响,具有代表性[10];②因目前只有HIV感染的献血者由疾病控制部门进行追踪,这依赖于鉴别检测结果,具有现实意义。此外,本研究重点分析了鉴别前保存条件对低病毒载量HIV RNA的影响,而对高载量HIV病毒已有相关研究[9,12]。
本研究中,首先分析了环境因素对3倍LOD的低载量HIV病毒标本的影响,60 IU/ml(3 LOD)的标本进行核酸检测,在3种温度条件下放置7 d后仍然能100%被检出,表明这3种保存温度保存7 d并无明显影响标本的病毒载量,这与文献中的实验结果一致[7,12]。同时,本研究将极低浓度(5 IU/ml,0.5 LOD)HIV-1标本同样在3种不同的温度下放置了7 d,核酸检测的结果与3倍LOD的标本截然不同。Procleix Utrio Plus试剂说明书标示的50%检出限所需的病毒浓度为4.7 IU/ml(95%置信区间4.0~5.7 IU/ml),因此,理论上5 IU/ml浓度的血清标本,核酸检测的阳性检出率应该在50%左右。检测结果显示,在初始条件下,所有标本的阳性检出率均在50%以上,与Procleix Utrio Plus Assay产品说明及文献报道的实验结果较为一致[13]。在经过1 d的保存之后,所有标本的阳性检出率均未出现明显的下降。保存了3 d之后,3组检测结果出现了一些差异,4 ℃条件下保存的标本阳性检出率已略<50%,而其余两个温度下检出率均在50%以上,并且4 ℃和-20 ℃条件下标本阳性检出率的下降幅度已>5%,4 ℃内的标本检出率已降至50%以下,而-20 ℃内的标本仍能维持50%的检出率,表明病毒载量极低的标本在-20 ℃以下的条件下保存3 d再进行鉴别检测,并不会明显影响检出效率,但保存在4 ℃条件下则可能会导致漏检率的升高。然而,保存7 d之后,仅-80 ℃条件下保存的标本阳性检出率仍能保持在50%以上,其他两组标本均未达到50%的检出率,并且4 ℃条件下将鉴别标本保存7 d对其阳性检出率的影响具有统计学意义,表明保存在该温度下会造成阳性检出率明显地下降。而-20 ℃条件下标本阳性检出率也已经下降到50%以下,下降幅度>15%,因此-20 ℃的条件也并不适合将鉴别检测的标本保存7 d。实验结果表明,鉴别检测标本若需要保存7 d,则保存于-80 ℃的条件下更为合适。
根据本次检测主要考虑鉴别检测前保存的时间和温度条件是影响其阳性检出率的主要因素,而这两种因素影响检出率的原因可能主要是因为在较高温度和长时间的保存中,极低浓度的HIV病毒核酸稳定性较差,更容易降解,造成浓度进一步降低以致于应用常规的核酸检测试剂和系统检测富集不到足够拷贝数的病毒核酸,则检测系统将其判定为非反应性。因此,尽管核酸检测能比酶免方法在病毒感染后更短的时间内检测到病毒核酸,但是对低病毒载量的标本仍有漏检的风险,可能酶免检测与核酸检测相结合的方式更有利于保障血液的安全[12-15]。影响鉴别检测结果的除标本的保存温度和时间外,可能还有保存的试管、标本离心的时间和转速等其他许多因素,尚需要进一步研究和探讨。
采用60 IU/ml的HIV-1标本保存7 d,鉴别检测的阳性检出率均为100%,表明3倍LOD以上浓度的HIV-1标本无论在何种温度放置7 d均可完全被检出。但是5 IU/ml的低浓度HIV-1标本,在4 ℃和-20 ℃放置7 d会严重影响鉴别检测的检出率,而-80 ℃的温度条件下将鉴别标本放置7 d后阳性检出率并未明显下降,表明-80 ℃的条件更有利于低浓度的鉴别检测标本进行长时间保存,使阳性标本能有效地被检出,从而更有效地保障血液安全。
参考文献
[1]国家卫生计生委.国卫医发(2015)95号血站技术操作规程(2015版)[S].国家卫生计生委,2015-12-17.
[2]吴丹霄,吴亚玲,吕杭军.核酸检测在献血筛查中的应用[J].浙江预防医学,2015,27(5):501-503.
[3]任芙蓉.血液核酸检测技术[J].北京医学,2008,30(10):624-627.
[4]莫丕立,吴军军,马联.核酸检测技术在采供血机构中的应用[J].中国输血杂志,2011,24(9):821-824.
[5]中华人民共和国卫生部,GB 18469-2012全血及成分血质量要求[S].中国国家标准化管理委员会,2012-05-11.
[6]Gessoni G,Barin P,Valverde S,et al.Biological qualification of blood units:considerations about the effects of sample`s handling and storage on stability of nucleic acids[J].Transfus Apher Sci,2004,30(3):197-203.
[7]Baleriola C,Johal H,Jacka B,et al.Stability of hepatitis C virus, HIV,and hepatitis B virus nucleic acids in plasma samples after long-term storage at -20℃ and -70℃[J].J Clin Microbiol,2011,49(9):3163-3167.
[8]黄力勤,查祎,姚凤兰,等.无偿献血人群HIV检测结果多样性分析[J].中国输血杂志,2016,29(5):505-508.
[9]Amellal B,Murphy R,Maiga A,et al.Stability of HIV RNA in plasma specimens stored at different temperatures[J].HIV Med,2008,9(9):790-793.
[10]Bruisten SM,Oudshoorn P,Van Swieten P,et al.Stability of HIV-1 RNA in blood during specimen handling and storage prior to amplification by NASBA-QT[J].J Virol Methods,1997,67(2):199-207.
[11]Salles NA,Levi JE,Barreto CC,et al.Human immunodeficiency virus transfusion transmission despite nucleic acid testing[J].Transfusion,2013,53(10pt 2):2593-2595.
[12]姚凤兰,陈瑜,汪德海,等.标本保存温度、时间和不同采血管对核酸检测结果的影响[J].中国输血杂志,2012,25(6):530-532.
[13]刘旭映,王淏,梁浩坚,等.新一代核酸检测试剂Procleix Ultrio Plus Assay的使用情况分析[J].国际检验医学杂志,2017,38(3):419-421.
[14]臧晓东,臧传邦,宋雪梅.血站酶联免疫检测联合核酸检测降低输血传播疾病残余风险的效果分析[J].中国卫生检验杂志,2016,26(3):373-374.
[15]霍宝锋,张天弼,刘智敏,等.无偿献血者血液标本行核酸检测对降低经血传播HIV的风险评估[J].中国医药科学,2017,7(10):229-231.
[16]苏武锦.中国无偿献血人群HIV感染状况及防控策略[J].现代医药卫生,2017,33(4):541-543.
