作物模型中单叶最大光合作用速率的温度响应修订
2018-05-14杨沈斌徐莎莎江晓东石春林王应平申双和
杨沈斌 徐莎莎 江晓东, 石春林 王应平 申双和
作物模型中单叶最大光合作用速率的温度响应修订
杨沈斌1徐莎莎2江晓东1,3石春林3王应平4申双和1
1南京信息工程大学气象灾害预报预警与评估协同创新中心 / 南京信息工程大学应用气象学院, 江苏南京 210044;2扬州市气象局, 江苏扬州 225009;3江苏省农业科学院, 江苏南京 210014;4CSIRO Marine and Atmospheric Research, PMB # 1, Aspendale, Victoria 3195, Australia
作物的光合作用对温度变化敏感, 其温度依存性随品种、生长环境的变化而改变。基于光效率模型的作物生长模型, 在应用中很少对光合作用的温度影响参数值进行订正, 且在全生育期使用相同的参数值, 难免会增加干物质模拟的误差。为此, 本文以ORYZA2000模型为例, 提出了一种修订光合作用温度影响参数值的方法。为确定方法的有效性, 结合2012年和2013年水稻品种两优培九的温度梯度控制实验, 首先利用抽穗开花期光合作用观测曲线提取了不同温度水平的光合作用参数值, 然后结合Arrhenius方程和Peaked方程建立了温度敏感性参数的温度影响方程。将这些方程代入机理性光合作用模型, 模拟了单叶最大光合作用速率与温度的曲线关系。最后, 以归一化后的曲线关系修订作物模型参数值, 并利用两年地上部分生物量(WAGT)观测值对其验证。结果显示, 两优培九单叶最大总光合作用速率随温度的变化关系不同于ORYZA2000的默认设置, 修订后的最适温度为38~40°C, 高于默认值。在10~20°C的低温段, 修订后的温度影响系数低于默认值。从模拟值的相对误差看, 修订后较修订前平均降低约3.3%。本研究为改进干物质模拟精度和分析不同品种光合作用的温度依存性提供了重要参考。
温度依存性; 物候期; 干物质积累; 气候变暖; 参数值订正
温度是影响作物光合作用进程的主导因素[1]。研究显示, 作物光合作用速率的温度依存性主要表现为单峰型曲线, 即从下限温度至最适温度为加速上升, 从最适温度到上限温度则相反。这种光合作用速率的温度依存性还与作物种类、所处生长环境密切相关[2]。因此, 针对特定品种, 研究其光合作用速率与温度的依存性, 并将其定量化用于作物生长量的模拟及温度影响分析具有重要的意义。
Medlyn等[1]曾结合多种植被类型的光合观测数据和Farquhar等[3]提出的机理性光合作用模型, 探讨了C3作物光合作用的温度依存性, 并建立了针对不同类型植物的最大羧化速率和RuBP再生速率的温度影响函数。类似的还有Warren和Dreyer[4]有关光合作用的温度影响研究。该研究采用10°C到35°C之间6个温度梯度下的叶片光合作用数据, 结合Arrhenius方程[5]反推了最大羧化速率和RuBP再生速率温度影响方程参数值。Leuning[6]通过类似的研究发现, 当叶片温度<30°C时, 最大羧化速率和RuBP再生速率随温度的变化品种间差异微小, 而当高于该温度后, 两者的温度依存性表现出明显的品种差异。同样基于Farquhar等[3]提出的光合作用模型, Borjigidai等[7]利用开放式CO2增效试验, 研究了水稻光合作用温度依存性的季节性特征, 并通过重建光合作用与温度的响应关系确定了最大光合作用速率的最适温度。从上述研究可以看出, 结合机理性光合作用模型可以针对特定品种建立光合作用生物学参数的温度依存函数, 并利用该函数评估温度变化对光合作用的影响。然而, 机理性光合作用模型参数众多, 实现过程复杂, 在作物模型中较少得到采用[3,8]。
现有的作物模型, 如AquaCrop[9]、CERES[10]、WOFOST[11]、APSIM[12]、ORYZA2000[13]等, 在模拟作物光合作用时多采用基于双曲线方程、指数方程的光效率模型[14]。该类模型不但简单易用, 还考虑了温度、叶片氮素含量、叶片水分等因素的影响, 并通过建立这些因素的影响方程计算作用系数, 以乘积形式作用于潜在速率变量上, 定量表示这些因素对光合作用的影响程度。模型中温度对光合作用速率的影响主要作用在最大光合作用速率和表观量子效率上, 其影响系数值通常来自参数文件中定义的温度影响系数查找表。从已有研究看, 鲜有介绍该温度影响系数查找表来源或构建方法的报道。因此, 在实际应用中, 一般默认模型中已有的参数值, 使其应用于整个生育期和所有品种。何亮等[15]通过WOFOST作物模型参数敏感性分析发现, 生育期为1.5时的最大光合速率参数敏感性较高。刘建栋等[16]曾对FAO (Food and Agriculture Organization)生产力模型中的光合作用参数验证显示, 该模型默认的光合作用模式参数值在特定区域作物生长模拟上存在较大偏差, 因此, 对参数值进行修订有助于提高模拟精度和模拟结果的针对性。
由于温度是影响作物光合作用速率的主导因素,在气候变化日益凸显的情况下, 温度对作物生产潜力的影响备受关注[17-18]。为了更好地模拟温度变化对作物光合作用的影响, 本文拟以ORYZA2000模型[13]为例, 结合两年的水稻温度梯度控制实验, 验证该模型中最大光合作用速率模拟模块的温度影响参数, 提出针对特定品种的参数修订方法。通过这项研究, 将为作物模型中光合作用温度影响参数的本地化提供方法参考。
1 数据与方法
1.1 ORYZA2000模型中单叶光合作用速率的模拟
ORYZA2000模型是由国际水稻研究所与荷兰瓦赫宁根大学联合开发的、具有较强机理性的一种水稻作物模型, 已在亚洲的大多数水稻种植国家得到广泛应用[13,18-20]。与其他同类水稻作物模型相似, ORYZA2000模型能够模拟潜在生产、水分胁迫和氮素胁迫下的水稻生育期进程、干物质积累和分配、叶面积和产量形成, 并估算出最终产量。在模拟水稻干物质积累方面, 该模型首先计算到达水稻冠层上方的光合有效辐射(PAR); 然后采用高斯积分法将冠层在垂直方向上划分为3层, 并根据光在冠层内的传输和分布, 分别计算各层阳叶和阴叶比例以及各自吸收的PAR; 随后, 应用基于负指数方程的光效率模型, 分别计算瞬时阴、阳叶总CO2同化速率, 并积分得到整个冠层瞬时的总CO2同化量; 最后, 在时间上同样采用高斯积分法, 将瞬时冠层总CO2同化量按权重系数累积求和, 再与当日天文日长求积得出一天整个冠层的总CO2同化量。在上述计算过程中, 瞬时单叶总光合作用速率的推算采用了公式(1)。

式中,L为单叶瞬时总CO2同化速率(kg CO2hm–2leaf h–1),m为光饱和条件下的单叶最大总CO2同化速率(kg CO2hm–2leaf h–1),表示初始光能利用率,a为吸收的PAR (W m–2leaf)。对于m的计算, 在ORYZA2000模型中考虑了环境CO2浓度、叶片氮含量和白天平均温度的影响。当叶片氮含量≥0.5 g N m–2leaf时, 模型采用公式(2)推算不同温度和CO2浓度下的m。
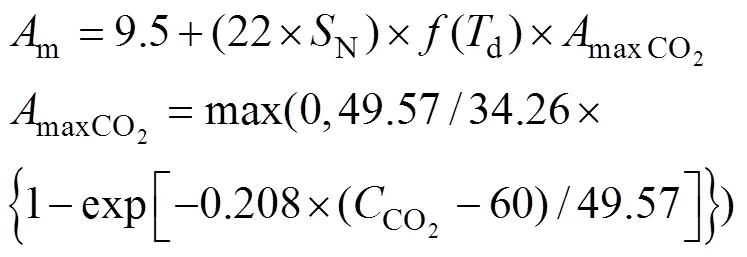
式中,N表示单位叶片面积含氮量(g N m–2leaf),(d)为温度影响函数,d表示白天平均温度,CO2表示环境CO2浓度(µmol mol–1)。当叶片氮含量低于0.5 g N m–2leaf时, 采用公式(3)推算m。

式中, AmaxCO2的计算同公式(2)。在公式(2)和(3)中, =f(Td)取值来自ORYZA2000的作物参数文件(CROP.DAT), 参数名为REDFTT, 该参数值以类似查找表的形式列出, 默认取值如图1所示, 在20~37°C之间f(Td)=1, 表明该温度区间为最适温度, 即该区间内单叶光合作用不受温度变化的影响, 而10~20°C之间f(Td)从0到1线性增加, 37~43°C之间则从1到0线性减少。低于10°C或高于43°C时单叶光合作用受到彻底抑制。
从公式(2)可以看出,max CO2仅是环境CO2浓度的函数。在固定CO2后,m的变化仅与N和(d)有关。假设水稻叶片氮含量在一段时期内的变化可以忽略, 那么m随温度的变化曲线线型与(d)的线型一致, 即在20~37°C之间的温度变化不会导致m的增减。图2分别显示了m随温度的变化曲线和不同温度下L随a的变化曲线。其中, 图2-a假设a=1000 W m–2leaf,N=0.7,CO2=400 µmol mol–1。图2-b则设置3个不同温度水平, 模拟了各水平下a从0到600 W m–2leaf下L的变化。在绘制L曲线时,的取值来自作物参数文件中的EFFTB默认值, 即在10°C至40°C之间随温度升高从0.54线性降至0.36。从图中可以看出,m与(d)线型一致。与m相似,L同样表现出对温度变化的敏感。尽管在39°C的=0.37, 低于15°C时的0.51, 但15°C时的光合作用水平依旧低于39°C, 表明低温对单叶总CO2同化速率的影响较高温段明显。
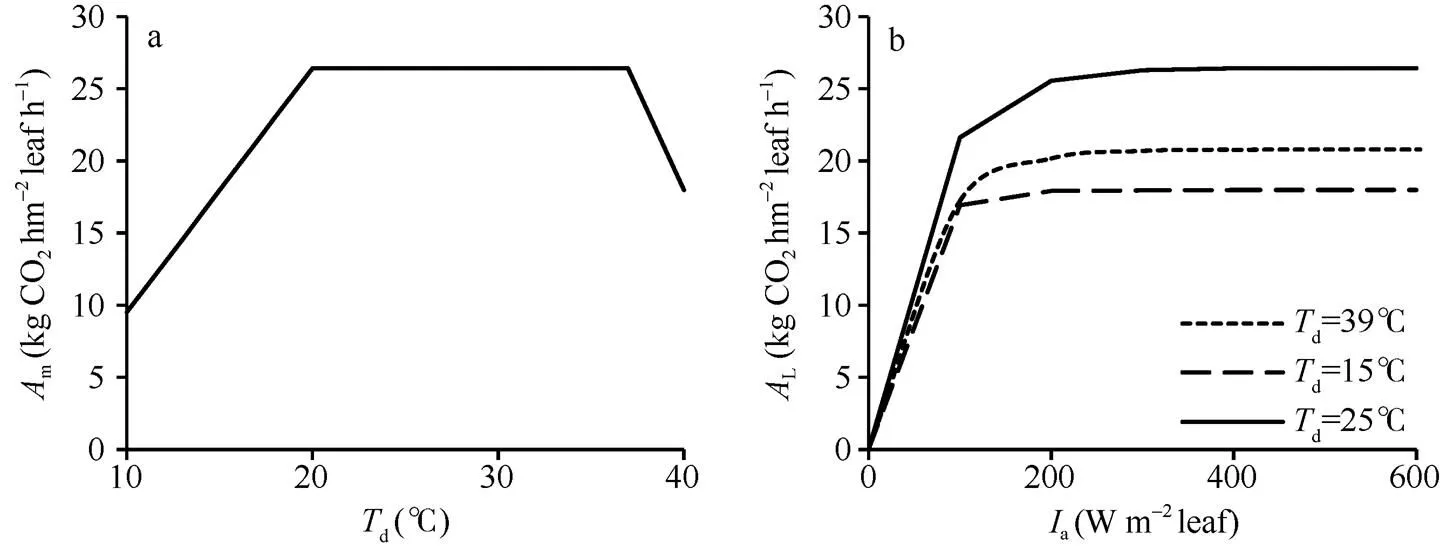
图2 Am随温度的变化(a)和不同温度下AL随Ia的变化(b)曲线
假设a=1000 W m–2leaf,N=0.7 g N m–2leaf,CO2=400 µmol mol–1。
It is assumed thata=1000 W m–2leaf,N=0.7 g N m–2leaf,CO2=400 µmol mol–1.
1.2 光合作用参数与温度的依存性
ORYZA2000模型在模拟瞬时单叶光合作用速率时, 从两个方面引入了温度影响, 一个是在模拟单叶最大总光合作用速率m时引入了参数REDFTT, 另一个是在单叶总光合作用速率L模拟方程中, 作为参数之一的初始光能利用率与温度存在一定关系, 并在作物参数文件中以参数名EFFTB列出相关系数值。尽管ORYZA2000模型没有明确这些参数值的确立依据, 但在实际应用中已被广泛采纳。为了明确这些参数值的确立依据, 将结合Farquhar等[3]提出的机理性光合作用模型和观测数据, 从实验资料中获取模型中光合作用参数与温度的函数关系, 最终从理论上推算出叶片光合作用速率随温度的变化关系。
Farquhar等[3]提出了针对C3植物的光合作用模型。该模型从Rubisco活性限制和RuBP再生能力限制两方面解释光合作用过程。Rubisco活性限制描述的是受CO2浓度制约时光合作用速率c与胞间CO2浓度(i)的关系。

当描述光合作用速率(j)受RuBP再生的制约时, 其关系表达为:

式中,cmax表示最大羧化速率(µmol m–2s–1),表示RuBP再生速率(µmol m–2s–1),c(µmol mol–1)和o(mmol mol–1)分别表示羧化作用和加氧作用的Michaelis-Menten常数, Γ*为不含暗呼吸的CO2补偿点(µmol mol–1),i表示胞间O2浓度, 一般为稳定值210 mmol mol–1。在实际条件下, 公式(5)中与入射光合有效辐射存在如下关系:

式中,max表示最大RuBP再生速率(µmol m–2s–1),表示为表现量子效率,表示量子产量(mol mol–1)。最后, 实际净光合作用速率n(µmol m–2s–1)表达为:

式中,d表示暗呼吸速率(µmol m–2s–1)。
经研究表明[1,3,6], 该模型中的c、o、cmax、max、d、Γ*等参数与叶温存在一定的关系。其中,c(µmol mol–1)o(mmol mol–1)与叶温的变化关系可采用Arrhenius方程表达:
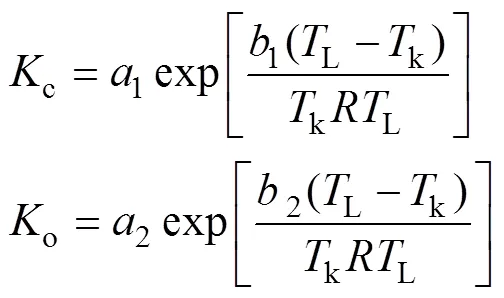
式中,1、1和2、2分别为方程系数, 其中1和2分别代表参考温度k下的c和o值, 这里参考温度k设置为298(K),L为叶片温度(K),为气体常数8.3143 (J mol–1K–1)。
对于cmax、max和d则采用Peaked方程表示:
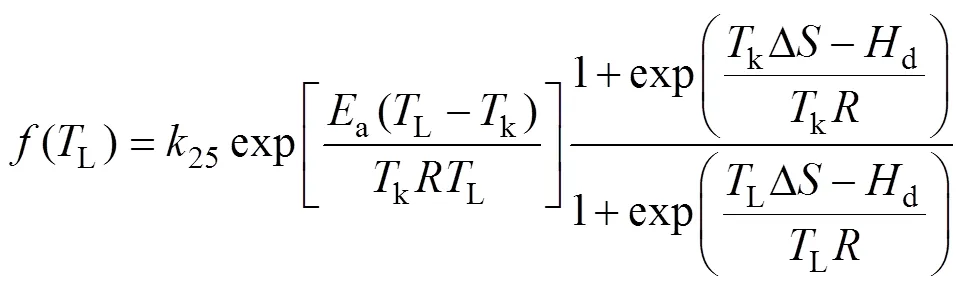
式中,25为参考温度25°C时的最大速率,a、Δ和d分别为方程系数。d描述了在最适温度以上时的衰减率, Δ代表了熵,a为方程系数。
Γ*与叶温变化的关系主要通过如下表达式反映:

式中,omax为最大氧气羧化速率。由于omax/cmax≈ max气, 与温度无关, 因此, Г*与叶温度的变化关系主要由c和o的关系决定。
在上述生物学参数中,c和o与叶温之间的关系属于Rubisco酶的本质属性, 因此水稻品种间该特征的差异不明显, 但不同水稻品种cmaxmaxd与温度的关系存在差别, 因此在实际应用中需要针对特定品种获取这些生物学参数的值[1-3,5]。
1.3 实验数据
本文以2012年和2013年水稻品种两优培九的分播期大田试验资料和人工气候控制实验数据为依据, 分析该品种的单叶光合作用速率与温度的关系, 并确定该品种c、o、cmax、maxd与温度的函数关系, 绘制单叶光合作用速率与温度的变化曲线。
2012年和2013年水稻大田试验情况见文献[21-22]所述。在2年各7个播期的大田试验中, 主要观测了水稻生育期进程、生物量、叶面积、茎蘖动态、籽粒灌浆进程、产量结构和产量。在大田试验期间, 还开展了人工气候控制实验。2012年分别于5月31日和6月10日, 2013年于5月30日和6月6日移栽秧苗至PVC塑料盆钵中, 移栽时秧龄均为4.5叶。盆钵长和宽均为28 cm, 高为30 cm, 下部封底。移栽前1周向盆钵装土至4/5高度, 并随后灌水静置。在移栽前, 搅拌土壤使中上层土壤松软。每盆栽种2穴, 每穴1株。移栽后, 将盆钵放入大田, 使盆钵内土层顶部与大田土层表面大体平齐。盆钵灌水、施肥、喷药等处理与大田管理保持一致。
待水稻生长至抽穗开花期, 将盆钵从大田移至4个人工气候箱内进行控温处理。每批3~4个处理, 每个处理在气候箱内放置5盆。温度处理采用平均温度15~45°C, 每5°C为一个梯度, 白天12 h和夜间12 h温度为平均温度±温度°C。人工气候箱内采用的是红白光源, 在空箱时测得的平均光强为530 µmol m–2s–1。每个处理持续5 d, 从第3天开始, 陆续从每个处理中挑选3~5片剑叶, 使用3台LI-6400光合仪对叶片的光响应曲线和CO2响应曲线进行了观测。测量时根据所处的温度梯度控制样本室叶片温度, 另外, 在光响应曲线测定中, 参考CO2浓度固定在395 µmol mol–1, 光强梯度设置为1800、1600、1400、1200、1000、800、600、400、300、200、100、80、60、30、0 µmol m–2s–1。在CO2响应曲线测定时, 光强固定在1400 µmol m–2s–1, 参考CO2浓度梯度设定为400、300、200、60、200、300、400、600、800、1000、1300、1600 µmol mol–1。
1.4 研究方案
针对特定的水稻品种, 以图3显示的技术方案对ORYZA2000模型中单叶最大总光合作用速率与温度的关系(d)进行修订。首先, 采用PHOTOSYNTHESIS.EXE程序[23], 从观测的不同温度梯度下各条光响应曲线和CO2响应曲线中提取各自的特征参数值; 在此基础上, 分析该品种光合作用的生物学特性, 并结合公式(8)和(9), 对c、o、cmaxmax和d的温度关系进行拟合, 获取各自函数中的参数值。将这些参数值代入到Farquhar等[3]提出的光合作用机制模型中, 模拟单叶总光合作用速率随叶温的变化曲线。然后, 根据空气温度与叶温的关系, 对曲线进行修订, 并对修订后的曲线进行归一化, 替换ORYZA2000模型作物参数文件中的REDFTT参数值。最后, 采用2012年和2013年两优培九的分播期地上部分生物量观测数据对修订后的光合作用模型进行验证, 通过比较修订前后生物量模拟值与观测值的差异, 确认修订方案的有效性。

图3 修订方案
2 结果与分析
2.1 不同温度下叶片的光合作用速率曲线
图4显示了不同温度处理下两优培九剑叶的光响应曲线和CO2响应曲线。从图中可以看出, 两类曲线都表现出明显的温度响应特征。如图4-a显示, 平均温度30°C下的净光合作用水平最高, 其次为平均温度35°C处理下的, 而15°C处理下的净光合作用水平最低, 在光强1200 μmol m–2s–1处, 比30°C下相应位置净光合速率低约60%, 表明该低温水平在较大程度上已影响到叶片的光合作用能力。对于其他温度处理下的, 其在接近光饱和点的净光合作用速率, 相比30°C处理下的平均低30%~50%。图4-b则显示了各温度处理水平下, 净光合作用速率随胞间CO2浓度的变化。从图中可以看出, 平均温度15°C和20°C处理下的叶片净光合作用速率水平较低, 其中15°C处理下的处于最低水平, 其最大净光合作用水平低于16.1 µmol m–2s–1。在所有温度处理中, 平均温度35°C和40°C处理下的叶片净光合作用速率水平最高, 其次为45°C处理, 30°C和25°C处理下的净光合作用速率水平相当, 但低于45°C处理下的结果。
2.2 叶片光合作用特征与温度的关系
根据不同温度梯度下两优培九剑叶光响应曲线和CO2响应曲线的观测结果, 采用PHOTOSYNTHESIS.EXE从曲线中提取了光合作用特征参数值。从图5可以看出, 光饱和点随着温度处理水平的增加, 呈现逐步增加再降低的趋势, 在35°C处理下, 光饱和点达到最大, 平均超过1500 µmol m–2s–1, 而在15°C处理下, 平均光饱和点低于1250 µmol m–2s–1, 且标准差最大。该结果表明, 两优培九对强光的利用能力在35°C左右达到最大。相比光饱和点, 光补偿点随温度处理水平的变化未表现出明显的趋势, 但大体上, 光补偿点在一定范围内随着温度升高而升高。15°C处理下光补偿点最低, 平均低于2 µmol m–2s–1。40°C处理下光补偿点最高, 平均达到14.4 µmol m–2s–1。从最大光合作用速率随温度处理水平的变化看, 25°C、30°C和35°C处理水平下的平均最大光合作用速率相近, 达到24 µmol m–2s–1左右, 且明显高于其他温度处理。15°C处理下的最大光合作用速率低于13 µmol m–2s–1。由于最大光合作用速率表示的是叶片潜在的最大光合能力, 可见低温对叶片的光合作用不利。表观量子效率是在弱光条件下光量子的转化效率, 一般取值在0.03~0.05之间[1]。

图4 不同温度梯度下两优培九在抽穗开花期剑叶的光响应曲线(a)和CO2响应曲线(b)
从图5-d可以看出, 表观量子效率随着温度处理水平的提升, 呈现逐步下降的变化趋势, 表明高温环境会抑制低光下光量子的转化效率。图5-e显示d在所有温度处理下其平均值均小于0.8 µmol m–2s–1。但其值随温度处理水平的升高, 主要呈增加趋势。在35°C水平及以上处理时,d降低。研究显示,d对温度变化敏感, 在温度水平较低时, 呼吸作用酶活性下降, 代谢变慢, 因此暗呼吸速率降低, 但随着温度的升高, 呼吸消耗呈非线性增大。
从图6中可以看出,c、o和G*与L的散点关系完全符合各自特定的函数, 这主要是由于c和o与L的关系与观测品种无关, 属于Rubisco酶的本质属性, 同时G*与L的关系又主要由c和o决定, 因此, 上述散点关系符合各自特定函数。cmax和max与L的散点关系各自表现出不同的特征。cmax与L的散点关系表现出随L的增加而近似线性增加,max与L的散点关系表现为随L的增加而增加, 但当L接近35°C后,max几乎不再增加。尽管两者与L的变化表现出不同的规律, 但两者比值(max/cmax)与L呈现出几乎线性的关系, 即随L的增加而减小, 变化在0.5~3.5间, 其斜率为-0.0813, 表明cmax与max之间存在显著的相关性。图6-f显示了d随L的变化, 两者散点关系相对离散, 但大体呈现出非线性的变化特征, 即随L的增加而非线性增加。当L在约42°C时, 叶片d几乎约为15°C下L的5倍。
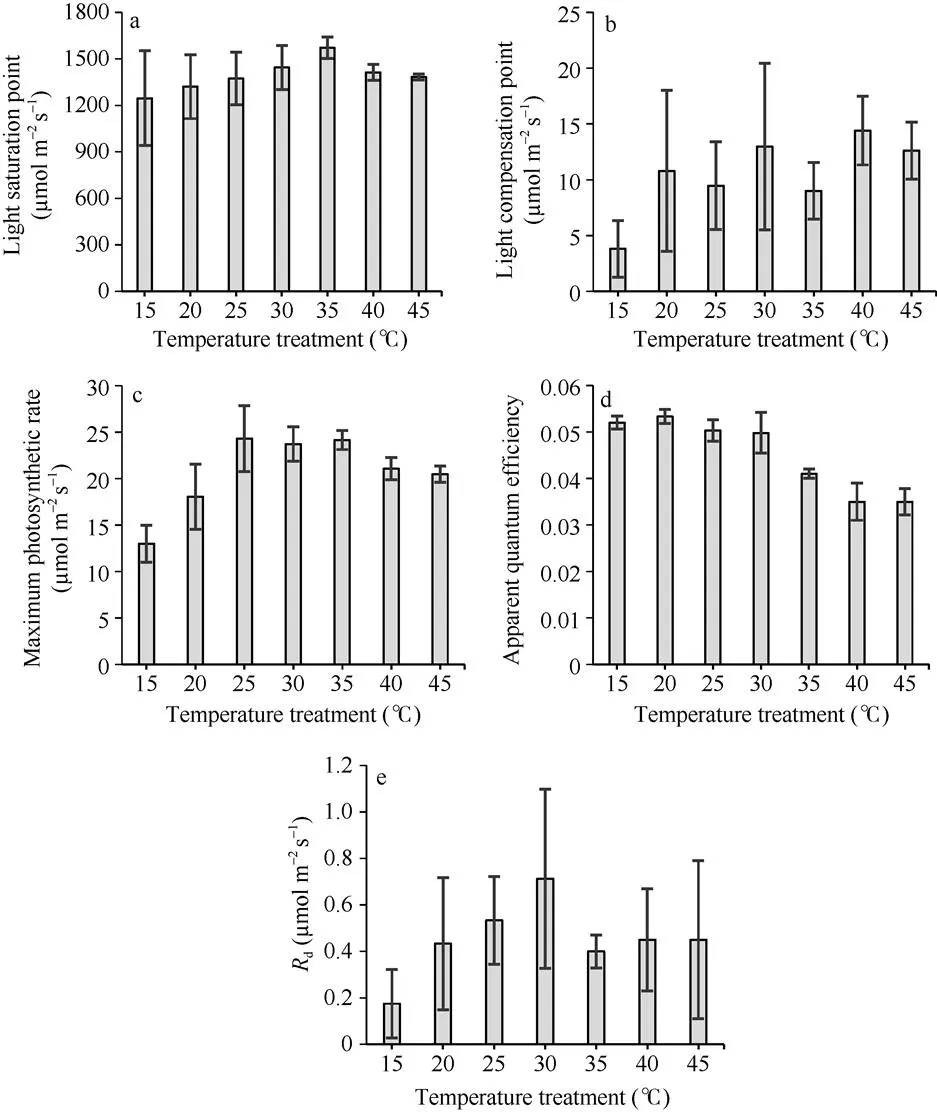
图5 从光响应曲线中提取的水稻光合作用特征参数值随温度处理的变化
(a)为光饱和点; (b)为光补偿点; (c)为最大光合作用速率; (d)为表现量子效率; (e)d。图中柱状图数值为平均值, 竖线表示标准差。
(a) Light saturation point; (b) Light compensation point; (c) Maximum photosynthesis rate; (d) Apparent quantum efficiency; (e)d. Mean values with standard deviations (vertical bars) are shown in the bar charts.
2.3 叶片光合作用速率的温度响应
依据公式(8)和(9), 采用最小二乘法确定了c、o、cmax、max、d与L的关系, 获取了如表1所列的各方程参数值。将确定的各参数温度关系方程代入Farquhar等[3]光合作用机理模型, 模拟了PAR达到1400 μmol m–2s–1, 胞间CO2浓度为340 μmol mol–1下n和n+d随L的变化(图7)。同时还模拟了PAR为1400 μmol m–2s–1, 胞间CO2浓度从320 μmol mol–1到400 μmol mol–1, 每20 μmol mol–1一个间隔下的n和n+d随L的变化(图8)。
从图7可以看出,n随L的变化呈先增大后减小的“钟型”曲线, 最适温度出现在约31°C, 此时n约为19.6 µmol m–2s–1。当n曲线叠加d曲线后, 得到n+d随L的变化曲线, 即总光合作用速率随叶温的变化曲线, 其曲线线型类似于n, 但其最适温度向更高的方向偏移, 约在38°C, 此时n+d的值约为24.9 µmol m–2s–1。可见随着L的升高呼吸增加的速率比净光合作用速率快, 使得总光合作用速率的最适温度高于净光合作用速率。从图8可以看出,n和n+d的曲线水平都随着i的增加而增加, 但仅n的最适温度出现随i的增加向后推移的现象, 即在对应的i浓度下,n的最适温度分别出现在约31°C、31°C、32°C、32°C和33°C, 而n+d的最适温度在各i浓度下均约为38°C, 未表现出明显的变化。

图6 从CO2响应曲线中提取的水稻光合作用特征参数值随叶温的变化
(a)cando; (b)cmax; (c)max; (d)max/cmax; (e)G*; (f)d.

表1 光合作用特征参数的温度影响方程参数值

图7 An、Rd和An+Rd随TL的变化
模拟设定光合有效辐射(PAR)为1400 μmol m–2s–1, 胞间CO2浓度(i)为340 μmol mol–1。
Assuming PAR=1400 μmol m–2s–1,i=340 μmol mol–1.
2.4 参数订正及验证
在图7中显示了n+d随L的变化, 即单叶在饱和光强下总光合作用速率随叶温的变化规律。然而, ORYZA2000模型为总光合同化速率m与d建立了函数关系。这里d为白天平均温度, 其计算方法为日最高温度与日平均温度的平均。考虑到在固定环境CO2浓度和叶片氮含量N条件下, 公式(2)可简化为m与d的线性函数关系:m=×(d) + 9.5, 其中为斜率。因此, 根据观测时叶温L与空气温度a的经验关系(图9), 对L进行了转换, 获取n+d与a的曲线关系, 并对其进行归一化, 替换由(d)表示的温度影响系数表。图9-b显示了归一化后的(a)。在a接近40°C时,(a)达到1.0。当a为13.9°C时,(a)为0。
将归一化后的(d)从14°C开始至44°C, 每隔2°C生成温度影响系数列表赋值给参数REDFTT。为了验证参数修订的有效性, 对REDFTT参数值替换前后地上部分生物量的模拟结果进行了比较。验证数据为2012年和2013年两优培九地上部分生物量(WAGT)观测数据。在验证前, 对两优培九的生育期参数、干物质分配系数、相对叶面积增长速率、茎秆存留系数、比叶面积系数等均进行了标定[21-22]。然后, 利用定标后的ORYZA2000模型, 以潜在生长模式模拟了逐日WAGT, 最后用与观测日期对应的模拟值(WAGTsim)和实测值(WAGTobs)计算相对误差e, 公式为:

图8 不同Ci浓度下An、Rd和An+Rd随TL的变化
模拟设定光合有效辐射(PAR)为1400 μmol m–2s–1。Assuming PAR=1400 μmol m–2s–1.

图9 从观测中获取的叶温TL与空气温度Ta的关系曲线(a)和随空气温度Ta变化的温度影响系数曲线(b)

图10显示了REDFTT参数值替换前后WAGT模拟值与实测值的对比。从图10可以看出, 修改前各播期的re平均值都高于修改后的, 表明对REDFTT参数值进行订正能够有效降低CO2同化量的模拟误差, 且修订前后所有播期WAGT的模拟误差在配对样本T检验中均表现出0.05水平的显著性差异。据统计, 2012年所有播期re平均降低约4%, 2013年则平均降低约2.5%。尽管降低的幅度相对较小, 但依旧说明对光合作用模型的温度影响参数进行调整有助于改进模型模拟的精度。
(a) 2012年; (b) 2013年。竖线表示标准偏差。
(a) for 2012; (b) for 2013. Vertical bar is standard deviation.
3 讨论
温度影响光合作用中的最大羧化速率、RuBP再生速率、暗呼吸速率等生物学参数, 建立这些参数的温度影响函数对定量分析和模拟单叶光合作用速率随温度的变化具有重要意义, 同时还可以通过该方法确立特定水稻品种单叶最大光合作用速率的“三基点温度”。从本文的研究结果看, 在当前大气CO2浓度水平下, 两优培九单叶最大净光合作用速率在饱和光强下的最适温度约为31°C, 且随胞间CO2浓度的增加有微小的增高; 同样环境下, 最大总光合作用速率的最适温度约为38°C, 与胞间CO2浓度变化关系不明显。依据最大总光合作用速率与温度的关系, 修订了ORYZA2000模型中最大光合作用速率温度影响参数的参数值。从修订前后地上部分生物量模拟结果对比看, 提出的修订方法对干物质积累的模拟精度有一定的提高。
然而, 值得提出的是, 本文仅对抽穗开花期的情况进行了分析, 对于其他生育期的情况缺乏相应的观测数据。有文献显示[24], 叶片光合作用速率随叶片生理年龄的变化而变化, 因此, 在ORYZA2000模型中, 对全生育期采用一套相同的温度影响参数, 潜在增加了模拟结果的不确定性, 可能是导致修订后相对误差e减小幅度有限的主要原因。考虑到不同生育期光合作用速率对温度变化的响应不同, 因此, 增加其他关键生育期叶片光合作用的观测有助于完善作物模型中的光合作用模拟模块。另外, 在结合机理性光合作用模型建立最大总光合作用速率与温度的关系时, 暗呼吸速率的计算方程不同于ORYZA2000模型中维持性呼吸速率的计算方程[25]。在ORYZA2000模型中, 维持性呼吸速率的计算采用的是幂指数函数, 且用于整个水稻冠层呼吸速率的计算, 不同于单叶暗呼吸速率的计算方程。从两个方程归一化后的曲线线型看, 也存在一定的差异。因此, 潜在影响了参数修订后模拟结果的精度。
后续研究将尝试在作物模型中引入机理性光合作用模型。例如, 采用耦合方法将双叶大叶模型替换作物模型中的光效率模型, 替换后不但能够从机制上模拟叶片到冠层的光合作用速率, 还能够更准确地模拟环境因子, 如温度、湿度、风和CO2浓度等对作物光合作用的影响。因此, 本文提出的叶片光合作用数据分析方法和温度影响参数修订方法, 为后续研究提供了重要的基础。另外, 本研究所选水稻品种单一, 未考虑不同水稻品种的差异, 因此在后续研究中, 还将针对更多代表性品种进行光合作用参数的定标。
4 结论
结合不同温度梯度下的水稻光合作用数据和机理性光合作用模型, 建立了针对特定水稻品种单叶最大光合作用速率的温度影响曲线, 并利用该曲线关系对水稻作物模型ORYZA2000中相应的参数值进行了订正。本文提出的修订方法具有一定的有效性。尽管修订后的相对误差减小幅度平均低于5%, 但对基于光效率模型的温度影响参数本地化处理提供了重要的技术参考, 也为分析和提取不同品种光合作用的温度依存性特征提供了依据。
[1] Medlyn B E, Dreyer E, Ellsworth D, Forstreuter M, Harley P C, Kirschbaum M U F, Le Roux X, Montpied P, Strassemeyer J, Walcroft A, Wang K, Loustau D. Temperature response of parameters of a biochemically based model of photosynthesis. II. A review of experimental data., 2002, 25: 1167–1179
[2] 阿里穆斯, 于贵瑞. 植物光合作用模型参数的温度依存性研究进展. 应用生态学报, 2013, 24: 3588–3594 Almaz B J, Yu G R. Temperature dependence of parameters of plant photosynthesis models: a review., 2013, 24: 3588–3594 (in Chinese with English abstract)
[3] Farquhar G D, Caemmerer S, Berry J A. A biochemical model of photosynthetic CO2assimilation in leaves of C3species., 1980, 149: 78–90
[4] Warren C R, Dreyer E. Temperature response of photosynthesis and internal conductance to CO2: results from two independent approaches., 2006, 57: 3057–3067
[5] Thornley J H M, France F. Mathematical Models in Agriculture: Quantitative Methods for the Plant, Animal and Ecological Sciences, 2nd edn. Wallingford: CABI Publishing, 2007
[6] Leuning R. Temperature dependence of two parameters in a photosynthesis model., 2002, 25: 1205–1210
[7] Borjigidai A, Hikosaka K, Hirose T, Hasegawa T, Okada M, Kobayashi K. Seasonal changes in temperature dependence of photosynthetic rate in rice under a free-air CO2enrichment., 2006, 97: 549–557
[8] 莫兴国, 刘苏峡, 林忠辉. 基于SVAT模型的冬小麦光合作用和蒸散过程研究. 应用生态学报, 2002, 13: 1394–1398 Mo X G, Liu S X, Lin Z H. Simulating photosynthesis and evapotranspiration of winter wheat with a SVAT model., 2002, 13: 1394–1398 (in Chinese with English abstract)
[9] Steduto P, Hsiao T C, Raes D, Fereres E. AquaCrop—The FAO crop model to simulate yield response to water: I. Concepts and underlying principles., 2008, 101: 426–437
[10] Timsina J, Humphreys E. Performance of CERES-Rice and CERES-Wheat models in rice-wheat systems: a review., 2006, 90: 5–31
[11] Boogaard L H, Van Diepen C A, Rotter R P, Cabrera J C M A, Van Laar H H. User’s Guide for the WOFOST 7.1 Crop Growth Simulation Model and WOFOST Control Center 1.5. Wageningen: DLO Winand Staring Centre, 1998
[12] Holzworth D P, Huth N I, deVoil P G, Zurcher E J, Herrmann N I, McLean G, Chenu K, Van Oosterom E J, Snow V, Murphy C, Moore A D, Brown H, Whish J P M, Verrall S, Fainges J, Bell L W, Peake A S, Poulton P L, Keating B A. APSIM—Evolution towards a new generation of agricultural systems simulation., 2014, 62: 327–350
[13] Bouman B A M, Van Laar H H. Description and evaluation of the rice growth model ORYZA2000 under nitrogen-limited conditions., 2006, 87: 249–273
[14] 钱莲文, 张新时, 杨智杰, 韩志刚. 几种光合作用光响应典型模型的比较研究. 武汉植物学研究, 2009, 27: 197–203 Qian L W, Zhang X S, Yang Z J, Han Z G. Comparison of different light response models for photosynthesis., 2009, 27: 197–203 (in Chinese with English abstract)
[15] 何亮, 侯英雨, 赵刚, 邬定荣, 于强. 基于全局敏感性分析和贝叶斯方法的WOFOST作物模型参数优化. 农业工程学报, 2016, 32(2): 169–179 He L, Hou Y Y, Zhao G, Wu D R, Yu Q. Parameters optimization of WOFOST model by integration of global sensitivity analysis and Bayesian calibration method., 2016, 32(2): 169–179 (in Chinese with English abstract)
[16] 刘建栋, 周秀骥, 于强. FAO生产潜力模型中基本参数的修正. 自然资源学报, 2001, 16: 240–247 Liu J D, Zhou X J, Yu Q. Modification of the basic parameter in FAO productivity model., 2001, 16: 240–247 (in Chinese with English abstract)
[17] Lobell D B, Gourdji S M. The influence of climate change on global crop productivity., 2012, 160: 1686–1697
[18] 杨沈斌, 申双和, 赵小艳, 赵艳霞, 许吟隆, 王主玉, 刘娟, 张玮玮. 气候变化对长江中下游稻区水稻产量的影响. 作物学报, 2010, 36: 1519–1528 Yang S B, Shen S H, Zhao X Y, Zhao Y X, Xu Y L, Wang Z Y, Liu J, Zhang W W. Impact of climate change on rice production in the middle and lower researches of the Yangtze River., 2010, 36: 1519–1528 (in Chinese with English abstract)
[19] Yadav S, Li T, Humphreys E, Gill G, Kukal S S. Evaluation and application of ORYZA2000 for irrigation scheduling of puddled transplanted rice in north west India., 2011, 122: 104–117
[20] Li T, Angeles O, Marcaida III M, Manalo E, Manalili M P, Padanielson A, Mohanty S. From ORYZA2000 to ORYZA (v3): an improved simulation model for rice in drought and nitrogen-deficient environments., 2017, 237/238: 246–256
[21] 杨沈斌, 江晓东, 王应平, 申双和, 石春林, 王萌萌, 陈斐. 基于Richards扩展方程提取水稻灌浆结实光温特性参数. 作物学报, 2014, 40: 1792–1802 Yang S B, Jiang X D, Wang Y P, Shen S H, Shi C L, Wang M M, Chen F. Characterizing light and temperature effects on rice grain filling using extended Richards equation., 2014, 40: 1792–1802 (in Chinese with English abstract)
[22] 王萌萌, 杨沈斌, 江晓东, 王应平, 陈德, 黄维, 于庚康, 石春林. 光温要素对水稻群体茎蘖增长动态影响的分析及模拟. 作物学报, 2016, 42: 82–92 Wang M M, Yang S B, Jiang X D, Wang Y P, Chen D, Huang W, Yu G K, Shi C L. Analysis and simulation of impact of light and temperature on rice tillering., 2016, 42: 82–92 (in Chinese with English abstract)
[23] Long S P, Bernacchi C J. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error., 2003, 54: 2393–2401
[24] Jones H G. Plants and Microclimate, 2nd edn. Cambridge: Cambridge University Press, 1992
[25] Amthor J S. The role of maintenance respiration in plant growth., 1984, 7: 561–569
Correcting the Response of Maximum Leaf Photosynthetic Rate to Temperatures in Crop Models
YANG Shen-Bin1, XU Sha-Sha2, JIANG Xiao-Dong1,3, SHI Chun-Lin3, WANG Ying-Ping4, and SHEN Shuang-He1
1Collaborative Innovation Center on Forecast and Evaluation of Meteorological Disasters / College of Applied Meteorology, Nanjing University of Information Science & Technology, Nanjing 210044, Jiangsu, China;2Yangzhou Meteorological Bureau, Yangzhou 225009, Jiangsu, China;3Jiangsu Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China;4CSIRO Marine and Atmospheric Research, PMB # 1, Aspendale, Victoria 3195, Australia
Crop photosynthesis is sensitive to temperature variations, and the temperature dependence of photosynthesis is known to vary with growth environments and crop varieties. Crop models based on light use efficiency model, seldom correct parameter values related to the temperature dependence of photosynthesis for a specific crop, which unavoidably increases the simulation errors in dry biomass. In this paper, a scheme used to correct those parameter values was put forward with the rice crop model ORYZA2000 as an example to evaluate the scheme’s performance. The temperature-controlled experiments were conducted to observe photosynthesis at heading stage of rice variety Liangyoupeijiu in 2012 and 2013. The data were first analyzed to retrieve photosynthetic characteristics from light response curves and CO2response curve. Based on their relationship with temperatures, temperature effect functions were established for all temperature sensitive photosynthetic parameters using Arrhenius and Peaked functions. A biochemical photosynthesis model was applied to simulate the changes of maximum leaf photosynthetic rate with temperatures, based on which temperature response curve for maximum leaf photosynthetic rate was produced and normalized to replace the default parameter values in ORYZA2000. The observations of above ground biomass (WAGT) of Liangyoupeijiu in two years were used to validate simulations before and after the correction. The normalized temperature response curve for maximum leaf photosynthetic rate of Liangyoupeijiu was different from the default response curve in ORYZA2000. From the corrected response curve, the optimal temperature for photosynthesis was between 38-40°C, higher than the default, and temperature effect coefficient was lower than the default between 10-20°C. Compared with the default parameter values, average relative error of the corrected parameter values was reduced by 3.3%. In conclusion, the method used in this paper can be an important reference for improving biomass simulation accuracy and analyzing temperature dependence of photosynthesis for different crop varieties.
temperature dependence; phenology; dry biomass; climate warming; parameter value correction
2017-11-15;
2018-03-15;
2018-03-16.
10.3724/SP.J.1006.2018.00750
本研究由国家公益性行业(气象)科研专项(GYHY201306035, GYHY201306036)和国家“十二五”科技支撑计划项目(2011BAD32B01)资助。
This study was supported by Special Fund for Meteorology-scientific Research in the Public Interest (GYHY201306035, GYHY201306036) and Key Projects in the National Science & Technology Pillar Program during the Twelfth Five-year Plan Period (2011BAD32B01)。
E-mail: jaasyang@163.com, Tel: 025-58731165
http://kns.cnki.net/kcms/detail/11.1809.S.20180316.1339.010.html
