非临床生物技术药物免疫原性分析方法学验证的探讨
2018-05-13任欣怡张代超程远国赵小平车津晶
任欣怡,朱 晰,张代超,陈 探,程远国,赵小平,车津晶
(1.上海益诺思生物技术股份有限公司,上海 201203;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
生物技术药物具有结构复杂、分子量大及异源性等特点,与小分子类药物不同的是其拥有较强的免疫原性。免疫原性的产生往往伴随药物浓度的降低,药物疗效的减弱或是不良反应的产生。因此,对生物技术药物免疫原性进行检测具有重要的意义[1-4]。目前,国内免疫原性的检测尚缺乏相关的技术指导原则,而美国食品药品监督管理局和欧洲药物管理局的相关指导原则侧重于临床免疫原性的评价[5-7]。
免疫原性分析检测的抗药抗体在体内多以混合物形式存在,无法获得代表待测物的标准品,因此免疫原性的检测和评价具有半定量的特点。这个特点是其在检测以及方法建立的过程中与其他常见的生物分析方法的不同之处。免疫原性分析常用的检测方法和技术有夹心酶联免疫吸附法(>enzyme>linked immunosorbent assay,ELISA )、桥连ELISA、表面等离子共振技术、电化学发光技术和配体结合液质联用技术等[8-9]。由于无法获得待测基质中真实抗受试物抗体的标准品,因此在方法建立过程中要通过在基质中外加阳性对照抗体来进行待测样品的模拟,还需结合统计学原理,通过合适的自然样本群基质建立待测样本的基底信号值[10-13]。
本文旨在对相关文献及美国、欧盟的免疫原性评价指导原则分析的基础上对非临床免疫原性分析方法的开发和验证进行探讨。
1 检测步骤
由于无法获得待测物的标准品,免疫原性检测无法进行准确的检测,只能通过概率的方法尽可能获得准确结果。免疫原性分析往往采用“多步法”进行:①通过一个具有一定假阳性的方法进行样本的快速筛选,排除大量阴性结果;②通过一个更为准确的方法对筛选出的“疑似阳性样本”进行确证检测,进一步排除阴性结果;③对得到的阳性样本进行进一步检测和分析,如滴度检测和中和抗体检测[14]。方法的建立和验证要根据检测的步骤来进行选择和调整。样本检测如仅需进行筛选和确证,则仅需考虑与筛选和确证相关的指标。如需要进一步检测滴度甚至中和抗体,则方法中要添加与之相关的指标[15]。
2 自然样本群的选择
应尽可能选择与待测样本相同或相近的自然样本群,如待检测样本来自老年或患类风湿性疾病的个体,则用于方法建立的自然样本群应选择与以上状态相一致的个体[16]。用于方法学建立的自然样本群对于待检样本应具有代表性,代表待检样本在自然状态下的一般情况。
3 对照样本的选择
对照样本是用来考察方法有效性的参照样本。对照样本分为阳性对照样本和阴性对照样本。阳性对照样本往往通过在基质中外加阳性对照抗体来进行模拟。阴性对照样本则通过混合的自然样本群样本来获得[17]。
3.1 阳性对照样本的选择
由于一般无法准确获得待测药物在机体内的真实抗体,因此要通过阳性对照抗体来作为药物在体内免疫原性情况的阳性对照。阳性对照抗体一般要求为多克隆抗体,以此更好反映机体内的真实情况。一般情况下,生物技术药物临床前药物代谢及安全性评价在灵长类动物体内进行,由于制备猴源的阳性对照多抗成本较高,因此广泛应用的阳性对照抗体是兔源或羊源多抗。在多抗制备和纯化过程中,为了得到更具代表性和特异性的阳性对照抗体,多抗血清要经过抗原吸附过程,以去除大部分非相关抗体。为了在长期试验中得到性质稳定且可重复的阳性对照抗体,亦可采用≥2株亲和力不同的单克隆抗体进行混合。
3.2 阴性对照样本的选择
阴性对照是为了提供自然样本群的本底值。由于个体样本间或多或少会存在个体差异,因此阴性对照应以混合自然个体制得,以消除个体间差异,使本底值更加稳定并具有代表性。阴性对照在免疫原性分析时作为临界值计算的依据。
4 临界值的计算
临界值为通过考察一个小规模自然样本群个体的信号值波动情况,结合统计学原理计算得到的在一定百分位数内可代表自然样本群分布情况的信号值。通常采用>9 5%的百分位数来计算临界值。综合考虑小规模自然样本群中离群个体情况和不同分析批中离群个体情况来排除离群个体因为样本自身原因造成的固定的离群称为生物离群值(如含天然抗体的个体),此值反映了小规模样本群中个体信号的波动。因为分析批分析原因而造成的随机离群称为分析离群值,此值反映了不同分析批中个体信号的波动。离群值的判断推荐使。用统计方法进行客观判断。临界值在计算过程中要先排除各个分析批中分析离群值,再排除样本群中生物离群值,然后通过计算样本群个体的均值及标准偏差来获得。为消除不同批次间标准偏差之间的变异,样本群个体的标准偏差通过各批个体的标准偏差的几何平均值来计算[18-21]。
4.1 筛选临界值的确定
通过统计分析自然样本群个体检测值的变化规律,得到符合该法的筛选临界值类型。筛选临界值分为固定筛选临界值,浮动筛选临界值以及动态筛选临界值等。其中较为常见的为前两者。固定筛选临界值是指相同的自然样本群在多个分析批中经统计得到批间方差齐性,且均值无显著差异情况下采用的临界值。待测样本检测时的筛选临界值即为通过方法学确定的临界值。在待测样本检测阶段此数值为固定数值。高于此数值的待测样本为疑似阳性。浮动筛选临界值是指,相同的自然样本群在多个分析批中经统计得到批间方差齐性,但均值有显著差异的情况下采用的临界值。由于不同分析批间检测数值均值存在差异,因此在待测样本检测时无法采用固定数值作为临界值,需结合阴性对照进行各分析批临界值的校正,得到随各分析批数值上下浮动的临界值。即便在方法学中证明了自然样本群个体批间均值无显著差异,亦推荐采用浮动筛选临界值以消除不同分析批中潜在的不稳定风险,以获得更为准确的数值。
结合文献[21]及笔者在实际操作中的经验,在筛选临界值确定时首先排除不同批次的离群值。然后检测不同批次个体数据的分布,来确定数据是否满足计算的需求。以偏度系数及Shapiro-Wilk检验中P值来评估数据的分布。当数据分布满足偏度系数位于[-1,1]或P>0.05其中任一个条件时,可进行下一步计算;当偏度系数位于[-1,1]之外且P≤0.05时,该数据不可采用,需分析原因后重新进行实验。简要流程见图1。
4.2 确证临界值的确定
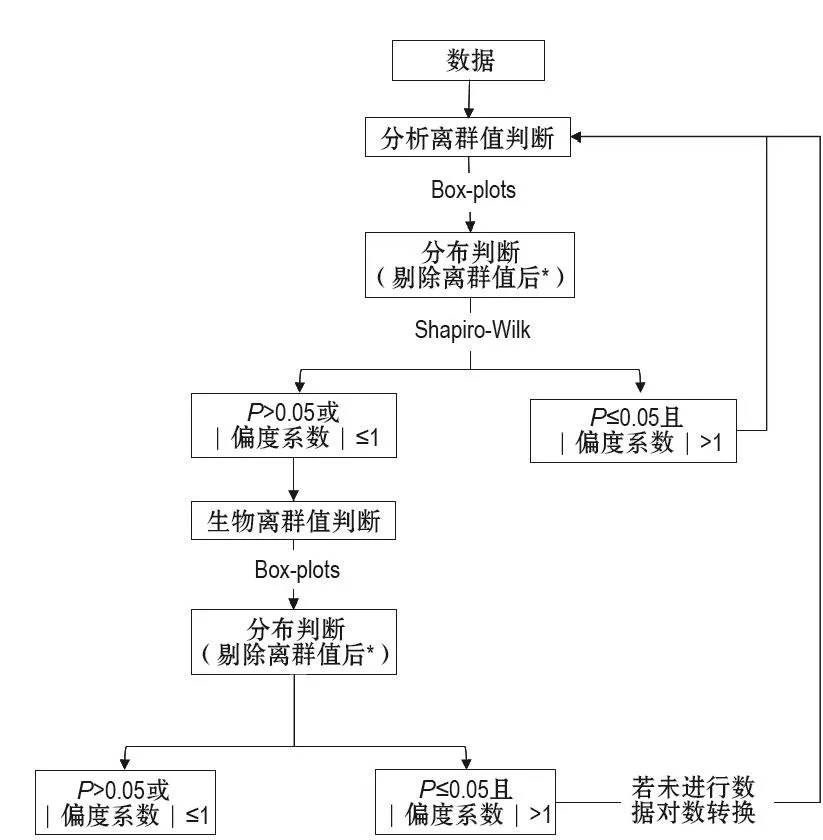
图1 筛选临界值计算中数据处理和判断流程图
待测样本经过筛选实验后得到的疑似阳性样本要经过再次确证方可得到可信的结果。由于抗药抗体的特异性,因此通过在疑似阳性样本中加入过量药物分子的方式来进行待测样本的确定。疑似阳性样本中若含抗药抗体,加入过量药物分子后,其中游离的药物分子将与检测试剂即标记了的药物分子竞争结合抗药抗体,从而造成检测出的抗药抗体信号值下降。通过分析自然样本群个体中加入同样浓度的过量药物分子后信号下降的情况可得到自然样本加入过量药物分子后非特异的信号下降比例。结合统计学原理,在一定百分位数的置信区间内得到一个比例数值,此比例数值即为待测样本确证实验时的临界值,即确证临界值,通常采用>99%的百分位数进行计算[3]。由于此置信区间较筛选临界值置信区间更为宽泛,可有效涵盖分析批的数值波动,且筛选实验已去除了大多数阴性结果,因此在实际操作中往往无需再考虑分析批间的波动,仅需采用一个固定的确证临界值。
5 其他
5.1 精密度检测
方法学验证阶段应充分考虑待测样本检测时的实际情况,即要分别考量筛选、确证或滴度实验中的数据可靠性。通过对照样本的检测来进行方法可靠性的考察。至少需要考察阴性对照,低浓度阳性对照及高浓度阳性对照样本的检测可靠性。由于免疫原性检测半定量的特点,无法对其计算回归浓度,因此检测数据的稳定性用检测数值间的精密度来表示。要同时考察批内和批间(日间)精密度。
5.2 特异性和选择性检测
方法的特异性和选择性对于免疫原性分析结果的解读非常重要。特异性指的是该法可检出针对受试物抗体的能力。其检测出的结果是只与受试物相关,而不与试剂相关。选择性指的是方法在基质中检出抗受试物抗体的能力。基质中可能存在潜在的干扰检测的物质。方法特异性和选择性不好会导致检测结果中假阳性的产生。方法特异性的考察往往通过外加受试物是否可抑制检测信号值来予以证明。选择性的考察往往通过比较外加在个体基质,混合基质及稀释液中的特定浓度的阳性对照的信号值之间的差异来进行证明。特异性和选择性的证明往往会决定免疫原性分析时所用到的最小稀释度。通过样品的稀释,可降低基质中非相关物质信号的干扰。但过度的稀释会降低样品检测的灵敏度,因此在免疫原性分析中样品的稀释多半介于1∶5~1∶100之间。
5.3 灵敏度检测
免疫原性分析方法中灵敏度是通过基质中检测灵敏度和药物耐受来体现的。检测灵敏度通过类似生物分析灵敏度的方法来获得。简要说来,通过建立阳性对照抗体的滴度曲线来进行灵敏度的评价。将对应分析批的临界值回代回滴度曲线以求得该分析批所对应的临界值。由于免疫原性分析检测方法固有的特点,各分析批间会存在信号的变异,导致各分析批所得的灵敏度数值也非一成不变,因此最终检测灵敏度会用一个范围来表示。药物耐受是指在某一特定浓度阳性对照抗体存在情况下可被持续检测为阳性时最高的受试物浓度。往往不同浓度阳性对照抗体所能耐受的受试物浓度也不同,需至少检测和评价低和高浓度阳性对照抗体存在情况下的药物耐受情况。最终检测灵敏度和药物耐受均需换算为基质中所对应的阳性对照抗体或受试物的质量浓度,以换算后的质量浓度表述方法的灵敏度[22]。
5.4 生物类似药免疫原性对比
在进行非临床生物类似药免疫原性对比时,方法的建立要同时考察并兼顾原研药和生物类似药(受试物)。两者免疫原性的对比必须是在同一试验体系内进行。不同试验间的对比并无意义,有时甚至是错误的。在检测方法中,可采取2种检测策略:分别建立针对原研药和受试物的检测方法并进行验证;仅建立针对受试物的检测方法。建立2种检测方法需要在方法学验证中比较各个方法指标间原研药和受试物之间的一致性,且在样本检测时需要进行交叉检测,工作量大,且无法排除方法间误差带来的变异,对于最终数据的解释带来了较大的挑战。因此,目前更推荐的用于生物类似药评价的方法为仅建立针对受试物的检测方法。通过在灵敏度考察时对比方法对于原研药和受试物的药物耐受来考察原研药和受试物之间的一致性,在样本检测时用该法进行检测,最终数据便于比较和解释,但此法也存在着一些局限,即仅能检出针对受试物的抗体,而不能检出原研药特有的受试物不具备的抗体[10-12]。
6 总结与展望
在非临床药物评价试验中,免疫原性扮演着解释药代,毒代和药效数据的作用。在生物类似药的评价中免疫原性在判断一致性时起到重要的作用,但生物类似药的一致性的最终判断要结合药代数据,毒理数据及药效数据综合判断。通过将免疫原性的数据和药代、毒代数据的综合,可有效地解释药物在体内的去向,并对药物暴露量的异常变化提供解释的依据。通过将免疫原性的数据与药效数据的综合,可通过中和抗体的数据解释药效中的异常降低。目前,国内大部分企业在进行免疫原性评价时,由于考虑到试验周期及申报时限的要求,往往会同步开展药物浓度分析及免疫原性评价试验。对于免疫原性试验数据的解释和应用还存在诸多的不足,更多地停留在按指导原则执行的层面上,而缺少对数据解读的能力。无法将免疫原性数据与药代,毒理及药效数据进行综合分析。从而损失了很多数据的价值。但通过国内同行的不断努力及国内医药企业的发展,相信国内的药物评价水平在不远的将来会有长足的进步。
