间充质干细胞通过调控巨噬细胞极化减轻1型糖尿病模型小鼠炎症反应
2018-05-13刘伟江孟祥宇刘元林郑荣秀
周 娜,刘伟江,李 苹,3,孟祥宇,王 洋,王 鹏,樊 月,刘元林,李 雪,郑荣秀,张 毅
(1.天津医科大学总医院儿科,天津 300052;2.军事科学院军事医学研究院辐射医学研究所,北京 100850;3.首都医科大学附属北京儿童医院,北京 100045)
随着现代生活水平的不断提高,1型糖尿病(type 1 diabetes mellitus,T1DM)患者呈不断上升趋势,已成为威胁青少年和儿童健康的主要代谢疾病之一。T1DM是一种自身免疫性疾病,多由T淋巴细胞介导,造成胰岛β细胞破坏,使其丧失合成和分泌胰岛素的功能,进而引起糖代谢紊乱[1]。目前,T1DM仍以胰岛素治疗为主,如果治疗不及时则可能出现严重并发症,影响患者的生活质量并危及生命[2]。因此,寻找最佳的治疗方法是当今研究的热点。近年来,间充质干细胞(mesenchymal stem cells,MSC)治疗T1DM受到广泛关注[3-4]。MSC是一种来源于中胚层的具有自我更新和多向分化潜能的成体干细胞[5-6],具有低免疫原性和免疫调节等生物学功能[7-8],可作用于多种免疫细胞,如T和B淋巴细胞为主的适应性免疫细胞及巨噬细胞、自然杀伤细胞和树突状细胞等固有免疫细胞[9-10]。目前已有研究表明,MSC通过改善T1DM的免疫紊乱状态及保护残存的β细胞,进而有效改善血糖状态[11]。但具体机制仍不清楚。
巨噬细胞作为人体天然免疫的主要成员之一,可参与多种炎症性疾病的发生发展[12]。在不同微环境下,可分化为作用相反的2个亚群,即经典活化M 1型和选择性活化M 2型。M 1型巨噬细胞激活后可分泌促炎症反应因子,如诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),肿瘤坏死因子αα(tumor necrosis factor-α,TNF-α),白细胞介素1β(interleukin-1β,I L-1 β)和I L-1 2等;M 2型巨噬细胞活化后可促进抗炎因子I L-1 0和I L-4及转化生长因子 β(transforming growth factor β,TGF-β)分泌而抑制炎症发生,精氨酸酶1(arginase-1,A r g-1)是其表达的主要分子之一[13-14]。现有研究已表明,M S C可调控巨噬细胞表型,促进其由促炎M 1型向抗炎M 2型极化,从而抑制炎症反应,维持微环境的稳态[15-16];且移植M S C可通过募集M 2型巨噬细胞使胰岛β细胞增殖和再生,进而影响T1DM的病理生理过程[17-18]。但M S C是否通过调节巨噬细胞极化,从而减轻T1DM模型小鼠的炎症反应仍不清楚。为此,本研究通过对T1DM模型小鼠进行M S C治疗,进一步探讨M S C调控巨噬细胞极化、减轻T1DM小鼠炎症反应的作用机制。
1 材料与方法
1.1 实验动物
30只6周龄雄性C 5 7 B L/6 J小鼠,体质量为1 8~2 1 g,购自北京维通利华实验动物有限公司,动物合格证号:SCXK-(京)2016-0006。在1 2 h昼夜交替下,饲养于军事医学研究院实验动物中心;环境温度保持在2 2~2 5℃,相对湿度为3 5%~5 0%。另5只1周龄雄性C57BL/6J小鼠(购自北京维通利华)用于M S C的分离培养。所有的动物实验过程经院实验动物伦理委员会批准。
1.2 试剂和主要仪器
链脲佐菌素(streptozotocin,STZ)、Trizol、油红O、地塞米松、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、胰岛素、β-磷酸甘油、维生素C磷酸盐、丙酮酸和碱性磷酸酶购自美国Sigma公司;柠檬酸、柠檬酸钠和1 0%中性甲醛购自国药集团化学试剂有限公司;牛血清白蛋白购自北京Solarbio科技有限公司;兔抗小鼠胰岛素抗体(一抗)购自美国A b c a m公司;HRP-山羊抗兔I g G抗体(通用型,二抗)及D A B显色剂购自丹麦DAKO公司;α-M E M、0.2 5%胰酶、PBS及胎牛血清购自美国Gibco公司;流式抗体(抗小鼠Ia,CD11b,Sca-1,CD105,CD34,CD45,CD31和C D 2 9抗体)购自美国ThermoFisher公司,APC-F4/80,PE-CD16/32和FITC-CD206抗体购自美国eBioscience公司;RTase M-MLV、RNA酶抑制剂及5×RTase M-MLV缓冲液购自日本TaKaRa公司;DTT、dNTP、无RNA酶水和2×Μltra Master Mix购自中国康为世纪有限公司;所用引物由安徽通用生物系统有限公司合成,引物序列见表1。

Tab.1 PCR primer sequence
稳择易型血糖试纸和血糖仪购自美国强生公司;Qubit®2.0荧光定量仪、台式低温冷冻离心机、7500 Real Time System、常温台式离心机及细胞培养箱购自美国Thermo Fisher公司;流式细胞仪Facscalibur购自美国BD公司;光学显微镜购自日本Olympus公司。
1.3 骨实质来源MSC的分离培养和鉴定
在无菌条件下分离7日龄小鼠股骨及胫骨,用眼科镊将骨碎片转移至盛有1 mLⅡ型胶原酶的EP管中,37℃恒温消化45 min后,将骨碎片转移至含10%胎牛血清的α-MEM完全培养基中,采用骨片贴壁法培养小鼠骨片来源的MSC。传至第3代(P3),采用流式细胞术、体外成脂及成骨诱导分化等方法鉴定分离培养MSC[8]。流式细胞仪检测所用抗体为FITC-抗小鼠Ia,FITC-抗小鼠CD11b,FITC-抗小鼠 Sca-1,PE-抗小鼠CD105,FITC-抗小鼠CD34,FITC-抗小鼠CD45,PE-抗小鼠CD31及PE-抗小鼠CD29。同时将细胞接种6孔板,用含10%胎牛血清的α-MEM培养基进行成脂(地塞米松1 μmol·L-1,胰岛素10 μg·L-1,IBMX 0.5 mmol·L-1和吲哚美辛 0.5 mmol·L-1)及成骨(地塞米松0.1 μmol·L-1,维生素C磷酸盐50 μmol·L-1和β-磷酸甘油10 mmol·L-1)诱导分化,分别培养8和10 d,用油红O染料工作液染色及实时荧光定量PCR(RT-PCR)检测成脂分化关键转录因子CCAAT增强子结合蛋白α(CCAAT enhancer binding protein alpha,CEBPα)和过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor gamma,PPARγ)mRNA表达。用碱性磷酸酶染料工作液染色及RT-PCR检测成骨分化关键转录因子骨钙素(osteocalcin)和Runt相关转录因子2(Runt related transcription factor 2,Runx2)mRNA表达。
1.4 1型糖尿病小鼠模型制备和MSC治疗
所有小鼠适应性喂养2 d后随机分为2组:正常对照组(n=10)和T1DM组(n=20)。正常对照组不做任何处理;T1DM组小鼠禁食12 h、禁水8~10 h后,ip给予含STZ 50 mg·kg-1柠檬酸钠缓冲液,每日1次,连续5 d。第1次注射后,即刻恢复自由饮食;给药第12天,连续3 d通过尾静脉取血测随机血糖,血糖平均值≥16.7 mmol·L-1即为建模成功。将建模成功的小鼠随机分为T1DM模型组(n=10)和MSC治疗组(n=10)。成模后第1和第15天,MSC治疗组由尾静脉注射MSC 5×105,正常对照组和T1DM模型组注射PBS;每周检测小鼠随机血糖和体质量。28 d后处死小鼠,用PBS反复灌洗腹腔,将灌洗液6000×g离心3 min,获腹腔巨噬细胞;随后取胰腺等组织待测。
1.5 胰腺组织HE染色和免疫组化检测
胰腺组织取出后,立即置10%中性甲醛溶液中固定,采用H E染色检测胰腺中胰岛组织形态是否饱满及胰岛细胞分布是否均匀,以判断病变程度[19];采用免疫组化法检测胰岛素分泌水平及巨噬细胞(F 4/8 0)数量[18]。
1.6 实时荧光定量PCR法检测腹腔巨噬细胞标志分子和炎症因子mRNA表达
Trizol法提取腹腔巨噬细胞总RNA,取1μg RNA逆转录为c D N A;R T-P C R法检测腹腔巨噬细胞标志分子(iNOS和A r g-1)及炎症因子(I L-1 β,I L-4,I L-6,I L-1 0,I L-1 2,I F N-γ,T N F-α和T G F-β)m RNA表达。反应体系为cDNA1 μ L,P C R上下游引物(1 0 μ m o l·L-1)1 μL,q-P CRMaster Mix 1 0 μ L 和无RNA酶水8 μ L;反应条件为9 5℃ 10 min,(9 5℃ 15 s,60℃ 1 min)40个循环,95℃15s,60℃1min,95℃15s。GAPDH为内参基因,采用 2-△△Ct表示待测基因mRNA表达水平。
1.7 流式细胞术检测腹腔巨噬细胞M1和M2表型
取腹腔巨噬细胞,加入流式抗体A P C-抗小鼠F 4/8 0,P E-抗小鼠C D 1 6/3 2及F I T C-抗小鼠C D 2 0 6抗体,避光孵育3 0 min;加入P B S 1 m L洗涤,4 5 0×g,离心5 min,弃上清,加入4%多聚甲醛2 0 0 μ L固定,上机检测。
1.8 统计学分析
2 结果
2.1 骨实质来源MSC的鉴定
分离培养的MSC呈均一的纤维样长梭形、旋涡状贴壁生长(图1A)。流式细胞仪检测结果表明,细胞高表达Sca-1,CD29和CD105;不表达或低表达CD31,CD34,CD45,Ia和CD11b(图1B)。油红O染色结果显示,分离培养的MSC成脂诱导后出现大量红色脂滴(图1C),且成脂关键转录因子CEBPα和PPARγ表达显著增加(P<0.01,图1D)。成骨诱导后,碱性磷酸酶活性增加(图1E),成骨关键转录因子骨钙素和Runx2表达亦显著增加(P<0.01,图1F)。上述结果提示,成功分离培养小鼠骨实质来源的MSC。
2.2 MSC治疗对T1DM模型小鼠随机血糖和体质量的影响

Fig.1 Pluripotency characteristics of mesenchymal stem cells(MSCs)derived from mouse compact bone. A:MSCs derived from murine compact bone were digested by collagenase and amplified to the passage 3(P3)in vitro. Cell morphologywas shown;B:expression status of surface molecules on MSCs was analyzed by flow cytometry;C:oil red O staining of adipocytesdifferentiated from MSCs;D:RT-PCR analyses of adipogenic markers in MSCs after adipogenic induction;E:alkaline phosphatasestaining of osteoblasts differentiated from MSCs;F:RT-PCR analyses of osteogenic markers in MSCs after osteogenic induction.n=3,**P<0.0 1,compared with corresponding control group.
与正常对照组比较,T1DM模型组小鼠随机血糖显著升高(P<0.0 5);与T1DM模型组相比,MSC治疗组小鼠随机血糖在治疗7 d后逐渐下降,治疗2 1 d后显著降低(P<0.0 5),2 8 d后降低(2 5.0±0.1)%(P<0.0 5),但未降至正常对照组水平(P<0.0 5)。与正常对照组相比,T1DM模型组小鼠体质量明显降低(P<0.0 5),M S C治疗组体质量在治疗后7 d内即开始增长,2 8 d后增加(1 2.0±0.4)(P<0.0 5)(图2)。
2.3 MSC治疗对T1DM模型小鼠胰岛素分泌和巨噬细胞数的影响

Fig.2 MSCs ameliorated non-fasting blood glucosed(A)and body mass(B)of streptozotocin(STZ)-induced type 1 diabetes mellitus(T1DM)model mice.T1DM was induced in male C57BL/6 mice using STZ 50 mg·kg-1intraperitoneal injection,5×105MSCs were injected into mice via tail vein injection route on the 1stday and the 15thday after incidence of diabetes.Blood glucose concentration exceeding 16.7 mmol·L-1in three consecutive daily measurements was considered diabetes.s,n=10.*P<0.05,compared with normal control group;#P<0.05,compared with T1DM model group.
HE染色结果显示,T1DM模型组小鼠胰腺组织形态已完全被破坏,炎症细胞浸润明显较多;MSC治疗组胰腺组织形态较模型组改善,细胞分布大体均匀一致,炎症细胞浸润较少(图3A)。免疫组化结果表明,T1DM模型组小鼠与正常对照组相比胰岛素分泌显著减少;与模型组相比,MSC治疗组胰岛素分泌增多(图3B);胰腺组织中F4/80阳性细胞数即巨噬细胞数量明显增加(图3C)。
2.4 MSC治疗对T1DM模型小鼠腹腔巨噬细胞炎症因子mRNA表达的影响
与正常对照组比较,T1DM模型组小鼠腹腔巨噬细胞促进炎症因子 IL-1β,TNF-α,IL-6和 IL-12 mRNA表达显著增加(P<0.05),IFN-γ无明显变化;抑制炎症因子IL-4,IL-10和TGF-β表达则显著降低(P<0.05)。与模型组相比,MSC治疗组炎症因子IL-1β,TNF-α,IL-6和IL-12 mRNA表达显著下降(P<0.05,P<0.01),抑制炎症反应IL-4,IL-10和TGF-β mRNA表达显著增加(P<0.05)(图4)。
2.5 MSC治疗促进T1DM模型小鼠M2型巨噬细胞极化
由图5所示,与正常对照组比较,T1DM模型组M1型巨噬细胞百分比升高到至(50.1±1.2)%(P<0.05),其标志分子iNOS mRNA表达升高(P<0.01);M2型巨噬细胞百分比下降到(22.5±4.0)%,其标志分子Arg-1 mRNA表达下降(P<0.05);M2/M1比值降低(P<0.05)。与T1DM模型组比较,MSC治疗组M1型巨噬细胞百分比降低至(15.6±1.2)%,iNOS mRNA表达降低(P<0.01);M2型巨噬细胞百分比升高至(72.5±3.4)%,Arg-1 mRNA表达升高(P<0.01);M2/M1比值升高(P<0.05)。
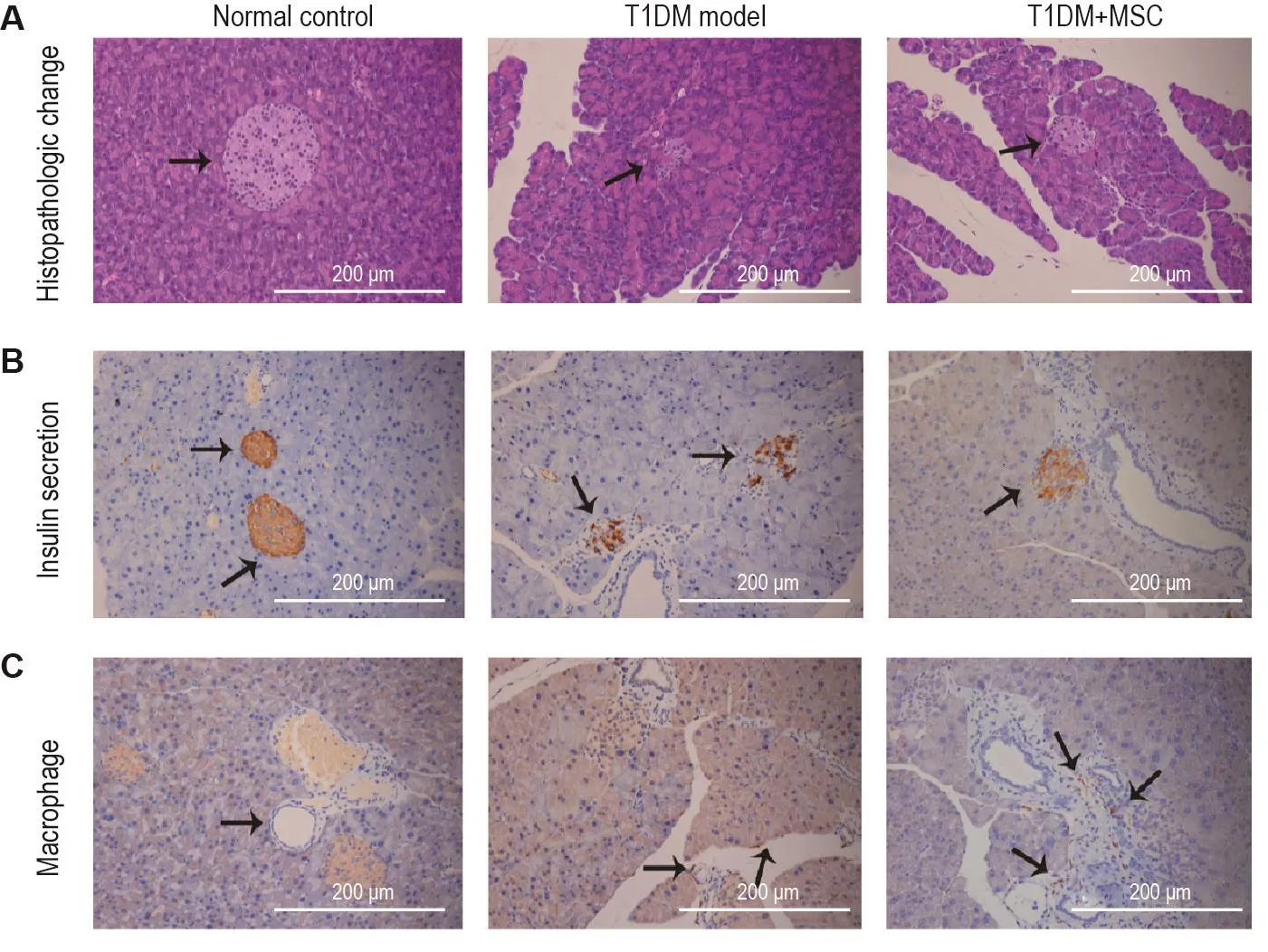
Fig.3 MSC treatment for 28 d decreased severity of insulitis and macrophage count in STZ-induced T1DM model mice.See Fig.2 for the mouse treatment.A:HE staining,the arrows show islet tissue;B:immunohistochemistry examination,the arrows show insulin secretion;C:immunohistochemistry examination,the arrows show the positive of F4/80.

Fig.4 MSC treatment up-regulated anti-inflammatory factors and down-regulated proinflammatory factors expression on peritoneal macrophages in STZ-induced T1DM model mice detected by RT-PCR.See Fig.2 for the mouse treatment.A:proinflammatory factors;B:anti-inflammatory factors,n=10.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with T1DM model group.
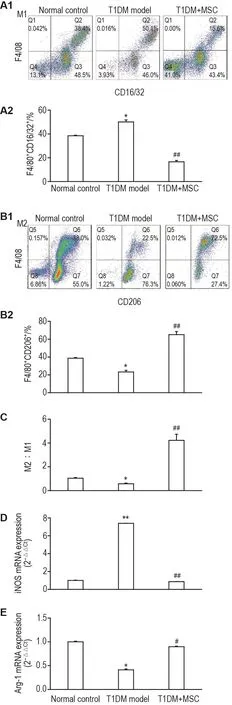
Fig.5 MSC treatment for 28 d promotes M2 macro⁃phage polarization in STZ-induced T1DM model mice.See Fig.2 for the mouse treatment.A:population of M1 cells;B:population of M2 cells;C:ratios of M2/M1;D:mRNA expression of iNOS on M1 cells;E:mRNA expression of Arg-1 on M2 cells.,n=10. *P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with T1DM model group.
3 讨论
T1DM是青少年和儿童中常见的一种自身免疫性疾病,目前依旧是以胰岛素治疗为主,尽管随着胰岛素给药方式的改进,已能改善患者的生活质量和身心健康[19],但尚不能有效的降低其并发症的发生率。目前研究发现,T1DM发病原因有很多,但主要病因是由于胰岛β细胞进行性破坏,进而导致胰岛素分泌不足和调节障碍。具体发病机制尚不清楚。但现有研究已证实,T1DM的发病机制涉及T细胞及多种固有免疫细胞如巨噬细胞等之间的相互调控,而这些免疫细胞数量的改变可造成胰岛β细胞的损伤或减少[19-20]。因此,机体免疫紊乱状态的纠正有望为T1DM的治疗提供新的思路和靶点[22]。
MSC作为一种多能的成体干细胞,具有多向分化潜能、低免疫原性和免疫调节能力[23],可作用于多种免疫细胞,如T及B淋巴细胞为主的适应性免疫细胞及巨噬细胞、自然杀伤细胞及树突状细胞等固有免疫细胞[9-10]。现有实验研究已证实,MSC治疗可改善T1DM的免疫紊乱状态,但具体机制尚不清楚[24]。本研究发现,MSC治疗组小鼠腹腔巨噬细胞的炎症因子IL-1β,IL-6,IL-12和TNF-α mRNA表达下降,其中早期炎症因子IFN-γ mRNA表达无明显差异,而抑制炎症反应的IL-10,IL-4及TGF-β mRNA表达显著增加,提示MSC可通过巨噬细胞调节免疫,从而减轻糖尿病的炎症反应。IFN-γ表达无明显差异可能与检测时间等相关,需进一步研究。
巨噬细胞作为人体一种重要的固有免疫细胞,在抗击病原微生物及损伤修复等方面有重要作用,并能随微环境的变化而向不同亚群(M1和M2)进行分化。其中M1型巨噬细胞有助于宿主防御外来微生物的侵袭,但持续活化可造成机体慢性炎症的发生,此时若M2型巨噬细胞发生极化,可发挥抗炎的作用。但体内外实验表明,机体M1型巨噬细胞不易向M2型巨噬细胞进行极化。目前已有研究发现,MSC移植能调节巨噬细胞的表型,促进其从促炎的M1型向抗炎的M2型极化,从而发挥抑制炎症反应、维持微环境稳态的作用[15,26]。此外,也有动物实验结果表明,给T1DM小鼠移植MSC,可募集M2巨噬细胞,促使胰岛β细胞再生,以减轻糖尿病反应[27]。而巨噬细胞极化是否参与T1DM小鼠的炎症反应过程仍不清楚。为此本研究制备了T1DM模型小鼠,用MSC移植治疗,检测体内腹腔巨噬细胞的M2/M1比值,RT-PCR检测腹腔巨噬细胞相关炎症因子mRNA表达。结果显示,MSC治疗组小鼠的血糖、体质量等生理指标均优于T1DM模型组。HE染色和免疫组化结果也显示,MSC治疗组胰岛损伤程度均优于模型组,说明MSC可治疗小鼠的T1DM。流式细胞术结果表明,MSC组M2/M1型巨噬细胞的比值显著高于T1DM模型组;RT-PCR比较分析两组小鼠腹腔巨噬细胞中M1和M2型巨噬细胞相关基因的表达水平。结果表明,相较于T1DM模型组,MSC治疗组M2型巨噬细胞相关基因Arg-1表达水平显著上升,M1型巨噬细胞相关基因iNOS表达水平显著下降。据报道,MSC免疫调节具有可塑性,其在T1DM模型小鼠中如何促进M2型巨噬细胞极化,以及糖尿病炎症微环境如何诱发MSC调节固有免疫细胞的炎症反应,仍需进一步探究。IL-1β作为固有免疫反应的重要因子,不仅可介导炎症反应,也可参与细胞凋亡过程;MSC治疗T1DM后IL-β分泌减少,同时可能抑制了其诱发凋亡反应,仍需深入研究,这也对MSC治疗T1DM疾病提供了新的研究方向。
综上所述,MSC移植可减轻T1DM模型小鼠的炎症反应,其机制可能与调控MI和M2巨噬细胞极化有关,MSC促进M2型巨噬细胞增多,抑制M1型巨噬细胞在小鼠T1DM模型中产生的炎症反应,从而减轻T1DM的发展。本研究为MSC治疗T1DM提供了新的理论依据,为深入了解MSC治疗T1DM的机制及临床应用提供有益参考。
