类风湿关节炎合并单克隆免疫球蛋白病临床特征及预后分析
2018-05-11杨月陆松松陈龙温磊贾园栗占国
杨月 陆松松 陈龙 温磊 贾园 栗占国
北京大学人民医院1风湿免疫科,2检验科,3血液科(北京100044)
单克隆免疫球蛋白病(monoclonal gammopa⁃thy,MG)是以血清或尿中出现单克隆免疫球蛋白即M蛋白为特点的一组疾病,多由浆细胞、浆细胞样淋巴细胞或B淋巴细胞克隆性增殖所致。国外研究发现,包括类风湿关节炎(rheumatoid arthritis,RA)、干燥综合征(Sjögren′s syndrome,SS)在内的多种风湿免疫病及其用药可能增加MG的发生风险[1-2],其中部分患者还可能向血液系统恶性肿瘤如淋巴瘤、多发性骨髓瘤(multiple myeloma,MM)[3]等方向演变。然而,这些研究多为大规模流行病学调查,以观察性结论为主。近年来少数学者针对合并MG的SS患者的临床特征及其发生恶性转化的危险因素进行讨论[4],但RA领域研究尚缺乏。本文对RA合并MG(RA⁃MG)的临床特征、危险分层、治疗以及转归进行分析,旨在提高风湿科医生对此类疾病的认识。
1 资料与方法
1.1 一般资料收集2010年1月至2017年1月于北京大学人民医院风湿免疫科通过血清蛋白电泳(serum protein electrophoresis,SPEP)和(或)血、尿免疫固定电泳(immunoxation electrophoresis,IFE)包括本周氏蛋白电泳检测,发现血或尿M蛋白,以确诊MG的RA患者共11例,其中3例同时继发SS。患者均满足1987年美国风湿病学会的RA分类标准[5]或2010年美国风湿病学会和欧洲抗风湿病联盟提出的新的RA分类标准[6]。其中男3例(27.3%)、女8例(72.7%),患者年龄50.1~ 82.8岁,中位年龄65.6(23.6)岁。采用1∶3匹配的病例对照研究,为病例组的每例RA患者分别匹配3名同期入院、原发病诊断相同,同性别、年龄相似,经SPEP和IFE检测确定未合并MG的RA患者作为对照组,所有患者均获得知情同意。
1.2 RA临床及免疫学特征回顾性收集病例组及对照组患者的病例资料,其中病例组收集在我院第一次诊断MG时的病例资料。记录患者RA的病程,晨僵、关节畸形、类风湿结节、肺间质病变(interstitial lung disease,ILD)、周围神经炎、淋巴结肿大、脾大(查体发现或超声、CT证实),以及M蛋白导致的冷凝集现象、冷球蛋白血症、高黏滞血症及血栓事件的发生率。收集患者血尿常规、血生化、24 h尿蛋白定量(24⁃hour urine total protein,24 h UTP),抗环瓜氨酸蛋白抗体(anti⁃citrullinated peptide antibody,ACPA)包括抗环瓜氨酸肽(cyclic citrullinated peptide,CCP)抗体、抗角蛋白抗体(anti keratin antibody,AKA)和抗核周因子(anti⁃perinuclear factor,APF),抗核抗体(antinuclear anti⁃body,ANA)、抗可提取性核抗原(extractable nu⁃clear antigen,ENA)抗体、类风湿因子(rheumatoid factor,RF)IgM和IgG,免疫球蛋白IgG、IgM、IgA定量,补体 C3、C4,C 反应蛋白(C⁃reactive protein,CRP)、动态红细胞沉降率(erythrocyte sedimenta⁃tion rate,ESR)的检验结果。收集患者肾小管受累指标包括尿视黄醇结合蛋白(retinol⁃binding pro⁃tein,RBP)、N⁃乙酰⁃β⁃D⁃氨基葡萄糖苷酶(N⁃acetyl⁃β⁃D⁃glucosaminidase,NAG)及β2⁃微球蛋白(β2⁃microglobin,β2⁃MG);采用MDRD公式估算肾小球滤过率(estimated glomerular filtration rate,eGFR)。收集患者肺高分辨率CT、肺功能,腹部超声、CT,关节影像学包括X线、超声或MRI,以及肾脏活检的结果。
1.3 MG的评估、危险分层、治疗及随访收集病例组患者第一次诊断MG时SPEP、血和尿IFE、血清游离轻链比值(serum free light chain ratio,sFLCR),骨髓相关检查包括穿刺涂片、免疫表型分析、骨髓活检及细胞和分子遗传学检测,以及为评估骨破坏进行的影像学检查结果。意义未明的单克隆免疫球蛋白病(monoclonal gammopathyof undetermined significance,MGUS)及MM的诊断依据2014年国际骨髓瘤工作组(International Myeloma Working Group,IMWG)制定的诊断标准[7]。根据血清M蛋白水平、种类及sFLCR有无异常,对MGUS患者发展为MM的危险进行分层[8]。POEMS综合征的诊断依据美国梅奥诊所2007年提出的诊断标准[9]。收集患者就诊前后全身应用糖皮质激素、缓解病情抗风湿药(disease⁃modifying anti⁃rheumatic drugs,DMARDs)包括甲氨蝶呤(methotrexate,MTX)等和生物制剂的情况。共6例RA⁃MG患者接受随访,记录患者疾病转归,并收集随访期间Ig定量、SPEP、血和尿IFE,以及骨髓检查、影像学检查及组织活检的结果。
1.4 统计学方法采用SPSS 18.0统计软件进行分析。正态分布的计量资料用均数±标准差进行描述,非正态分布的计量资料用中位数(四分位间距)进行描述;计数资料采用率、构成比进行描述分析。计量资料组间比较采用t检验或Mann⁃WhitneyU检验,计数资料组间比较采用χ2检验或Fisher确切概率法,以P<0.05为差异有统计学意义。将两组之间单因素回归分析中P≤0.10的因素纳入多因素Logistic回归分析,计算相对危险度(OR值)及95%可信区间(95%CI),并确定与MG发病相关的独立危险因素,以P<0.05为差异有统计学意义。
2 结果
2.1 RA⁃MG患者临床特点分析在我院就诊期间首次诊断MG时患者中位年龄63.5(23.6)岁、RA中位病程9.7(8.4)年。对合并及未合并MG的RA患者进行对比,见表1。临床表现方面,RA⁃MG组患者脾大的发生率显著高于对照组[27.3%(3/11)vs.3.0%(1/33),P=0.043]。两组患者在晨僵、关节畸形、类风湿结节、淋巴结肿大,以及ILD、周围神经炎或血栓事件的发生率方面,差异均无统计学意义。两组患者均无合并冷凝集现象、冷球蛋白血症或高黏滞血症的记录。
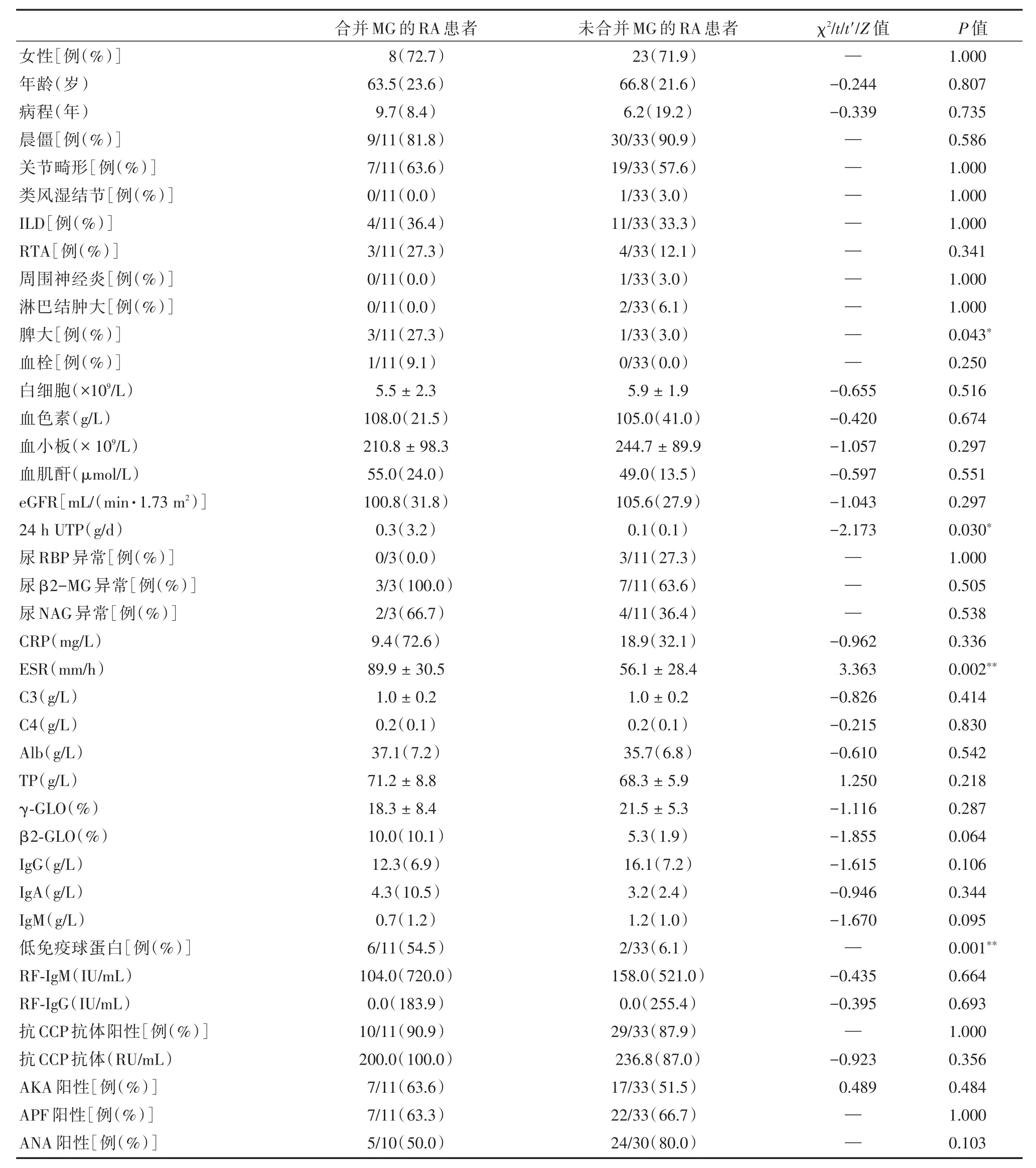
表1 合并及未合并MG的RA患者临床表现及实验室检查对比Tab.1 Comparison of clinical manifestations and laboratory parameters between rheumatoid arthritis patients with and without MG
2.2 RA⁃MG患者免疫学特点分析实验室检查方面,RA⁃MG患者低免疫球蛋白血症(hypoimmu⁃noglobulinemia)的发生率[54.5%(6/11)vs.6.1%(2/33),P=0.001]、ESR[(89.9 ± 30.5)mm/hvs.(56.1± 28.4)mm/h,P=0.002]、24 h UTP[0.3(3.2)mg/dvs.0.1(0.1)mg/d,P=0.030]水平均高于对照组,差异存在统计学意义。两组患者在血细胞计数、血清总蛋白(TP)、白蛋白(Alb)、血肌酐、eGFR,免疫球蛋白IgG、IgA、IgM、补体C3、C4、CRP水平、SPEP中γ⁃GLO及β2⁃GLO比例、肾小管受损指标尿RBP、β2⁃MG和NAG异常率、自身抗体包括RF⁃IgM和RF⁃IgG水平、抗CCP抗体、AKA、APF和ANA阳性率方面,差异均无统计学意义。二分类单因素回归发现,脾大、ESR增快、SPEP中β2⁃GLO所占比例增高、低免疫球蛋白血症、血清IgA水平升高及ANA阳性可能是RA患者发生MG的危险因素(P≤0.10),进一步进行多因素Logistic回归分析发现,ESR增快是RA患者发生MG的独立危险因素(P<0.05),见表2。

表2 单因素及多因素回归分析计算MG预测指标的粗略OR值和校正OR值Tab.2 Single and multiple logistic regression analyses to identify the risk factors for the development of MG in RA patients
2.3 RA⁃MG患者的诊断在全部11例诊断RA⁃MG的患者中,仅3例患者通过SPEP检测到M蛋白;包括这3例在内共8例通过血清IFE检测到M蛋白;5例通过尿IFE检测到M蛋白。1例患者血、尿M蛋白均为λ型,骨髓涂片中幼稚浆细胞为42%,免疫分型提示异常克隆性浆细胞,骨髓活检符合浆细胞瘤,MAGE⁃C1/CT7基因RT⁃PCR阳性,MM探针间期荧光原位杂交(fluorescence in situ hybridization,FISH)检测阳性。结合患者均存在X线证实的骨质疏松和病理性骨折,采用Durie⁃Salmon分期系统,诊断MM lambda型DSⅢA/Ⅱ期。2例患者因未行骨髓穿刺,最终未能明确诊断。其余患者诊断MGUS,其中1例患者在我院第一次诊断MG的14年前因皮肤变黑、双下肢无力于外院就诊,查血清IFE提示IgAλ,诊断POEMS综合征并行骨髓移植术。术后间断复查M蛋白逐渐转阴,28.6个月前复查SPEP和血、尿IFE仍未见异常。此后患者因RA于我科长期随诊,此次就诊复查血清IFE再次发现IgAλ型M蛋白,诊断MGUS。在诊断MGUS的患者中,共4例患者免疫分型检查可见极少量异常克隆性浆细胞,但结合患者骨髓检查异常浆细胞比例、骨髓活检及临床表现,尚未达到冒烟型骨髓瘤(SMM)或MM的诊断标准。
2.4 RA⁃MG患者的治疗将病例组及对照组患者既往全身使用糖皮质激素和DMARDs及生物制剂的比例进行对比,发现病例组患者MG诊断前全身糖皮质激素(45.5%vs.39.4%,P=0.738)、DMARDs(72.7%vs.78.8%,P=0.692)包括 MTX(54.5%vs.48.5%,χ2=0.121,P=0.728)和生物制剂(18.2%vs.15.2%,P=1.000)的使用率与对照组相比未见差异。诊断MG后,1例诊断MM的患者接受BCD(硼替佐米+地塞米松+环磷酰胺)方案化疗;其余患者中共4例加用全身糖皮质激素治疗,中位剂量相比对照组患者差异无统计学意义[泼尼松 0.0(10.0)mgvs.0.0(10.0)mg,Z=-0.211,P=0.833];两组患者接受DMARDs(80.0%vs.90.9%,P=0.575)或生物制剂(18.2%vs.12.1%,P=0.630)治疗的比例也未见差异。
2.5 RA⁃MG患者的随访评估共5例患者接受随访,随访时间3.7~32.6个月。1例患者最初诊断MGUS,危险分层为中-高危,在随访24.5个月后血M蛋白浓度较前增高,复查骨髓穿刺见幼稚浆细胞为11%,骨髓活检考虑浆细胞瘤,MAGE⁃C1/CT7、MM⁃FISH阳性。结合患者腰椎X线提示压缩性骨折,诊断MM,并予RD方案化疗。在随访至30.4个月时复查血清M蛋白2.5 g/L,复查骨髓涂片未见异常克隆性浆细胞。另1例患者在随访18.7个月后复查血M蛋白定量呈升高趋势,骨髓涂片、免疫分型虽然仍未见到异常的克隆性浆细胞,但出现了新的分子遗传学异常。值得注意的是,其血肌酐由105 μmol/L升至285 μmol/L、eGFR由61.37 mL/(min·1.73 m2)降至18.05 mL/(min·1.73 m2)。肾脏超声提示双肾弥漫性病变,肾穿刺活检提示间质多灶浆细胞及淋巴细胞浸润,肾间质纤维化,肾脏刚果红染色阴性。
3 讨论
RA是一种抗原驱动、T淋巴细胞介导的全身性自身免疫病。B淋巴细胞在RA的发病过程中也起着重要作用,可作为抗原呈递细胞,产生免疫球蛋白包括自身抗体。临床上,RA合并高球蛋白血症的情况并不少见,这与RA长期慢性的炎症刺激所致的B细胞活化、反应性浆细胞增生相关[10],以多克隆性最为常见。当患者出现异常克隆性球蛋白时,易被漏诊或误诊。本文对RA⁃MG患者独特的临床及免疫学特点进行分析,并对其诊治及预后展开讨论。
本研究结果表明,ESR增快是RA患者发生MG的独立危险因素,这与先前报道的SLE⁃MG患者特征类似[11]。笔者认为,这一方面是因为发生MG时,M蛋白包裹红细胞表面,使带有负电荷的红细胞之间排斥力减低,容易凝集而出现缗线状排列,进而导致血沉显著增快;另一方面,不除外病情活动度高、炎症重的RA患者更易出现B淋巴细胞和浆细胞活化并导致MG的发生。因本研究为回顾性,缺乏对RA病情活动度评估的数据,未能进行相关分析,是本文的一大缺陷。RA⁃MG患者存在低免疫球蛋白血症的患者比例更多,这与克隆性浆细胞或淋巴细胞过度增殖并分泌单克隆免疫球蛋白所导致的正常免疫球蛋白降低相关。与既往SLE⁃MG和SS⁃MG研究[11-12]结果不同的是,两组患者SPEP检测中γ⁃GLO的比例并未见到差异,而单因素回归分析发现,β2⁃GLO比例增高是RA患者发生MG的危险因素(P=0.049)。这可能与部分患者M蛋白分布于β球蛋白带而非γ球蛋白带存在一定相关性。两组患者在性别组成、发病年龄、出现MG时RA的病程、类风湿因子水平、CRP,以及血清IgA、IgG和IgM水平方面,差异均无统计学意义,这与国外报道的RA⁃MG患者特征相同[13]。此外,既往大规模群体研究[14]显示,自身免疫病的治疗药物如MTX的长期应用是患者发生淋巴增殖性疾病(lymphproliferative disorders,LPD)的危险因素,提示药物导致的免疫监视功能降低在LPD发病中的作用,但其在MG发病中的作用尚不明确。本研究未发现RA⁃MG的发生与既往使用全身糖皮质激素、包括MTX在内的DMARDs和生物制剂存在相关性。
对11例RA⁃MG患者的MG类型进行分析,发现RA合并MG以MGUS最为常见。MGUS是最常见的癌前病变之一,可以向MM及淋巴瘤等方向恶性转化。国际上根据患者M蛋白水平、类型和sFLCR对MGUS恶性转化为MM的风险进行分层[8]:如患者满足血清M蛋白为IgG型、水平<15 g/L,且sFLCR在正常范围(0.26~1.65)内,则为低危;如患者满足以上任意一条,则为低-中危;满足2条,为中-高危;满足3条,为高危。1例最初诊断中-高危MGUS的患者经24.5个月随访后最终确诊MM,并给予BD方案(硼替佐米+地塞米松)化疗。因此,在确诊RA⁃MG后,需注意进行风险评估,以便在患者向血液系统恶性肿瘤转化时及早发现。此外,1例患者在RA病程中曾确诊POEMS综合征,经骨髓移植治疗后血M蛋白转阴,在随访28.6个月后复查血清IFE再次发现M蛋白。此例患者是迄今为止有文献报道的第4例诊断POEMS综合征合并RA的病例[15],也是在进行骨髓移植后再次出现MGUS的首例RA⁃POEMS病例。另一例患者在诊断MGUS 18.7个月后发生肌酐进行性升高,结合骨穿和肾穿结果,考虑肾功能不全由浆细胞在肾小管、间质浸润所致,肾脏意义的单克隆免疫球蛋白病(MGRS)[16]可能性大,因患者未完善免疫电镜诊断证据尚不充分。因此,在合并MG的RA患者中需注意监测肾功能,以警惕浆细胞过度激活和M蛋白沉积所导致的肾脏损害。回顾本研究中RA⁃MG患者M蛋白的类型,与先前报道[17]不同的是,IgA型所占比例最高。最终诊断MM的2位患者分别为λ游离轻链和IgAκ型,这与此前认为非IgG型MGUS向MM转化的风险较高相契合[8]。
在治疗方面,诊断MM的2例患者分别加用以硼替佐米为主的联合化疗方案BCD和BD治疗。硼替佐米(万珂)是一种新型蛋白酶体抑制剂。FRÖHLICH等[18]报道,合并MM的SLE患者在使用硼替佐米化疗后,不仅MM达到临床缓解,SLE的临床症状和实验室异常也明显改善,考虑这种作用与硼替佐米清除部分浆细胞,进而抑制免疫反应相关。与此类似,我们发现2例RA⁃MM患者经过化疗后,关节肿痛症状也有所缓解,炎症指标如CRP、ESR较前呈下降趋势。诊断MGUS的RA患者在全身糖皮质激素的用量、加用免疫抑制剂和生物制剂的情况与未合并MG的RA患者无显著差异,这与血液领域的专家共识[19]类似,在风湿免疫病患者发生MGUS时,应以监测M蛋白水平、骨髓象及脏器损害,积极治疗原发病为主,而非仅因出现异常单克隆免疫球蛋白即给予化学治疗。
综上所述,RA患者可在病程中合并MG,以MGUS最为常见,也可发生MM等血液系统恶性肿瘤。当RA患者出现ESR明显增快,或存在脾大、不明原因肾脏受累,及低免疫球蛋白血症时,需高度警惕MG的发生,及时完善SPEP及血、尿IFE检查,必要时完善骨髓相关检查及骨质破坏的影像学评估。除诊断血液系统恶性肿瘤的患者需转至血液科规范化学治疗外,合并MGUS的患者应以治疗RA为主,同时需对MGUS进行危险度分层和密切随访,以便早期发现恶性转化并把握正确的治疗时机。
[1]BROWN L M,GRIDLEY G,CHECK D,et al.Risk of multiple myeloma and monoclonal gammopathy of undetermined signifi⁃cance among white and black male United States veterans with prior autoimmune,infectious,inflammatory,and allergic disor⁃ders[J].Blood,2008,111(7):3388⁃3394.
[2]WENG M Y,HUANG Y T,LIU M F,et al.Incidence of can⁃cer in a nationwide population cohort of 7852 patients with pri⁃mary Sjogren′s syndrome in Taiwan[J].Ann Rheum Dis,2012,71(4):524⁃527.
[3]BRITO⁃ZERON P,RETAMOZO S,GANDIA M,et al.Mono⁃clonal gammopathy related to Sjögren syndrome:a key marker of disease prognosis and outcomes[J].J Autoimmun,2012,39(1⁃2):43⁃48.
[4]HEMMINKI K,LIU X,FÖRSTI A,et al.Effect of autoim⁃mune diseases on incidence and survival in subsequent multiple myeloma[J].J Hematol Oncol,2012,5:59.
[5]ARNETT F C,EDWORTHY S M,BLOCH D A,et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J].Arthritis Rheum,1988,31(3):315⁃324.
[6]ALETAHA D,NEOGI T,SILMAN A J,et al.2010 Rheuma⁃toid arthritis classification criteria:an American College of Rheumatology/European League Against Rheumatism collabora⁃tive initiative[J].Arthritis Rheum,2010,62(9):2569⁃2581.
[7]RAJKUMAR S V,DIMOPOULOS M A,PALUMBO A,et al.International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma[J].Lancet Oncol,2014,15(12):e538⁃548.
[8]KYLE R A,DURIE B G,RAJKUMAR S V,et al.Monoclonal gammopathy of undetermined significance(MGUS)and smol⁃dering(asymptomatic) multiple myeloma:IMWG consensus perspectives risk factors for progression and guidelines for moni⁃toring and management[J].Leukemia,2010,24(6):1121⁃1127.
[9]DISPENZIERI A.POEMS syndrome[J].Blood Rev,2007,21(6):285⁃299.
[10]RAPOSO A,PEIXOTO D,BOGAS M.Monoclonal gammopa⁃thy and rheumatic diseases[J].Acta Reumatol Port,2014,39(1):12⁃18.
[11]ALI Y M,UROWITZ M B,IBANEZ D,et al.Monoclonal gam⁃mopathy in systemic lupus erythematosus[J].Lupus,2007,16(6):426⁃429.
[12]TOMI A L,BELKHIR R,NOCTURNE G,et al.Monoclonal gammopathy and risk of lymphoma and multiple myeloma in pa⁃tients with primary Sjögren′s syndrome[J].Arthritis Rheuma⁃tol,2016,68(5):1245⁃1250.
[13]GARTON M J,KEIR G,DICKIE A,et al.Prevalence and long⁃term significance of paraproteinaemia in rheumatoid arthritis[J].Rheumatology(Oxford),2006,45(3):355⁃356.
[14]HOSHIDA Y,TOMITA Y,ZHIMING D,et al.Lymphoprolifer⁃ative disorders in autoimmune diseases in Japan:analysis of clinicopathological features and Epstein⁃Barr virus infection[J].Int J Cancer,2004,108(3):443⁃449.
[15]AKAGI T,MUKAI T,KODAMA S,et al.POEMS syndrome in a patient with rheumatoid arthritis[J].BMJ Case Rep,2017,pii:bcr⁃2017⁃220875.
[16]BRIDOUX F,LEUNG N,HUTCHISON C A,et al.Diagnosis of monoclonal gammopathy of renal significance[J].Kidney Int,2015,87(4):698⁃711.
[17]KELLY G,BAIRD G,FOSTER H,et al.Prognostic signifi⁃cance of paraproteinaemia in rheumatoid arthritis[J].Ann Rheum Dis,1991,50(5):290⁃294.
[18]FRÖHLICH K,HOLLE J U,ARIES P M,et al.Successful use of bortezomib in a patient with systemic lupus erythemato⁃sus and multiple myeloma[J].Ann Rheum Dis,2011,70(7):1344⁃1345.
[19]BIRD J,BEHRENS J,WESTIN J,et al.UK Myeloma Forum(UKMF)and Nordic Myeloma Study Group(NMSG):guild⁃lines for the investigation of newly detected M⁃proteins and the management of monoclonal gammopathy of undetermined signifi⁃cance(MGUS)[J].Br J Haematol,2009,147(1):22⁃42.
