组蛋白去甲基化酶KDM3A在乳腺浸润性导管癌中的表达及临床意义
2018-05-11郑树涛李欣欣刘文亚
姚 娟, 郑树涛, 马 华, 李欣欣, 刘文亚
(新疆医科大学第一附属医院1影像中心, 2临床医学研究院, 乌鲁木齐 830054)
美国肿瘤协会于2017年1月发布的数据显示,乳腺癌是女性恶性肿瘤中发病率最高的疾病[1]。KDM3A会阻断雌激素受体信号通路,对乳腺癌细胞的增殖很重要[2]。本实验从组织水平检测组蛋白去甲基化酶KDM3A在乳腺癌中的表达及其与临床资料的相关性,并且和评价乳腺癌预后转移的指标雌激素受体ER、孕激素受体PR、人类表皮生长因子HER2做相关性分析,以期为乳腺癌的生物学评价重新寻找一种新的指标。
1 对象与方法
1.1研究对像上海芯超公司组织芯片,为150例经手术切除并经病理证实的乳腺浸润性导管癌。全部为女性患者,平均年龄49岁,中位年龄56岁,随访时间9~12.5 a。
1.2免疫组化结果判读乳腺癌细胞的胞浆中出现黄色或棕黄色颗粒则提示KDM3A蛋白表达为阳性。KDM3A免疫组化结果采用半定量双评分法评价。每片随机选取10个高视野。每个字段被计数为200细胞。阳性细胞记录为< 10%为0分;10%~50%为1分;51%~75%为2分;>75%为3分;细胞着色强度记为:不着色为0分;浅黄色为1分;黄色为2分;棕褐色为3分.每个肿瘤样本的染色强度与百分比得分相乘后得出最终得分,肿瘤最后确定为(-)0分;(+)≤4分;(++)5~8分;(+++)≥9分。阴性弱阳性和中等阳性为低表达组,强阳性为高表达组。
1.3统计学处理采用SPSS 22.0 统计软件对所有数据进行分析,运用χ2检验KDM3A与浸润性乳腺癌患者临床病理参数,Spearman等级相关分析检测KDM3A与雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子(HER2)的相关性,Kaplan-meier法绘制生存曲线,对生存率采用Log-rank进行单因素分析、Cox回归模型多因素分析。
2 结果
2.1KDM3A蛋白与ER、PR及HER2的相关性分析采用Spearman秩相关对KDM3A和ER、PR、HER2进行分析,结果显示KDM3A和ER、PR、HER2差异无统计学意义(P>0.05)。
2.2Log-rank生存分析本组150例患者中,截止至随访时间结束,5年总体存活率为84%(126/150)。各指标生存率见表1。Log-rank分析结果显示:浸润性乳腺癌患者预后与患者的年龄、病理分级、肿瘤大小、淋巴结转移及KDM3A无关,而与临床分期、ER蛋白、PR蛋白表达有关(P<0.05)。
2.3Cox回归多因素生存分析将年龄、肿瘤直径、组织分级、淋巴结有无转移、临床分期、KDM3A表达、ER、PR以及HER2引入Cox模型进行多因素分析,结果显示临床分期、PR、KDM3A是乳腺癌患者预后因素(P<0.05),见表2。
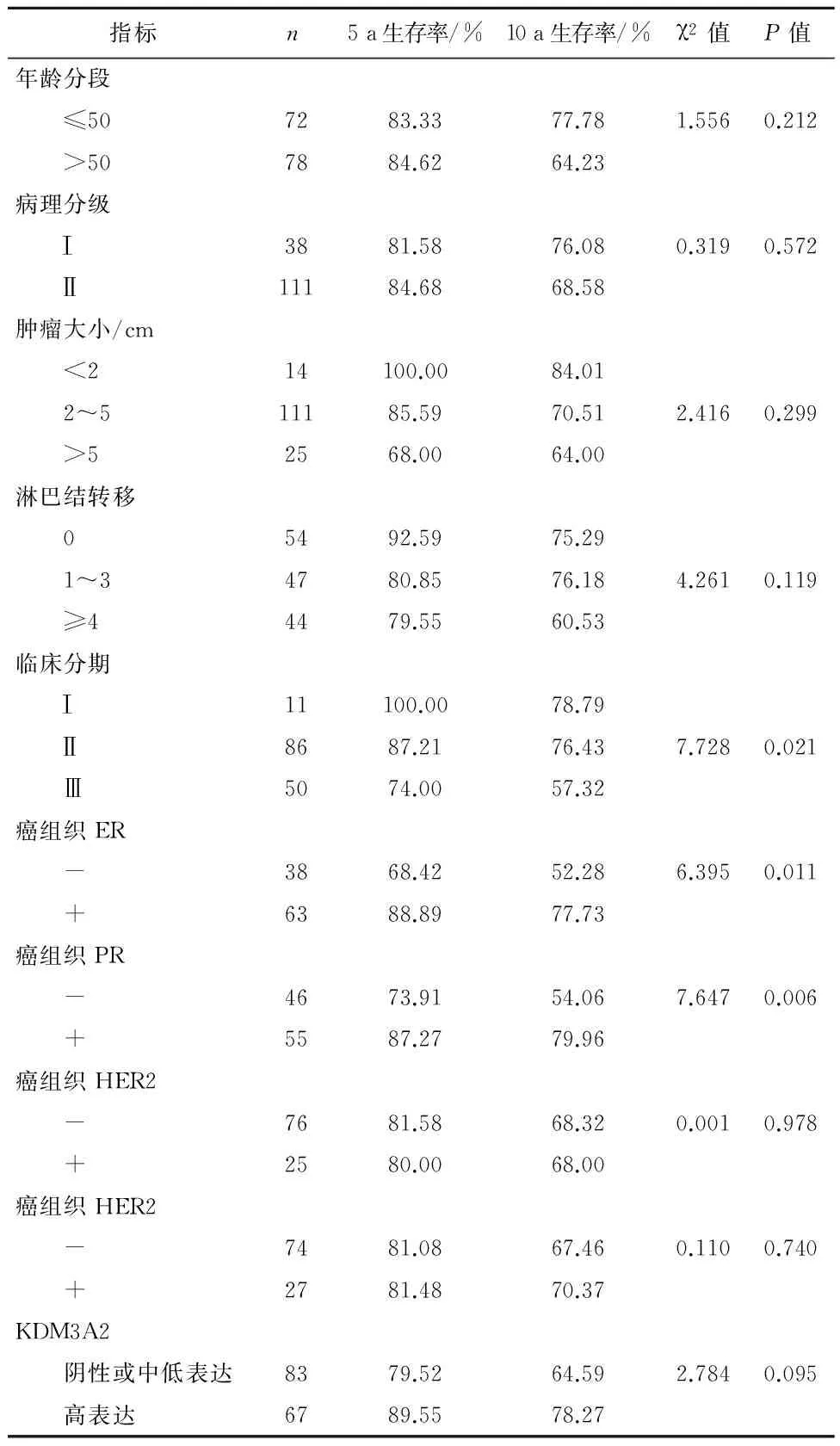
表1 浸润性乳腺癌患者生存状态单因素分析结果

表2 浸润性乳腺癌患者COX回归多因素生存分析
3 讨论
乳腺癌是女性发病率及致死率最高的恶性肿瘤,但是至今乳腺癌的发病机制仍没有达到一个共识,以往对乳腺癌发生、发展及转归的研究主要集中在基因突变、基因缺失、重组及重排等遗传学机制上面,但很多学者在研究表观遗传学的过程中,发现人类部分基因与乳腺癌的发生、发展、转归与浸润有着十分重要的联系。
Yamane等[3]报道KDM3A参与H3K9的甲基化和转录,激活雄激素。KDM3A在精子发生发展过程中及缺氧状态下的起到重要作用[4-6]。KDM3A参与了肺癌发生,是肿瘤异种移植生长所必需的并且可以诱导神经母细胞瘤[7-10]、肝癌及乳腺癌迁移和侵袭[11-12]。本研究的目的是为了评估KDM3A在乳腺癌中的表达及与相关临床资料的相关性。本研究结果显示KDM3A表达与临床分期、肿瘤大小、HER2、ER、PR表达这些指标差异无统计学意义。Yamada等[11]研究认为KDM3A与肝细胞癌的表达及临床病理特征等多因素Cox回归分析无相关性,同时发现KDM3A是肝癌复发的独立预测指标。然而,在胃癌中KDM3A表达升高已被发现与预后相关,同时有研究证明KDM3A与肾细胞癌的进展相关[12]。Zhao等[13]在研究中也发现在前列腺癌组织中KDM3AmRNA的表达较良性前列腺增生明显增加,上述这些研究表明KDM3A在不同的肿瘤中的表达可能不同。
Wang等[14]研究表明,KDM3A的表达与预后较差的乳腺癌患者之间差异有统计学意义,本次研究结果中单因素分析KDM3A与乳腺癌的预后差异无统计学意义。目前KDM3A的研究基本偏重于基础研究,临床研究相对较少,本研究为临床研究,但是缺乏对比。虽然在单因素分析中,KDM3A在乳腺癌预后与PR、EP相比,差异无统计学意义,但在本次研究多因素回归分析结果显示,临床分期、PR、KDM3A差异有统计学意义,说明这3种指标可以作为乳腺癌患者综合预后因素。后续需要对此研究结果进行细胞水平研究。
本实验中得出在150例浸润性乳腺癌患者中,KDM3A和ER、PR、HER2相关系数检验均>0.05,说明KDM3A和我们在临床中常用的指标关系不大。但是在多因素回归分析中,美国癌症联合会第6版临床分期、PR、KDM3A的P值均<0.05,说明这几个指标可以作为生存分析综合指标。由此推测在乳腺癌发生、发展中,KDM3A可以作为乳腺癌的预后指标,但是相互之间的分子机制还不清楚。
分析本研究与文献[2,15]不一致的原因可能为:(1)组织芯片有一定局限性,本实验选择组织芯片,其芯片本身也可能导致最终结果的偏差;(2)制备组织芯片的组织的保存时间和免疫组化评分标准的选择也是不可忽略的因素;(3)没有研究KDM3A体外细胞功能,无法评估其对乳腺癌细胞生物学作用介导的细胞增殖、侵袭和迁移的能力。
总之,目前乳腺癌的发生、发展机制仍然不清,推测KDM3A有可能作为乳腺癌的监测基因,其表达水平可以提示乳腺癌的预后程度,有助于临床治疗及判断患者预后情况。
参考文献:
[1] SIEGEL R L, MILLER K D, JEMAL A, et al. Cancer statistics, 2017[J].CA Cancer J Clin,2017,67(1):7-30.
[2] RAMADOSS S, GUO G, WANG CY. Lysine demethylase KDM3A regulates breast cancer cell invasion and apoptosis by targeting histone and the non-histone protein p53[J].Oncogene,2017, 36(1):47-59.
[3] YAMANE K, TOUMAZOU C, TSUKADA Y, et al. JHDM2A, a JmjC-containing H3K9 demethylase, facilitates transcription activation by androgen receptor[J].Cell,2006,125(3):483-495.
唐宋诗词源远流长,千百年来闪烁着不朽的艺术光芒。如飘逸豪放的李白,沉郁顿抑的杜甫,清扬畅丽的白居易,凄婉优柔的李煜,闲雅清婉的李清照,豪放旷达的苏轼,雄放流畅的陆游……沿着字里行间向我们走来,向我们说话,向我们呈现他们整体的人格、气质、风骨,凸现出唐宋诗词在传统人文中的独特魅力,感受灵魂难言的欣悦和洗礼。
[4] OKADA Y, SCOTT G, RAY M K, et al. Histone demethylase JHDM2A is critical for Tnp1 and Prm1 transcription and spermatogenesis[J]. Nature ,2007,450(7166):119-123.
[5] BEYER S, KRISTENSEN M M, JENSEN K S, et al. The histone demethylases JMJD1A and JMJD2B are transcriptional targets of hypoxia-inducible factor HIF[J]. J Biol Chem ,2008,283(52):36542-36552.
[6] POLLARD P J, LOENARZ C, MOLE D R, et al. Regulation of jumonji-domain-containing histone demethylases by hypoxia-inducible factor (HIF)-1alpha[J]. Biochem J,2008,416(3):387-394.
[7] ZHOU X, SUN H, ELLEN T P,et al. Arsenite alters global histone H3 methylation[J]. Carcinogenesis, 2008,29(9):1831-1836.
[8] KASIOULIS I,SYRCD H M,ADAMS I R,et al.Kdm3a lysine demethylase is all Hsp90 client required for cytoskeletal rearrangements during spermatogenesis[J].Mol Biol Cell,2014(25):1216-1233.
[9] OSAWA T, TSUCHIDA R, MURAMATSU M, et al. Inhibition of histone demethylase JMJD1A improves anti-angiogenic therapy and reduces tumor-associated macrophages[J].Cancer Res, 2013,73(10):3019-3028.
[11] YAMADA D, KOBAYASHI S, YAMAMOTO H, et al. Role of the hypoxia-related gene, JMJD1A, in hepatocellular carcinoma: clinical impact on recurrence after hepatic resection[J]. Ann Sur Oncol,2012, 19(3):355-364.
[12] GUO X, SHI M, SUN L, et al. The expression of histone demethylase JMJD1A in renal cell carcinoma[J]. Neoplasma, 2011, 58(2):153-157.
[13] ZHAO Q Y, LEI P J, ZHANG X, et al. Global histone modification profiling reveals the epigenomic dynamics during malignant transformation in a four-stage breast cancer model[J]. Clin Epigenetics, 2016, 8(4):34-46.
[14] WANG L, CHANG J, VARGHESE D, et al. A small molecule modulates jumonji histone demethylase activity and selectively inhibits cancer growth[J]. Nat Commun,2013, 4(7):2035-2044.
