心率变异性对慢性心力衰竭病情评估及预后的应用价值
2018-05-11周利民
刘 玉, 周利民, 张 军
(安徽省滁州市第一人民医院心血管内科, 安徽 滁州 239000)
慢性心力衰竭(chronic heart failure,CHF)是由于多种原因引起的一组临床综合征,主要指在各种严重心血管疾病的中晚期阶段,由于长时间的压力或者容量超过负荷,从而使心肌收缩力减退,引起心室泵血和(或)充盈功能下降[1]。慢性心力衰竭可由各种各样的原因引起,包括心肌炎、室间隔缺损、缺血性心脏病、风湿性心脏病、动脉瓣狭窄、高血压等许多疾病[2]。慢性心力衰竭的发病年龄广泛,且具有反复发作的特点,有很高的病死率和致残率。心率变异性(Heart rate variability,HRV)产生于自主神经系统对心脏窦房结的调制,它使得心搏间期一般存在几十毫秒的差异和波动[3]。心率变异的测定可以很好地反映患者自主神经调节功能状态的变化,在慢性心力衰竭患者临床诊断治疗中,能够较为精准地诊断患者心脏发生的窦性心律不齐或心脏节律变化异常等症状。近年来,许多临床相关研究发现,HRV可为冠心病诊断、心血管疾病判断和病情预后的评价提供重要价值[4-5]。本研究旨在评价心率变异性指标对慢性心力衰竭患者病情评估及预后的应用价值,探讨该指标与CHF病情的关系及预后预测的价值,从而为CHF患者的临床诊断及治疗和预后评价提供临床依据。
1 资料与方法
1.1一般资料选取2015年3月-2016年9月在本院住院治疗的慢性心衰患者共249例作为研究对象。(1)心力衰竭诊断标准:参照2007年中国《慢性心力衰竭诊断治疗指南》,根据患者临床症状和体征。包括有无呼吸困难、乏力、水肿等,并结合超声心动图、胸部X线、心电图等检查,经我院心脏内科专家参照指南并根据患者以上临床表现和检查指标综合判断。(2)纳入标准:①符合上述诊断标准;②患者年龄在40~75岁;③自愿加入本研究。(3)排除标准:①患者入院前半年曾发生急性脑血管疾病;②入院前3个月内发生急性冠脉综合征;③急性心力衰竭;④患者心率<50次/min,或植入心脏起搏器,或≥Ⅱ度房室传导阻滞;⑤NYHA心功能分级Ⅱ~Ⅳ级者;⑥患者合并心房颤动、病态窦房结综合征等;⑦合并肝肾功能不全、甲状腺疾病、肺源性心脏病者。根据上述标准选取患者,患者年龄51~72岁,其中男性166例,女性82例。根据NYHA心功能分级,将上述患者分为观察组(Ⅱ~Ⅲ级)和对照组(Ⅳ级),两组患者一般资料比较无统计学差异(P>0.05),具有可比性,见表1。

表1 两组患者一般资料比较
1.2方法选用世纪今科公司生产的动态心电检测系统(编号:14730642),对两组患者的窦性心律进行24 h连续自动分析,并院心脏内科专家进行校正,剔除干扰等异位心律。对R-R 间期变异进行分析处理。选用时域定量指标:心率总体标准差(SDNN)、全程每 5分钟 段RR 间期平均值的标准差(SDANN)、心率差值均方的平均根(RMSSD)、三角指数。以HRV时域定量指标作为评价标准,以患者的风险事件发生情况作为预后指标。

2 结果
2.1两组患者HRV时域定量指标参数比较两组患者HRV时域定量指标参数进行比较,观察组的SDNN、SDNANN、RMSSD、HRV三角指数的值分别为(71.92±16.59)、(75.32±14.23)、(17.10±6.38)、(14.39±7.32),对照组的SDNN、SDNANN、HRV三角指数、RMSSD的值分别为(66.95±11.72)、(69.28±12.56)、(14.37±3.94)、(11.79±5.44),与对照组相比,观察组SDNN、SDANN、RMSSD、三角指数均显著降低,差异均有统计学意义(P<0.01),结果见表2。
2.2CHF组间不同程度心衰患者的HRV时域定量指标分析比较观察组NYHA分级Ⅲ级的时域定量指标参数SDNN、SDANN、RMSSD、三角指数分别为(87.12±19.73)、(86.1±19.48)、(19.42±8.36)、(16.04±9.32),对照组NYHA分级Ⅱ级的时域定量指标参数SDNN、SDANN、RMSSD、三角指数分别为(64.27±13.85)、(60.73±11.64)、(15.03±4.28)、(10.95±4.46)。与Ⅲ级相比,Ⅱ级的时域定量指标参数均显著低于Ⅲ级分级(P<0.01),差异均有统计学意义(P<0.01),见表3。
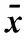
表2 两组患者HRV时域定量指标参数比较(分, ±s)
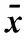
表3 两组患者HRV时域定量指标参数比较(分,±s)
注:与对照组比较,*P<0.05; 与Ⅲ级比较,△P<0.05。
2.3两组患者的风险事件发生情况比较观察组的窦性心律失常发生62例(53.9%)、心脏病事件22例(19.1%)、窦性心律失常伴心脏病事件13例(11.3%),观察组的窦性心律失常发生37(27.6%)、心脏病事件11例(8.2%)、窦性心律失常伴心脏病事件6例(4.5%),观察组患者心血管风险事件发生例数明显高于对照组,差异均有统计学意义(P<0.05),见表4。
3 讨论
慢性心力衰竭是多种心血管疾病中晚期面临的共同转归。随着年龄的增加,糖尿病、心血管疾病尤其是冠心病和高血压病等并发症,也是促使心力衰竭发生的重要因素[6]。CHF是一种复杂的临床综合征,也是一种特殊的进行性病症,随着病变的进展和演变,心肌重构不断加深,患者的病情也会很快恶化,引起一系列严重后果[7]。心率变异性是指一定时间内窦性心率的周期性改变,表现为心搏间期之间的微小变异。HRV是反映交感—副交感神经张力及其平衡的重要指标,可以很好评价心脏的自主神经系统功能,被誉为评估自主神经功能的最佳指标[8]。HRV在临床上的应用早已开展,已有很多研究将其用于对一些常见病诸如冠心病、高血压、糖尿病等疾病的自主神经功能改变的判断上,取得了很好的效果[9-10]。有研究显示HRV可以作为预测心血管疾病患者的恶性心律失常危险以及心脏猝死发生风险的重要独立指标[11-12]。探讨心率变异性指标对慢性心力衰竭病情评估及预后的应用价值,对慢性心力衰竭患者的临床诊断及治疗和预后评价提供临床依据,具有重要意义。

表4 两组患者的风险事件发生情况比较[n(%)]
本研究将HRV指标应用于CHF的病情评估及预后进行分析,结果发现,与对照组相比,观察组患者HRV时域定量指标各参数SDNN、SDANN、RMSSD、三角指数均显著高于对照组,且进一步分析发现,随着心衰程度的加重,HRV时域定量指标各参数也会显著升高,表明心衰病情的进展对心肌的损害也越发加重,心脏副交感神经活性也明显降低,交感神经活性相对增强,即心脏迷走神经功能减弱或交感迷走神经平衡失调,最终表现为交感神经张力的增高,此时患者可出现循环系统的机能亢进的临床表现,临床表现常可出现心律失常、心悸、憋气、血压升高等一系列的症状,此时患者体内神经-体液系统也会发生一系列变化,可出现代谢障碍,加重心脏病变。严重者可出现心肌细胞肥大、非肌性细胞增殖及心肌纤维化等病理改变,加重心衰的进展和恶化[13-14]。而本文研究结果表明HRV的参数随着心衰严重程度的变化而变化,这提示HRV这一指标对评估老年慢性心衰患者病情的诊断和分析具有较好的参考价值,李克强等的研究结果也显示HRV的变化对于CHF患者病情的评价具有积极的意义[1, 9]。同时,对于患者病情的预后而言,观察组的风险事件发生率显著高于对照组风险事件,表明随着心衰严重程度的增加,心肌功能严重恶化,心衰风险事件发生率升高,患者预后情况不容乐观[15],提示HRV的这一指标对评估慢性心衰患者的预后具有重要的意义,这与袁春野等[2]与Echeverria等[16]的研究结果也相一致。
综上所述,心率变异性的这一指标对评估慢性心衰患者病情的评价以及预后的评判具有重要的意义。
参考文献:
[1] 李克强,胡嘉涛,邹海平,等. 心率变异时域对老年慢性心力衰竭预后危险分级的定量研究[J]. 中国现代医药杂志, 2014,16(6):8-10.
[2] 袁春野,任明. 慢性心力衰竭患者心率变异变化的临床研究现状及进展[J]. 世界最新医学信息文摘, 2017,17(2):42.
[3] 杜英,兰军,涂昌,等. 心率变异性与冠心病充血性心力衰竭患者的相关性研究[J]. 黑龙江医药科学, 2015,38(3):78-79.
[4] WU L, JIANG Z, LI C, et al. Prediction of heart rate variability on cardiac sudden death in heart failure patients:a systematic review [J]. INT J CARDIOL, 2014, 174(3):857-860.
[5] REIS M S, ARENA R, ARCHIZA B, et al. Deep breathing heart rate variability is associated with Inspiratory muscle weakness in chronic heart failure[J]. Physiother Res Int, 2013, 19(1):16-24.
[6] ABLONSKYTE-DUDONIENE R, BAKSYTE G, CEPONIENE I, et al. Prognosis of in-hospital myocardial infarction course for diabetic and nondiabetic patients using a noninvasive evaluation of hemodynamics and heart rate variability[J]. Medicine, 2013, 49(6):262-272.
[7] 刘向阳,唐良秋,范文茂,等. 高血压合并冠心病患者血同型半胱氨酸、血压及心率变异的相关性研究[J]. 中国实用医药, 2017,12(2):1-3.
[8] FLATT A, ESCO M R. Heart rate variability stabilization in athletes:towards more convenient data acquisition.[J]. Clin Physiol Funct Imaging, 2016, 36(5):331-336.
[9] 李克强,胡嘉涛,晏斌林,等. QRS间期联合心率变异对慢性心衰评估及预后的临床价值[J]. 海南医学, 2015,26(8):1129-1132.
[10] 齐欣,郭书文,陈剑明,等. 益气活血法联合酒石酸美托洛尔治疗冠心病心律失常的临床研究[J]. 中华中医药学刊, 2017,35(2):279-282.
[11] 刘芹. 稳心颗粒联合美托洛尔缓释片对慢性心衰合并室性心律失常患者心功能及心率变异性的影响[J]. 慢性病学杂志, 2017,18(1):110-112.
[12] 吴立杰. 美托洛尔联合非洛地平对高血压并冠心病患者心率变异性及血压晨峰的影响[J]. 深圳中西医结合杂志, 2017, 27(14):146-148.
[13] 郭宏博,李春梅,李文国. 曲美他嗪对老年慢性心力衰竭患者自主神经功能的影响[J]. 中国继续医学教育, 2016,8(26):165-166.
[14] 刘佳琨. 2型糖尿病合并慢性心力衰竭中医证型与心率变异性的关系[J]. 河北中医, 2016,38(7):1004-1006.
[15] 孙有利. 冠心病充血性心力衰竭患者心率变异性分析[J]. 医疗装备, 2015,(4):50-51.
[16] ECHEVERRIA J C, INFANTE O, PEREZGROVAS H, et al. Effects of orthostatism and hemodialysis on mean heart period and fractal heart rate properties of chronic renal failure patients[J]. Artificial Organs, 2017,41(11):1026-1034.
