冰鲜鱼和膨化饲料中不同糖类水平对乌鳢生长性能及糖代谢的影响
2018-05-11侯涌侯艳彬姚垒戴滨阳钱利纯范京辉2
侯涌,侯艳彬,姚垒,戴滨阳,钱利纯*,范京辉2*
(1.浙江大学动物科学学院,农业部华东动物营养与饲料重点实验室,杭州310058;2.杭州市农业科学研究院,杭州310024)
乌鳢(Ophiocephalus argus)俗称黑鱼、乌鱼、蛇头鱼、财鱼、生鱼、文鱼等,是一种广泛分布于我国南北水域的肉食性淡水鱼类。其肉质鲜美、骨刺较少、含肉率高,且肉质富含营养,蛋白质含量较高,是人们的“盘中佳肴”。研究表明:乌鳢的平均含肉率为68.24%,高于四大家鱼和鲤、鲫、鲂等常见鱼种[1-2];乌鳢肉中粗蛋白高达18.9%,粗脂肪仅为4.25%,且氨基酸组成明显优于植物性蛋白,并富含人体所必需的钙、磷、铁、锌等矿物质元素[3]。
作为肉食性鱼类,乌鳢对配合饲料中糖类的利用能力较低,与乌鳢的大规模集约化养殖相比,至今对乌鳢的配合饲料研发尚不成熟,关于乌鳢营养需求的研究也较少。研究表明,初始质量为3.38 g左右的乌鳢,其适宜饲料组成为蛋白质45%,脂肪8%,糖类16%[4]。另有研究表明,初始质量为50 g左右的乌鳢,其适宜饲料组成为蛋白质40%,脂肪8%,糖类20%,有效磷添加量0.8%[5]。目前,乌鳢的人工集约化养殖主要以饲喂冰鲜饲料为主。由于冰鲜饲料资源较为紧缺,导致其价格不断上涨,给乌鳢的人工养殖造成很大压力。此外,在投喂冰鲜饲料时,由于饲料在水中流失及鱼类采食后大量的含氮废物排出,造成水体污染、病原体大量繁殖、鱼苗成活率下降、换水频繁等负面影响,进一步增加了养殖成本;因此,对乌鳢配合饲料的研发迫在眉睫。通过研究冰鲜鱼与膨化饲料中不同糖类含量对乌鳢生长性能及糖代谢相关酶活性的差异,不仅可以为乌鳢利用糖类的研究奠定一定的理论基础,还可以为乌鳢配合饲料的研发提供理论依据。
1 材料与方法
1.1 试验日粮
试验Ⅰ组日粮为冰鲜鱼:试验Ⅱ、Ⅲ和Ⅳ组日粮为膨化饲料,以鱼粉为主要蛋白源,鱼油为脂肪源,面粉为主要糖类源,粗蛋白与粗脂肪含量基本一致。由于面粉含量低于13%时饲料无法有效成型,所以最低添加量为13%;若以1%、2%梯度增加,面粉添加量变化不明显,若添加量以4%梯度递增,试验Ⅳ组面粉添加量将会达到21%,超出了水生动物不高于20%面粉含量的要求,所以试验Ⅱ组、Ⅲ组和Ⅳ组的膨化饲料分别添加13%、16%和19%的面粉(含糖量分别为17.48%、19.55%和21.63%),配方见表1。
1.2 试验动物与试验设计
试验所用的1 500尾乌鳢购于浙江省湖州市某渔场。试验鱼饲养在浙江欣欣饲料有限公司水产养殖基地水泥池中,禁食1 d后,以含13%糖类组饲料作为驯化饲料,每天8:00和17:00各投喂1次至饱食,驯化时间为3周。驯化结束后,对试验鱼进行称量、分组。选择健康、规格基本一致,体质量平均为(184.60±0.05)g的乌鳢鱼苗1 280尾,随机分为试验Ⅰ组、Ⅱ组、Ⅲ组和Ⅳ组。每组4个重复,每个重复80尾鱼,分别饲喂于16个水泥池(规格4 m×5 m×2 m)中,正式试验期为11周。试验期平均水温(26.3±1.7)℃,溶氧量5.5 mg/L左右,氨氮1.3 mg/L左右,盐度35%左右,pH(8.0±0.2)左右。定时定期巡塘,每天做好生产记录,若有死鱼及时捞出并称量记录。
试验期试验Ⅱ、Ⅲ和Ⅳ组每日以鱼体质量的0.5%左右投喂膨化饲料,试验Ⅰ组以3%~5%投喂冰鲜鱼。每日8:00与17:00各投喂1次,投喂0.5 h后,观察采食状况,估计采食量,并把多余饲料吸出。每15 d换水1次,水源为消毒后的池塘水,每次换水1/3,日夜连续充气增氧。每天定时巡塘,每天做好投喂记录,及时捞出网箱中死鱼并称量记录。观察乌鳢的采食情况,根据天气、鱼的状态等及时调整投喂量。

表1 试验饲料配方及营养组成(干质量)Table1 Formulation and nutrition composition of experimental diet(dry mass) %
1.3 样品采集与指标测定
1.3.1 样品采集
试验结束后,将池塘内的乌鳢禁食24 h后全部捞出称量,记录每个池塘的乌鳢尾数。然后每个池塘取10尾大小、规格相当的乌鳢放于水族箱内暂养,待乌鳢采食3、6、9、12和24 h后,每组分别取8尾进行样品采集。样品采集前,称量体质量、测量体长并记录。屠宰前,尾静脉采血,血样用肝素抗凝,在4℃、4 000 r/min条件下离心15 min制备血浆,上清液移入冻存管,冻存于液氮中,最后移入-70℃冰箱保存备用。采完血后,将乌鳢解剖,取肝称量并记录,然后放入液氮冻存,最后移入-70℃冰箱保存备用。
1.3.2 指标测定
记录每个网箱剩余乌鳢的尾数、初质量与末质量、体长、采食量、肝质量等指标,计算平均个体日增量、增质量率、特定生长率、成活率、肥满度、饲料系数、肝胰腺指数等生长指标。饲料在105℃下烘干后,测定其水分含量,分别采用凯氏定氮法、索氏抽提法、灼烧法(550℃)、3,5-二硝基水杨酸法测定其粗蛋白、粗脂肪、粗灰分和总糖含量。肝糖原、血糖、胰岛素、胰高血糖素含量均采用试剂盒(购于南京建成生物工程研究所)进行测定。葡萄糖激酶(glucokinase,GK)活性采用上海酶联生物科技有限公司提供的试剂盒进行测定。己糖激酶(hexokinase,HK)和果糖-1,6-二磷酸酶(fructose 1,6-bisphosphatase,FBPase)活性均采用苏州科铭生物科技有限公司提供的试剂盒进行测定。
1.4 计算公式和数据处理
增质量率=(平均末质量-平均初质量)/平均初质量×100%;特定生长率=(ln平均末质量-ln平均初质量)/试验天数×100%;饲料效率=尾均增量/尾均摄食量×100%;摄食率=饲料摄入量/[(初均质量+末均质量)/2×试验天数]×100%;肥满度=(体质量/g)/[(体长/cm)3]×100%;成活率=试验结束时试验鱼总数/试验开始时试验鱼总数×100%。
试验数据用SPSS 16.0统计软件进行方差分析,采用邓肯法进行多重比较,所有数据均以“平均数±标准差”表示,显著性水平为P<0.05。
2 结果与分析
2.1 采食冰鲜鱼和膨化饲料对乌鳢生长性能的影响
乌鳢采食冰鲜鱼和膨化饲料的生长性能差异如表2所示。试验Ⅱ、Ⅲ和Ⅳ组与试验Ⅰ组相比,增质量率和特定生长率均显著下降(P<0.05),同时,饲料效率与摄食率也显著降低(P<0.05),但肥满度在统计学上差异不显著(P>0.05)。试验Ⅱ、Ⅲ和Ⅳ组成活率分别比试验Ⅰ组降低了3.28%(P>0.05)、26.97%(P<0.05)和13.82%(P>0.05)。
2.2 采食冰鲜鱼和膨化饲料对乌鳢血糖的影响
采食冰鲜鱼和膨化饲料对乌鳢血糖影响的差异见图1。结果显示,摄食后随着时间的增长,试验Ⅱ、Ⅲ和Ⅳ组乌鳢血浆中血糖水平均显著高于试验Ⅰ组(P<0.05)。
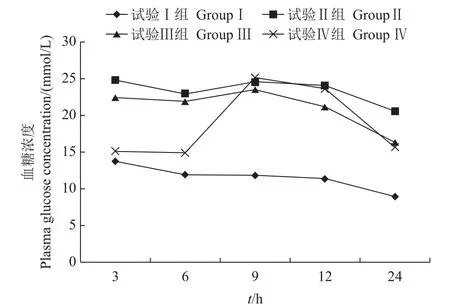
图1 采食冰鲜鱼和膨化饲料对乌鳢血糖浓度的影响Fig.1 Effects on plasma glucose concentration of snakehead feeding with chilled trash fish and puffed feed
2.3 采食冰鲜鱼和膨化饲料对乌鳢肝的影响
2.3.1 对乌鳢肝糖原含量的影响
由图2可知,摄食含糖类的日粮后,试验Ⅱ、Ⅲ和Ⅳ组乌鳢的肝糖原含量与试验Ⅰ组相比均显著上升(P<0.05),且分别在6、9、6 h达到最大值。
2.3.2 对乌鳢肝胰腺指数的影响
由图3可知:试验Ⅱ、Ⅲ和Ⅳ组乌鳢的肝胰腺指数显著高于试验Ⅰ组(P<0.05);除试验Ⅳ组在采食后9 h的肝胰腺指数有较大波动外,其他试验组在不同时间点的肝胰腺指数变化较小。
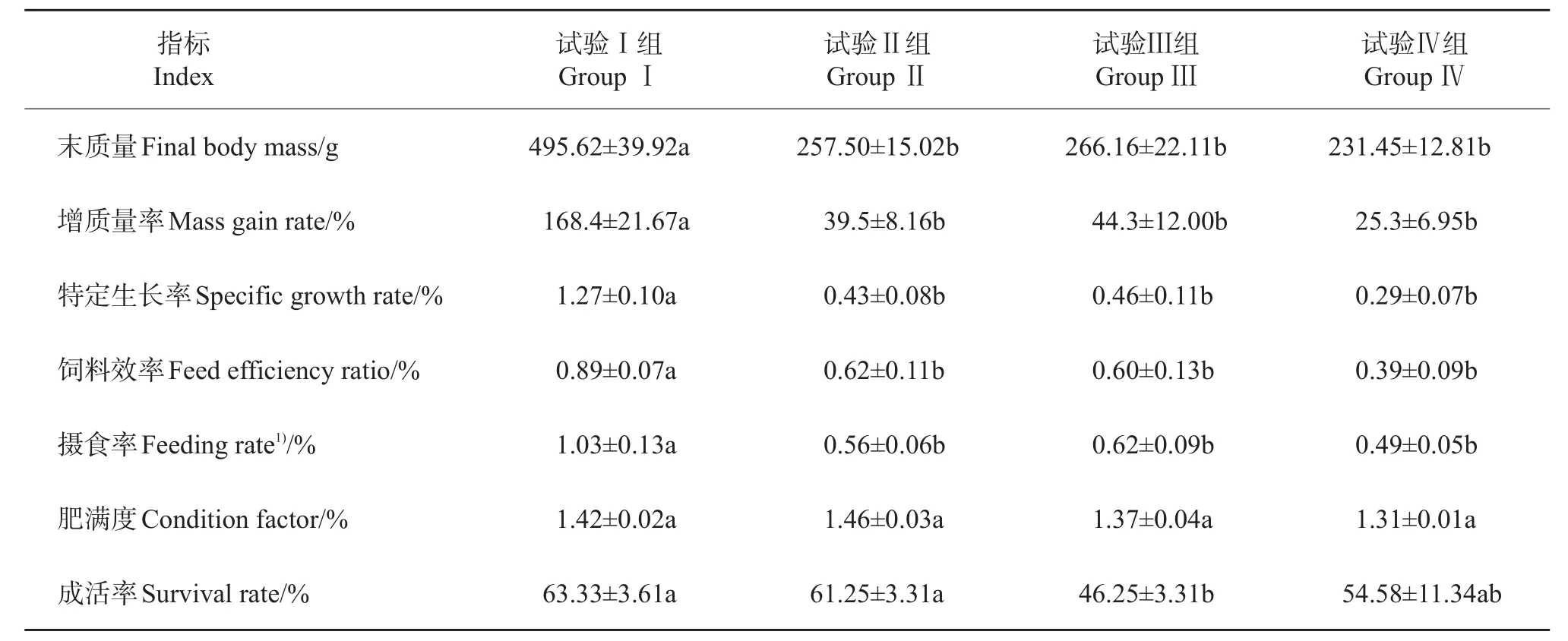
表2 采食冰鲜鱼和膨化饲料对乌鳢生长性能的影响Table2 Effects on growth performance of snakehead feeding with chilled trash fish and puffed feed

图2 采食冰鲜鱼和膨化饲料对乌鳢肝糖原含量的影响Fig.2 Effects on hepatic glycogen content of snakehead feeding with chilled trash fish and puffed feed

图3 采食冰鲜鱼和膨化饲料对乌鳢肝胰腺指数的影响Fig.3 Effects on hepatopancreas index of snakehead feeding with chilled trash fish and puffed feed
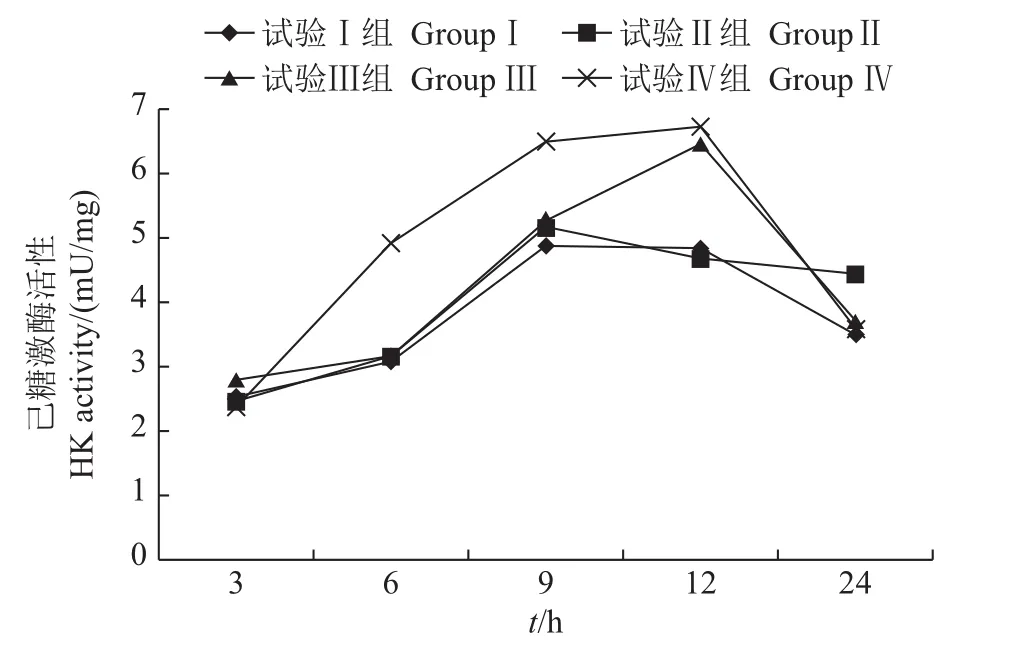
图4 采食冰鲜鱼和膨化饲料对乌鳢肝HK活性的影响Fig.4 Effects on hexokinase(HK)activity in the liver of snakehead feeding with chilled trash fish and puffed feed
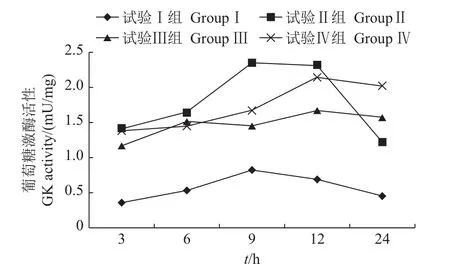
图5 采食冰鲜鱼和膨化饲料对乌鳢肝GK活性的影响Fig.5 Effect on glucokinase(GK)activity in the liver of snakehead feeding with chilled trash fish and puffed feed
2.4 采食冰鲜鱼和膨化饲料对乌鳢糖代谢关键酶活性的影响
2.4.1 对乌鳢肝己糖激酶(HK)活性的影响
从图4中可以看出,各组HK活性均呈先上升后下降的趋势。试验Ⅱ、Ⅲ和Ⅳ组的HK活性与试验Ⅰ组相比均有显著升高(P<0.05)。其中:摄食后6 h和9 h,试验Ⅳ组的HK活性与Ⅰ组相比分别升高了 59.41%(P<0.05)和 33.40%(P<0.05);摄食后12 h,试验Ⅲ和Ⅳ组的HK活性与Ⅰ组相比分别升高了33.68%(P<0.05)和39.05%(P<0.05);摄食后24 h试验Ⅱ组比Ⅰ组升高了27.20%(P<0.05)。
2.4.2 对乌鳢肝葡萄糖激酶(GK)活性的影响
从图5中可以看出,乌鳢摄食后3、6、9、12和24 h,试验Ⅱ、Ⅲ和Ⅳ组肝GK活性与试验Ⅰ组相比均有显著提升(P<0.05)。
2.4.3 对乌鳢肝果糖-1,6-二磷酸酶(FBPase)活性的影响
由图6可知,摄食后各试验组FBPase活性随时间的变化总体呈先上升后下降的趋势,且试验Ⅰ组与试验Ⅱ、Ⅲ、Ⅳ组之间的差异均不显著(P>0.05)。
2.5 采食冰鲜鱼和膨化饲料对乌鳢激素含量的影响
2.5.1 对乌鳢血浆中胰岛素含量的影响
乌鳢采食冰鲜鱼和膨化饲料血浆胰岛素含量的差异见图7。摄食后试验Ⅰ、Ⅱ、Ⅲ和Ⅳ组乌鳢血浆中胰岛素含量变化均呈倒S型(先下降后上升再下降)。乌鳢摄食后3、6和12 h,试验Ⅱ、Ⅲ和Ⅳ组血浆胰岛素含量与试验Ⅰ组相比均有所升高,且试验Ⅱ和Ⅳ组显著升高(P<0.05)。乌鳢摄食后9和24 h,试验Ⅳ组与试验Ⅰ组相比,血浆胰岛素含量显著降低(P<0.05)。
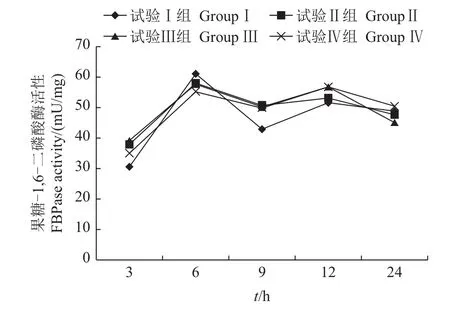
图6 采食冰鲜鱼和膨化饲料对乌鳢肝FBPase活性的影响Fig.6 Effectson fructose1,6-bisphosphatase(FBPase)activity in the liver of snakehead feeding with chilled trash fish and puffed feed

图7 采食冰鲜鱼和膨化饲料对乌鳢血浆中胰岛素含量的影响Fig.7 Effects on plasma insulin content of snakehead feeding with chilled trash fish and puffed feed

图8 采食冰鲜鱼和膨化饲料对乌鳢血浆胰高血糖素含量的影响Fig.8 Effects on plasma glucagon content of snakehead feeding with chilled trash fish and puffed feed
2.5.2 对乌鳢血浆中胰高血糖素含量的影响
由图8可知:乌鳢摄食后,各试验组血浆胰高血糖素含量总体呈持续下降趋势。其中:摄食后3 h,试验Ⅲ组比Ⅰ组升高了21.59%(P<0.05);摄食后6 h,试验Ⅱ组比Ⅰ组升高了27.76%(P<0.05);摄食后9 h,试验Ⅱ、Ⅲ、Ⅳ组血浆胰高血糖素含量较Ⅰ组显著降低(P<0.05)。
3 讨论
3.1 采食冰鲜鱼和膨化饲料对乌鳢生长性能的影响差异
鱼类特别是肉食性鱼类主要以蛋白质和脂肪作为能源物质,对糖类的利用能力较差。然而大量研究发现,饲料中低水平糖类可提高不同品种肉食性鱼类的生长性能[6-13]。在本研究中,与冰鲜鱼组相比,乌鳢的增质量率和特定生长率受试验日粮膨化饲料中糖类水平的影响显著,并随之升高而降低。ENES等[14]采用不同糖类水平及不同类型日粮饲喂欧洲鲈幼鱼,其生长性能显著降低。其原因可能是乌鳢作为肉食性鱼类,其消化道较短,且因天然食物中缺乏糖类,导致其肝及肠道中淀粉酶活性显著低于草食性鱼类;此外,由于乌鳢缺乏对高血糖的适宜调控能力,因而在摄食后易出现持久的高血糖现象,从而导致了其生长性能的降低。在本研究中,试验日粮的饲料效率和摄食率均显著低于冰鲜鱼组,说明对于肉食性鱼类乌鳢,膨化饲料不仅显著降低了其摄食率,同样降低了饲料效率,严重影响其生长性能。各试验组的成活率除试验Ⅲ组之外差异均不显著,这可能是因为乌鳢是凶猛的肉食性鱼类,其好打斗的特性造成了一部分乌鳢的死亡,且在人工饲养的有限空间内,乌鳢打斗的几率可能会更高。
3.2 采食冰鲜鱼和膨化饲料对乌鳢血糖的影响差异
研究认为,鱼类尤其是肉食性鱼类对糖类的耐受能力较差,被认为具有“天生糖尿病的体质”,摄食糖类饲料后其血糖水平通常持续偏高[15-17]。在本试验中,与摄食冰鲜鱼组的相比,乌鳢在摄食不同糖类水平的膨化饲料后呈现持续的高血糖现象,且峰值随糖类含量的升高而上升。这可能是因为未饲喂糖类饲料组的乌鳢血糖主要来源于糖异生,而饲喂糖类饲料组的乌鳢血糖主要来源于两方面:一是由肠道对日粮糖类消化吸收进入血液循环的血糖;二是糖异生途径,从而导致其持续的高血糖现象。
近年来的研究发现,鱼类的胰岛素水平接近甚至高于哺乳类动物,摄入糖类后胰岛素水平及其受体数量能适应性上调[18]。不过鱼类的胰岛素对血糖的刺激反应通常比哺乳动物慢[19],这可能导致胰岛素水平在摄食糖类后的一段时间内相对不足。本研究发现,在摄食后初期,摄食糖类饲料的乌鳢血浆胰岛素含量明显高于冰鲜鱼组,然而其血糖水平却并未有显著降低,其原因可能是饲料中糖类含量的升高引起的高血糖可诱导乌鳢胰岛素含量的升高。这与BLASO[20]对棕鳟的研究结果一致。
本研究还发现,摄食含糖类膨化饲料的乌鳢,在摄食后前期的胰高血糖素水平比冰鲜鱼组高,后期则明显降低。这可能是因为乌鳢为肉食性鱼类,受其自身遗传规律和发育过程的影响,在摄食后其血糖水平的维持主要依靠糖异生途径,而胰高血糖素是促进糖异生途径的主要激素之一,故在摄食后初期其血浆胰高血糖素水平较高,且不受日粮中糖类水平及血糖水平的反馈抑制,并且血浆胰高血糖素仅随摄食后时间的延长而逐渐降低。本研究结果与在海狸上的研究结果[21]一致。然而也有研究发现,虹鳟在摄入葡萄糖后血糖水平增高,胰高血糖素水平下降,而胰岛素水平无明显变化[22]。由此可见,胰岛素与胰高血糖素在不同鱼类中的作用机制并不一致。
3.3 采食冰鲜鱼和膨化饲料对乌鳢肝的影响差异
肝是在鱼类糖代谢中发挥重要作用的器官之一,鱼类摄入高水平糖类日粮后,通常通过增高肝胰腺指数和肝糖原含量来调控摄食高糖类饲料后的持续高血糖[23-24]。在本研究中糖类日粮可显著增高乌鳢的肝胰腺指数和肝糖原含量,且随糖类水平的升高,摄食后的肝胰腺指数、肝糖原含量亦随之升高。这与罗毅平等[25]对南方鲇的研究结果和周华等[26]对鳡幼鱼的研究结果一致。同样,在异育银鲫葡萄糖耐量试验中也发现,口服葡萄糖后不仅显著增加了血糖含量,肝糖原含量亦显著升高[27]。在本研究中,试验Ⅳ组在摄食后6 h的肝糖原质量分数高达97.60 mg/g。虽然摄食后肝糖原含量有所升高,但乌鳢摄食含糖类膨化饲料后的持续高血糖现象并未得到明显改善,这可能是因为乌鳢虽然可通过将血糖转化为肝糖原提高肝糖原储存量,以缓解摄食含糖类日粮后产生的高血糖对机体的危害,但由于其肝体积有限,缓解高血糖的效果并不明显。
3.4 采食冰鲜鱼和膨化饲料对乌鳢肝糖代谢关键酶活性的影响差异
3.4.1 对乌鳢肝糖酵解酶活性的影响差异
GK和HK均为糖酵解途径的关键酶,能高效催化葡萄糖转化为葡萄糖-6-磷酸,完成葡萄糖进入糖酵解途径的第一步关键反应。目前一般公认的是,在鱼类的肝中缺乏GK[28]。因此存在假说,认为GK的缺乏是限制鱼类利用糖类的主要原因之一。而有研究发现,同未添加糖类的试验组相比,在添加30%糖类的大西洋鲑肝中发现了HK和GK,且其活性可诱导性升高,证实了GK在鱼类体内[29]。本研究发现,不同糖类水平的膨化饲料可显著提高乌鳢肝GK活性,但HK活性在高糖类日粮(21.63%糖类)与低糖类日粮(17.48%、19.55%糖类)中,其活性的诱导作用并不明显。这与林小植等[30]在南方鲇幼鱼上的研究结果一致,其原因可能是乌鳢HK的Km值较低,高浓度底物葡萄糖可抑制其活性。
3.4.2 对乌鳢肝糖异生酶活性的影响差异
果糖1,6-二磷酸酶是糖异生的关键酶之一,在哺乳类动物中,血糖水平能显著影响FBPase的表达及活性,饲料的糖类水平较高时,葡萄糖异生作用明显受到抑制。但鱼类情况比较复杂,存在不同的分子机制来调控FBPase的活性表达。在虹鳟、鳕鱼和比目鱼中,其活性表达顺序由高到低依次为:肝>肾>肌肉。研究发现,在虹鳟鱼体内,FBPase基因表达主要位于肝组织,饲喂含糖类饲料与无糖类饲料对虹鳟肝内FBPase基因的表达及活性并无影响,同样,禁食与饲喂对FBPase基因的表达及活性也无影响[31]。另有研究发现,日粮中的蛋白质可显著提高虹鳟、欧洲鲈等肉食性鱼类肝的FBPase活性或基因表达[32-34]。由此可推测,对鱼类糖异生关键酶活性调控显著的营养物质可能为蛋白质而非糖类。
在本研究中,乌鳢仅摄食含糖类膨化饲料日粮后,试验Ⅱ、Ⅲ、Ⅳ组与试验Ⅰ组之间的果糖1,6-二磷酸酶活性差异均不显著(P>0.05),表明乌鳢日粮中糖类的含量水平对肝FBPase活性无显著影响。其原因可能是乌鳢作为肉食性鱼类在长期进化过程中,其血糖水平的稳定主要依靠糖异生途径维持,摄食糖类日粮后产生的高血糖对糖异生酶活性的反馈抑制作用并不明显。但目前关于乌鳢糖异生关键酶活性的调控机制尚不明确,有待进一步研究。
4 结论
乌鳢作为肉食性鱼类对饲料中糖类的利用能力较低,与无糖类日粮相比,不同糖类水平的日粮可显著影响其生长性能。摄食糖类日粮后,乌鳢易产生持续高血糖现象,尽管乌鳢可以通过肝储存大量肝糖原以缓解高血糖对机体的损伤,但由于乌鳢肝体积较小,其缓解作用亦有限。乌鳢摄食不同水平的糖类日粮后均可诱导其肝GK活性显著升高,以促进糖的利用。HK活性较GK活性更稳定,仅受高糖类日粮的影响,低糖类水平对其活性诱导作用有限。而FBPase活性不受糖类及血糖水平的反馈调节。糖类日粮对糖异生关键酶活性的调控作用并不明显。含糖类日粮可显著提高摄食初期乌鳢血浆中的胰岛素水平,降低摄食后期血浆中的胰高血糖素水平,但胰岛素与胰高血糖素在乌鳢糖代谢过程的调控机制尚不明确。
参考文献(References):
[1] 聂国兴,傅艳茹,张浩,等.乌鳢肌肉营养成分分析.淡水渔业,2002,32(2):46-47.
NIE G X,FU Y R,ZAHNG H,et al.Analysis of nutritional ingredient in muscle of Ophiocephalus argus.Freshwater Fisheries,2002,32(2):46-47.(in Chinese)
[2] 唐黎.贵州水域乌鳢含肉率及肌肉营养成分分析.河北渔业,2017(9):18-22.
TANG L.Analysis on dressed rate and muscular nutrient of Channa argus in Guizhou waters.Hebei Fisheries,2017(9):18-22.(in Chinese)
[3] 刘新轶,王宇希,谢楠,等.交鳢及其亲本肌肉营养成分分析.齐鲁渔业,2010(5):24-26.
LIU X Y,WANG Y X,XIE N,et al.Analysis of muscular nutrients in hybrids and their parents of Channa argus.Shandong Fisheries,2010(5):24-26.(in Chinese)
[4] 曹振杰,杨玲,巩俊霞.乌鳢对蛋白质、脂肪、糖类、混合无机盐适宜需求量的初步研究.内陆水产,2003,28(8):39-40.
CAO Z J,YANG L,GONG J X.Preliminary study on the appropriate demands of Ophiocephalus argus on protein,fat,sugar and mixed inorganic salt.Inland Aquatic Product,2003,28(8):39-40.(in Chinese)
[5] 聂国兴,李学军,乔志刚,等.乌鳢营养需要的初步研究.水利渔业,2002,22(1):8-9.
NIEGX,LIX J,QIAOZ G,et al.Studies on thenutritional requirements of Ophiocephalus argus.Reservoir Fisheries,2002,22(1):8-9.(in Chinese)
[6] HEMRE G I,LIEØ,SUNDBY A.Dietary carbohydrate utilization in cod(Gadus morhua):Metabolic responses to feeding and fasting.Fish Physiology and Biochemistry,1993,10(6):455-463.
[7] HEMRE G I,SANDNES K,LIEØ,et al.Carbohydrate nutrition in Atlantic salmon,Salmo salar L.:Growth and feed utilization.Aquaculture Research,1995,26(3):149-154.
[8] SHIMENO S,SHIKATA T.Regulation of carbohydrate metabolism in Fish-.Effectsof acclimation temperatureand feeding rate on carbohydrate-metabolizing enzymeactivity and lipid content of common carp.Nsugaf,1993,59(4):661-666.
[9]JANTRAROTAI W,SITASIT P,JANTRAROTAI P,et al.Protein and energy levels for maximum growth,diet utilization,yield of edible flesh and protein sparing of hybrid Clarias catfish(Clarias macrocephalus×Clarias gariepinus).Journal of the World Aquaculture Society,2010,29(3):281-289.
[10]DENG D F,REFSTIE S,HEMRE G I,et al.A new technique of feeding,repeated sampling of blood and continuous collection of urine in white sturgeon.Fish Physiology and Biochemistry,2000,22(3):191-197.
[11]苗淑彦,苗惠君,聂琴,等.饲料中不同种类的碳水化合物对大菱鲆生长性能和代谢反应的影响.水产学报,2013,37(6):910-919.
MIAO S Y,MIAO H J,NIE Q,et al.Effects of different dietary carbohydrates on growth performance and metabolism response of juvenile turbot(Scophthalmus maximus).Journal of Fisheries of China,2013,37(6):910-919.(in Chinesewith English abstract)
[12]窦兵帅.饲料中碳水化合物及脂肪水平对鲈鱼中、后期生长性能及生理状态的影响.上海:上海海洋大学,2013.
DOU B S.Effect of dietary carbohydrate and lipid levels on growth performance and physiological status of Japanese seabass(Lateolabrax japonicus)in different growth stages.Shanghai:Shanghai Ocean University,2013.(in Chinese with English abstract)
[13]吴凡,文华,蒋明,等.饲料碳水化合物水平对奥尼罗非鱼幼鱼生长、体成分和血清生化指标的影响.华南农业大学学报,2011,32(4):91-95.
WU F,WEN H,JIANG M,et al.Effects of different dietary carbohydrate levels on growth performance,body composition and serum biochemical indices of juvenile hybrid tilapia(Oreochromis niloticus♀×O.aureus♂).Journal of South China Agricultural University,2011,32(4):91-95.(in Chinese with English abstract)
[14]ENESP,PANSERATS,KANSHIK S,et al.Effect of normal and waxy maize starch on growth,food utilization and hepatic glucose metabolism in European sea bass(Dicentrarchus labrax)juveniles.Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2006,143(1):89-96.
[15]HUTCHINSC G,RAWLESSD,GATLIN IIID M.Effects of dietary carbohydrate kind and level on growth,body composition and glycemic response of juvenile sunshine bass(Morone chrysops♀×M.saxatilis♂).Aquaculture,1998,161(1/2/3/4):187-199.
[16]罗毅平.肉食性鱼类南方鲇对饲料碳水化合物营养胁迫的生理生态学反应.重庆:西南大学,2007.
LUO Y P.Ecophysiological responses in a carnivorous fish,the southern catfish (Silurus meridionalis Chen) to nutritional stress of dietary carbohydrate.Chongqing:Southwest University,2007.(in Chinese with English abstract)
[17]窦兵帅,梁萌青,郑珂珂,等.饲料中碳水化合物水平对鲈鱼生长、生理状态参数及体组成的影响.渔业科学进展,2014,35(1):46-54.
DOU B S,LIANG M Q,ZHENG K K,et al.Effects of dietary carbohydrate level on growth,physiology and body composition of Japanese seabass Lateolabrax japonicus.Progress in Fishery Sciences,2014,35(1):46-54.(in Chinese with English abstract)
[18]KIRCHNER S,KAUSHIK S,PANSERAT S.Effect of partial substitution of dietary protein by a single gluconeogenic dispensable amino acid on hepatic glucose metabolism in rainbow trout(Oncorhynchus mykiss).Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2003,134(2):337-347.
[19]PERES H,GONCALVES P,OLIVA-TELES A.Glucose tolerance in gilthead seabream (Sparus aurata)and European seabass(Dicentrarchus labrax).Aquaculture,1999,179(1/2/3/4):415-423.
[20]BLASO JJ.Realidad virtual:EICRV de Barcelona,el más moderno exponente de las Tecnologías de Realidad Virtual del sur de Europa.IMHE:Información de Máquinasherramienta,Equiposy Accesorios,2001,268:188-190.
[21]DE CELIS V R,ROJAS P,GÓMEZ-REQUENI P,et al.Nutritional assessment of somatolactin function in gilthead sea bream(Sparus aurata):Concurrent changes in somatotropic axis and pancreatic hormones.Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2004,138(4):533-542.
[22]DEL SOL NOVOA M,CAPILLA E,ROJAS P,et al.Glucagon and insulin response to dietary carbohydrate in rainbow trout (Oncorhynchus mykiss). General and Comparative Endocrinology,2004,139(1):48-54.
[23]CAPILLA E,MÉDALE F,NAVARRO I,et al.Muscle insulin binding and plasma levels in relation to liver glucokinase activity,glucose metabolism and dietary carbohydrates in rainbow trout.Regulatory Peptides,2003,110(2):123-132.
[24]周传朋.不同水平碳水化合物日粮对团头鲂的生长、免疫及相关糖代谢酶的影响.南京:南京农业大学,2012.
ZHOU C P.Effect of different dietary carbohydrate levels on growth performance,immunity and carbohydrate metabolic enzymes in Wuchang bream (Megalobrama amblycephala).Nanjing:Nanjing Agricultural University,2012.(in Chinesewith English abstract)
[25]罗毅平,谢小军.南方鲇对饲料碳水化合物的代谢适应.水生生物学报,2009,33(1):140-145.
LUO Y P,XIE X J.Metabolic adaptation of carnivorous southern catfish to dietary carbohydrate.Acta Hydrobiologica Sinica,2009,33(1):140-145.(in Chinese)
[26]周华,樊启学,宗克金,等.饲料碳水化合物水平对鳡幼鱼生长和体成分的影响.水生态学杂志,2011,32(3):108-113.
ZHOU H,FAN Q X,ZONG K J,et al.Effects of dietary carbohydrate levels on the growth performance and body compositions of juvenile Elopichthys bambusa.Journal of Hydroecology,2011,32(3):108-113.(in Chinese with English abstract)
[27]蔡春芳,陈立侨,宋学宏,等.异育银鲫口服葡萄糖后血糖、血脂和肝糖原的变化.水产学报,2002,26(3):237-241.
CAI C F,CHEN L Q,SONG X H,et al.The change of plasma glucose,plasma triglyceride and hepatic glycogen after oral glucose administration in allogynogenetic silver crucian carp.Journal of Fisheries of China,2002,26(3):237-241.(in Chinesewith English abstract)
[28]戈贤平,俞菊华,吴婷婷.翘嘴红鲴GK基因的克隆和序列分析.水产学报,2006,30(3):410-415.
GE X P,YU JH,WU T T.Molecular cloning and sequence analysis of the cDNA of glucokinase in Erythroculter ilishaeformis.Journal of Fisheries of China,2006,30(3):410-415.(in Chinesewith English abstract)
[29]BORREBAEK B,WAAGBØR,CHRISTOPHERSEN B,et al.Adaptable hexokinase with low affinity for glucose in the liver of atlantic salmon(Salmo salar).Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1993,106(4):833-836.
[30]林小植,罗毅平,谢小军.饲料碳水化合物水平对南方鲇幼鱼餐后糖酵解酶活性及血糖浓度的影响.水生生物学报,2006,30(3):304-310.
LIN X Z,LUO Y P,XIE X J.Effects of dietary carbohydrate level on glycolytic enzymes and serum glucose concentrations in the juvenile southern catfish after feeding.Acta Hydrobiologica Sinica,2006,30(3):304-310.(in Chinesewith English abstract)
[31]PANSERAT S,PLAGNES-JUAN E,KAUSHIK S.Nutritional regulation and tissue specificity of gene expression for proteins involved in hepatic glucose metabolism in rainbow trout(Oncorhynchusmykiss).Journal of Experimental Biology,2001,204(13):2351-2360.
[32]COWEY C B,KNOX D,WALTON M J,et al.The regulation of gluconeogenesis by diet and insulin in rainbow trout(Salmo gairdneri).British Journal of Nutrition,1977,38(3):463-470.
[33]WALTON M J.Metabolic effects of feeding a high protein/low carbohydrate diet as compared to a low protein/high carbohydrate diet to rainbow trout Salmo gairdneri.Fish Physiology and Biochemistry,1986,1(1):7-15.
[34]王猛强,黄文文,周飘苹,等.不同蛋白质和小麦淀粉水平对大黄鱼生长性能、糖酵解和糖异生关键酶活性的影响.水产学报,2015,39(11):1690-1701.
WANG M Q,HUANG W W,ZHOU P P,et al.Effects of dietary protein and wheat starch levels on growth performance,hepatic glycolysis and gluconeogenic key enzymes activities in large yellow croaker(Larimichthys crocea Richardson).Journal of Fisheries of China,2015,39(11):1690-1701.(in Chinese with English abstract)
