数字化乳腺X线立体导丝定位对BI-RADS-4级以上NPBL患者的诊断价值
2018-05-11夏德新郭永团李德春邵国庆
夏德新 郭永团 李德春 邵国庆
据2016年统计,全世界每年约有120万妇女患乳腺癌,有40万例死于该病,且以每年3%的速度递增[1]。我国乳腺癌发病率约占全身恶性肿瘤的10%,在某些大城市已跃居女性恶性肿瘤的首位,且发病年龄趋于年轻化。如何对不可触及乳腺病变(nonpalpable breast lesion,NPBL)进行准确定位,保证病变的精确切除,是目前早期乳腺癌诊断工作的重点。数字化乳腺X线立体导丝定位引导外科活检具有定位准确、损伤性小、诊断准确性高等优点[2],是早期发现乳腺癌的有效方法。本研究收集应用数字化乳腺X线立体导丝定位引导外科活检的30例BI-RADS-4级以上NPBL患者的临床资料,以探讨该技术的诊断价值。
1 对象和方法
1.1 对象 选择2014年12月至2017年4月本院收治的30例女性BI-RADS-4级以上NPBL患者为研究对象。因乳房不适、乳头溢液、乳房胀痛或健康体检来医院就诊,临床未触及肿块,仅常规乳腺X线检查发现异常,因性质待定而收治入院;所有患者常规乳腺X线片、数字化乳腺X线片、导丝定位X线摄片和术后病理结果等临床资料完整。年龄 30~70 岁[45(37,51)]岁,其中<35岁 4例(13.33%),35~45岁 14例(46.67%),>45岁12例(40.00%);体检常规乳腺X线发现异常18例,乳房疼痛不适或乳头溢液就诊且常规乳腺X线发现异常12例;病灶部位在乳房外上象限18例,外下象限4例,内上象限6例,内下象限2例。
1.2 方法 由经验丰富的放射科医生进行操作。医生熟知乳腺癌高危因素、乳房的体格检查、乳腺X线检查结果;熟练使用三维立体定位穿刺活检系统(Seno vision,HOLOGIC公司);熟知X线BI-RADS乳腺疾病的分级,并能准确分级,在良恶性判断方面经验丰富。术前告知患者操作过程、目的、意义及可能发生的并发症,并取得患者知情同意;术后拍摄大体标本X线片、患者乳腺X线常规位片。数字化乳腺X线立体导丝定位引导外科活检术:(1)常规X线摄患侧乳腺头尾位片、侧位乳腺片,观察病变,确定病灶位置及穿刺深度,必要时摄侧位片及腋下位片。患者取坐位,尽量将病灶置于矩形框中央,可于0°曝光1次确认,X线管按顺、逆时针各转15°,分别曝光 1 次,计算出三维坐标值(x、y、z)[3],将定位针架移至计算的目标靶点位置。(2)消毒,手动安装穿刺针,按系统设定的深度进针,再按上述方法重复X线摄双15°的定位片。定位满意后,打开导丝前端Y形钩且将导丝留置在病灶内,即送手术室。(3)皮肤重新消毒铺巾,沿导丝向乳头作放射型切口,若病灶位于乳晕附近也可作乳晕旁弧形切口。术中始终沿着金属定位线作切除,当切除到置入导丝末端时要稍微扩大范围;将切除的标本摄片,明确病灶及钢丝是否完整切除后,再送病理科诊断,见图1。

图1 导丝穿刺定位钙化灶(a:常规乳腺X线示簇状钙化伴致密影;b:立体定位前压迫X线摄片;c、d:不同角度确定钢丝位于钙化灶中心;e:切除后可见导丝位于钙化灶中心,病灶完全切除;箭头所示为钙化灶)
1.3 观察指标 观察数字化乳腺X线表现、BI-RADS分类、立体定位结果及病理诊断结果。立体定位满意:针尖与病变的距离≤2cm[4]。
2 结果
2.1 数字化乳腺X线表现 数字化乳腺X线检查示微小簇状钙化灶12例;局部结构扭曲、紊乱4例;局限性不规则密度增高影5例;致密结节影伴有钙化灶6例;乳腺非对称性致密影3例。
2.2 BI-RADS分类 由2位高年资医师依据美国放射学会(ACR)第5版BI-RADS分类标准对数字化乳腺X线诊断归属进行分类,其中4类26例(4A类9例,4B类11例,4C类6例),5类4例,见表1。
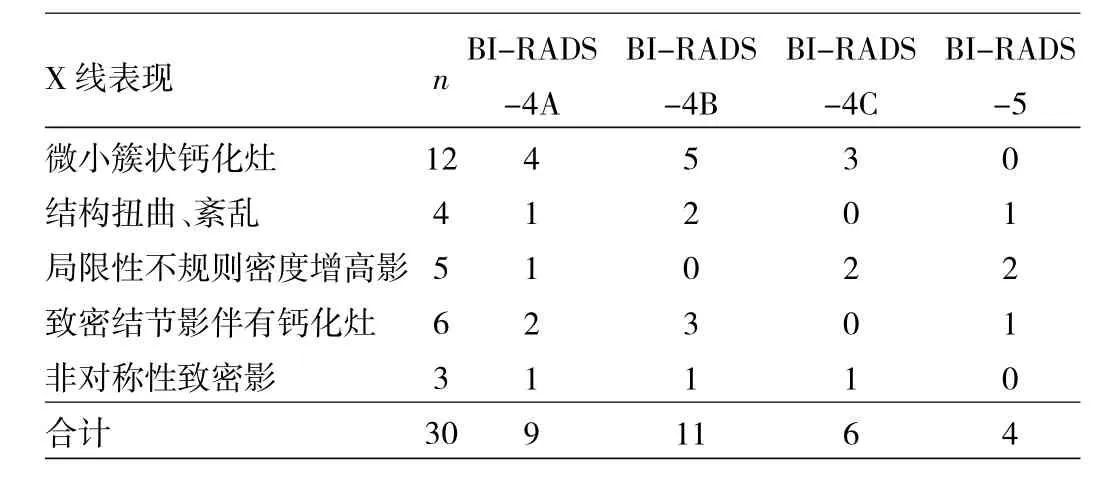
表1 数字化乳腺X线表现与BI-RADS分类的关系(例)
2.3 立体定位结果 所有患者一次性导丝置入定位成功,成功率为100.00%,手术切除准确。术中见细金属丝准确置入病灶,30例患者一次性次置入满意,定位满意率为100.00%。
2.4 病理诊断结果 30例NPBL患者病灶均一次性准确切除;标本再行X线摄片,可见病灶切除完整。病理诊断为浸润性导管癌6例,导管内癌5例,乳腺单纯癌2例,乳腺纤维瘤7例,乳腺增生症5例,乳腺腺病4例,积乳囊肿1例。恶性病变13例(43.44%);良性病变17例(56.67%;其中4例行乳腺改良根治术,9例行保乳手术)。BI-RADS-4A恶性1例,BI-RADS-4B恶性4例,BI-RADS-4C恶性4例,BI-RADS-5恶性4例,见表2。
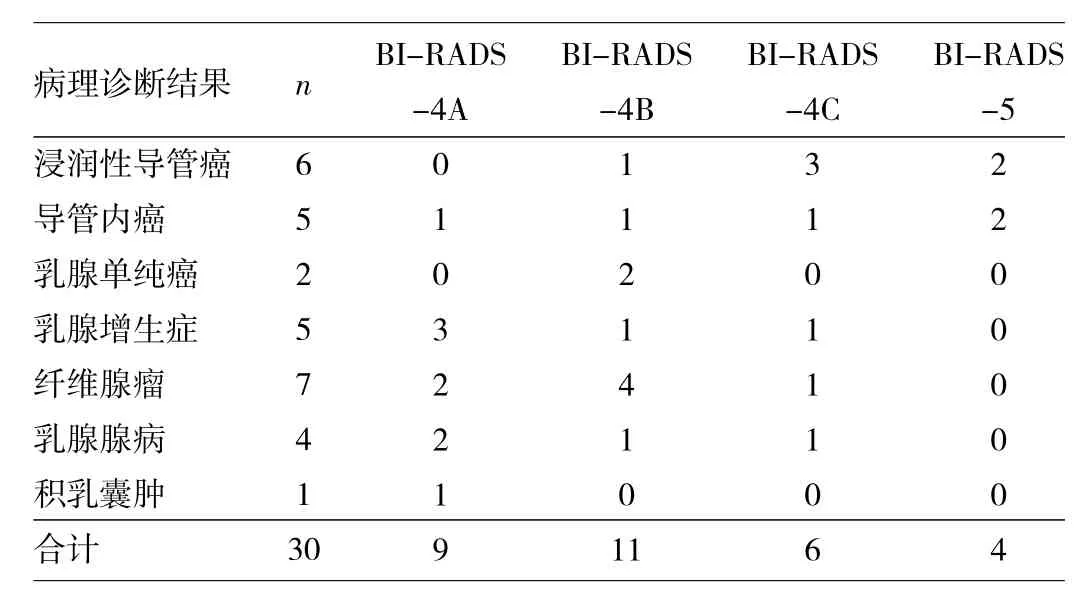
表2 病理诊断结果与BI-RADS分类的关系(例)
2.5 随访结果 术后对13例乳腺癌(浸润性导管癌6例、导管内癌5例、乳腺单纯癌2例)患者随访12~30个月,定期复查乳腺X线、胸部X线、乳腺超声、腹部超声等。13例患者全部生存,其中1例患者在术后6个月出现局部簇状钙化灶,切除后病理诊断为导管原位癌。
3 讨论
近年来,中国女性乳腺癌发病率迅速上升,且呈年轻化趋势。乳腺X线普查结果显示,2%~4%的正常人群中有临床不可触及的乳腺微小病灶,其中20%~30%为恶性肿瘤[5]。很多乳腺癌患者早期并无症状,不能扪及肿块。随着乳腺X线普查的开展以及影像检查技术的提高,临床上NPBL检出率不断增高。但是乳房无解剖定位特征,腺体组织个体差异非常大,且乳房在受压下、平卧位、站立位的差异很大,因此对可疑恶性病变,外科仅靠常规乳腺X线片定位病灶往往不够准确[6]。90年代在电子计算机技术发展的背景下,出现了X线立体穿刺钢丝定位技术,这从技术上解决了NPBL在术中精确定位的问题[7]。本组30例患者均一次性导丝置入定位成功,定位满意率为100.00%。该技术由电子计算机确认完成,定位误差不超过0.5mm。与常规定位方法比较,数字化乳腺X线立体导丝定位准确、操作简单、技术先进、成功率高[8]。
目前临床上NPBL的检查方法主要有超声、钼靶摄片,同时进行BI-RADS分类,对可疑乳腺病灶进行初步定性,以避免盲目手术、过度手术。BI-RADS分类是1992年由ACR提出并推荐采用的“乳腺影像报告和数据系统”,其后经3次修订用于指导乳腺X线诊断(第4版),目前在用的是第5版(2013版)[9]。本组30例患者恶性13例,其中BI-RADS-4A恶性1例(11.11%),BI-RADS-4B恶性 4例 (36.37%),BI-RADS-4C恶性 4例(66.67%),BI-RADS-5恶性 4例(100.00%)。可见,随着BI-RADS分类的提高,乳腺恶性程度随之增加,3级(良性可能)的病灶一般建议短期随访,若这类病变患者出现严重恐癌症时,也可选择穿刺活检,原则上严格按照BI-RADS分类选择复查或切除活检。
早期乳腺癌,尤其是临床触诊阴性的乳腺恶性钙化病灶,早期临床很难发现。本组12例数字化乳腺X线检查示微小簇状钙化灶的患者中,有5例最终证实为乳腺癌,均为早期发现;另有3例癌前病变被发现。穿刺定位留置导丝活检术是目前诊断早期乳腺癌的有效、可靠的方法。随着导丝引导手术切除技术的发展,可最大程度地发现早期乳腺癌及癌前病变,避免过度活检带来的损害。导丝是金属物,有一定硬度且尖端有双倒钩,因此不易移位[10]。本组30例患者均一次置入成功,导丝无脱落或位移,定位满意率高达100.00%。术中沿着导丝切除,可以保证病变的准确切除,解决以往外科手术盲目切除、漏切或误切的问题。立体定位术的注意事项归纳如下:(1)合理选择穿刺体位、进针的倾斜角度及深度,进针路径应选择最短距离;如可疑病变位于乳腺外上、内上象限,则采用头尾位从上向下进针[11]。(2)向患者介绍定位操作过程,尽量摆患者舒适的体位;操作者主动与患者谈心,分散其注意力,同时熟练操作以缩短定位时间,避免患者出现迷走神经反应。(3)进针方向与胸壁平行,以免穿刺针插入胸腔引起气胸。(4)计算穿刺安全距离,尤其是乳房较小或病变太靠近胸壁的患者,应准确计算穿刺深度及压迫后乳房厚度,以免穿刺针穿出乳腺组织。(5)取出标本后,导丝及标本要再摄片并与原片对照,了解是否完全切除可疑病灶,为病理报告提示病灶的准确位置。(6)穿刺定位成功后,应尽可能立即手术,以避免因导丝移位而使手术失败。术后给予抗生素预防感染。
综上所述,数字化乳腺X线立体导丝定位活检解决了乳腺外科医生对乳腺微小病变术中精确定位的困难,为微小病灶的早期定性诊断提供了可靠途径。它具有技术安全、定位准确、损伤性小、诊断符合率高等优点,同时满足患者对乳房外形美容的要求[12],值得推广应用。此外,BI-RADS分类又保证了切除的阳性率,减少过度手术。
[1]Kwan IK,Kyung HL,Tae RK,et al.Changing patterns of microcalcification on screening mammography for prediction of breast cancer[J].Breast Cancer,2016,23(3):471-478.
[2]Pagni P,Spunticchia F,Barberi S,et al.Use of core needle biopsy rather than fine-needle aspiration cytology in the diagnostic approach of breast cancer[J].Case Rep Oncol,2014,7(2):452-458.
[3]梁建堂,王凤,潘忠清.乳腺微小病灶病理活检360o定位穿刺技术的设计与临床应用[J].实用放射学杂志,2010,26(5):719-723.
[4]Tinnemans JGM,Wobbes T,Hendriks JH.Localization and excision of nonpalpable breast lesions[J].Arch Surg,1987,122(7):802-806.
[5]Kharkwal S,Sameer,Mukherjee A.Triple test in carcinoma breast[J].J Clin Diagn Res,2014,8(10):9-11.
[6]ChanBK,Wiseberg-FirtellJA,JoisRH,etal.Localizationtechniques for guided surgical excision of nonpalpable breast lesions[J].Cochrane Database Syst Rev,2015,31(12):1-49.
[7]Gallagher WJ,Cardenosa G,Rubens JR,et al.Minimal-volume excision of nonpalpable breast lesions[J].Am J Roentgenol,1989,153(5):957-961.
[8]赵慧娟,尹成方,赵爱丽.X线引导下乳腺二维与三维导丝定位活检技术的比较[J].中国介入影像与治疗学,2011,8(4):307-309.
[9]American College of Radiology.Breast imaging reporting and data system(BI-RADS)Atlas(2013 Edition)[M].Beijing:Medical Publishing House of Peking University,2016:1-29.
[10]Krekel NM,Haloua MH,Lopes Cardazo MF,et al.Intra-operative ultrasound guidance for palpable breast cancer excision(COBALTtrial):A multicenter,randomized controlled trial[J].Lancet Oncol,2013,14(1):48-54.
[11]Takács T,Paszt A,Simonka Z,et al.Radioguided occult lesion localisation versus wire-guided lumpectomy in the treatment of non-palpable breast lesions[J].Pathol Oncol Res,2013,19(2):267-273.
[12]Lovrics PJ,Cornacchi SD,Vora R,et al.Systematic review of radioguided surgery for non-palpable breast cancer[J].EJSO,2011,37(5):388-397.
