肠上皮细胞紧密连接蛋白的结构功能及其调节
2018-05-11王希廖吕钊江荣林
王希 廖吕钊 江荣林
人或动物肠上皮细胞组成了十分重要的机械屏障,对维护完整的肠黏膜屏障功能具有重要意义。相邻的上皮细胞间通过多种蛋白及分子构成的连接复合体,从顶端到基膜依次为紧密连接(TJ)、黏附连接、桥粒连接和缝隙连接等,共同起着加强细胞间连接功能、组成传递信息通道的作用,其中以TJ最为重要。肠上皮细胞TJ与多种肠道疾病的发生、发展以及全身缺血缺氧后出现肠损伤、肠黏膜屏障功能受损等有着密切关系。近年来,关于TJ的功能结构及其影响因素的研究日益增多,本文就肠上皮细胞TJ的蛋白组成、结构功能、调节途径及其影响因素作一系统阐述。
1 肠上皮细胞TJ功能及结构组成
肠上皮细胞的TJ存在于靠近肠腔侧的上皮细胞侧面,是一个动态变化的、由多种蛋白及分子组成、具有多种功能的复合体,属于不通透连接。其功能主要有:(1)连接上皮细胞,封闭细胞间的空隙;(2)维持细胞极性,限制细胞不同液体间的脂质和完整膜蛋白的自由扩散;(3)维持通透性屏障,只能允许离子和可溶性小分子物质通过,限制大分子及微生物通过,并可调节离子和大分子物质跨细胞旁路的被动转运。构成TJ的蛋白及分子主要包括3种跨膜蛋白,即咬合蛋白(Occludin)、闭合蛋白(Claudins)、连接黏附分子(JAM)及闭合小环蛋白(ZOs,一种胞浆蛋白),见图 1。
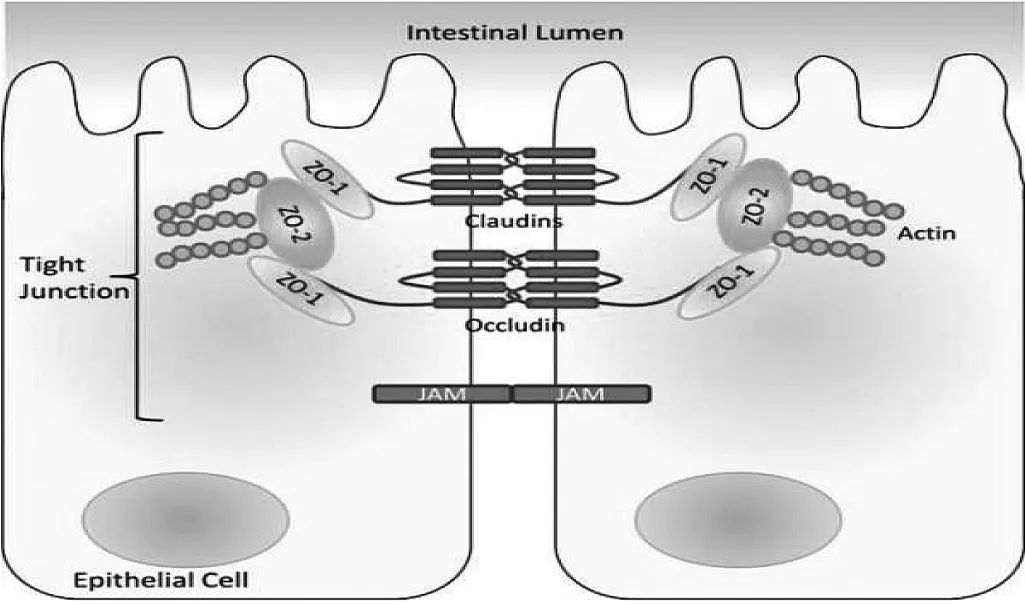
图1 肠黏膜上皮细胞TJ模式图
1.1 Occludin Occludin有2个亚型,结构特点为经过4次跨膜,形成2个细胞外环。相邻细胞间Occludin胞外环相互结合,其胞内域的氨基酸残基富含大量电荷,与ZOs直接结合,再通过胞浆蛋白与骨架蛋白相互作用[1]。Occludin蛋白通过磷酸化来调节TJ复合体的定位及功能,从而影响TJ的渗透性,同时有调节细胞黏附及维持细胞极性等功能。
1.2 Claudins 目前已发现Claudins有26种异构体,聚合于细胞质膜上构成TJ复合物的主链,其每一分子均由4个右螺旋折叠结构的跨膜结构域和2个胞外环状结构组成,这2个环状结构的第一环大于第二环,有较强的疏水性,且氨基及羧基末端都存在于细胞内,通过PDZ结合域与ZOs分子相连[2]。这2个细胞外环结构是组成TJ的重要结构基础,且影响着TJ条带形成及离子选择通透性。
1.3 JAM JAM有4个异构体,而表达于肠上皮细胞的是JAM-1、JAM-4。与其他TJ跨膜蛋白不同,JAM 家族分子是单次跨膜蛋白,N-端位于细胞膜外并具有2个免疫球蛋白样环状结构,即二聚体结构。在肠上皮细胞表面,一个JAM二聚体与相邻细胞表达的另一个JAM二聚体相互作用,形成一个四聚体,构成JAM间相连的结构[3],并通过其PDZ结构域与ZOs形成非Ca2+依赖性连接。
1.4 ZOs ZOs蛋白有3种异构体,属于膜相关鸟苷酸激酶家族。ZOs位于细胞质内膜表面,一端与细胞质内Occludin蛋白末端连接,另一端与TJ和细胞骨架肌动蛋白相连。ZOs对TJ的组成及细胞屏障通透性的维持有着密切的关系[4]。
2 肠上皮细胞TJ的调节途径
肠上皮细胞TJ作为信号中心,一方面调节细胞外环境与细胞内之间的信息传递;另一方面,其本身亦受到细胞内多种信号通路的调节,如丝裂原活化蛋白激酶(MAPK)、蛋白激酶 C(PKC)、肌球蛋白轻链激酶(MLCK)、Rho/Rho激酶、信号转导及转录活化因子 3(STAT3)、Gα12、芳香烃受体(AhR)等,共同调节TJ蛋白的表达,控制TJ蛋白的组装、分解、磷酸化,影响TJ的结构与功能。
MAPK信号通路主要包括丝裂原活化蛋白(p38)、细胞外调节蛋白激酶(ERK)、c-Jun氨基末端激酶(JNK)等2条通路,共同参与TJ蛋白及肠上皮屏障功能的调控[5-6]。蛋白质的磷酸化在TJ的组装过程中起着重要作用,是维持和调节细胞旁通透性的关键,而磷酸化失调可导致TJ功能严重受损。PKC能使Occludin、Claudins磷酸化,是TJ重要的调节途径[7]。促炎细胞因子,如血小板活化因子、IFN、IL-1等,通过激活NF-κB诱导MLCK介导的肌球蛋白轻链(MLC)磷酸化,细胞质和细胞膜上的ZOs与Occludin蛋白分离,相邻细胞的间隙增大,从而破坏TJ,增加肠道通透性[8]。有研究发现,抑制Rho活性可导致ZOs和Occludin蛋白在TJ处定位降低;相反,Rho激活后能使ZOs和Occludin蛋白在TJ处沉积,从而维持TJ的功能[1]。Gα12属于三聚体G蛋白家族,通过SH3结构域结合到ZO-1,Gα12活化能增强TJ蛋白的磷酸化,使TJ蛋白被破坏、Z0-1和Na+-K+-ATP酶的正常分布发生改变,细胞极性消失[9]。STAT3是介导细胞因子信号通路的重要转录因子,可与多种细胞因子相结合并通过酪氨酸激酶(JAK)/STAT3途径发挥诱导细胞信号转导作用,通过调控基因表达来影响Claudin-1和Occludin 的水平[10]。吲哚并(3,2-B)咔唑-6-甲醛活化 AhR后,通过诱导一系列代谢酶的基因表达,从而影响TJ蛋白ZOs表达及其在上皮细胞间的分布[11]。
3 TJ结构与功能的影响因素
3.1 肠道疾病相关影响 多种肠道疾病的发生,伴随着肠上皮细胞TJ的损伤、肠屏障结构及功能的破坏,出现病理性改变。
3.1.1 炎症性肠病 炎症性肠病包括溃疡性结肠炎、克罗恩病。在发病时,肠黏膜所产生的大量炎症细胞因子、炎症介质等会损伤肠上皮细胞,从而诱导上皮细胞凋亡,并通过多个通路影响肠上皮细胞TJ蛋白的表达及分布,破坏TJ结构,造成肠黏膜屏障功能受损[12-13]。此外,肠上皮细胞TJ结构、蛋白表达和功能异常还被证实参与了乳糜泻和肠道易激综合征的发生、发展[14]。在认识到TJ屏障功能受损可引起一系列肠道疾病的基础上,已有学者开始探索如何增强肠上皮细胞TJ的屏障功能,以减轻和缓解炎症性肠病的临床表现。
3.1.2 肠道肿瘤 肠上皮细胞TJ蛋白表达异常,与肿瘤的发生、浸润和转移有着密切关系。TJ的完整性遭到破坏,通透性随之增加,营养因子通过TJ扩散,促进了肿瘤细胞的存活及扩散。TJ的改变对肿瘤的诊断、治疗及预后判断都有着重要的意义,如在大肠癌患者癌组织中肠上皮细胞TJ蛋白中的Claudin-1明显高于正常组织,其表达状态与肿瘤的分化、转移、分期有着密切联系[15];同样,Claudin-3可促进结肠癌的恶性转化,其机制可能是由表皮生长因子激活ERK1/2等途径而调控Claudin-3的表达[16]。
3.1.3 肠道感染 细菌引起的肠道感染同样会影响肠上皮细胞TJ结构及功能。肠道发生致病性大肠杆菌感染时,会改变TJ蛋白Occludin、ZOs及Claudins的分布,破坏肠上皮细胞TJ超微结构,使得TJ的通透性增加[17]。霍乱弧菌能产生一种具有蛋白酶作用的毒素来消化Occludin,从而破坏TJ的完整性。白色念珠菌可通过激活NF-κB、MAPK信号通路来破坏肠上皮细胞TJ蛋白的表达及功能,增加其通透性,影响肠黏膜屏障功能[18]。人类肠道病毒71型是引起手足口病的主要病原体,感染后可使肠上皮细胞TJ蛋白ZOs表达减少,改变TJ的排列,增加TJ通透性,促进病毒及有害毒素的移位[19]。HIV病毒感染时可诱发肠上皮细胞内的NF-κB激活,减少ZO-1表达,进而影响其他TJ蛋白的表达及合成,使得TJ结构完整性遭到破坏,肠黏膜屏障通透性增加[20]。
3.2 缺血再灌注损伤 目前研究已经证实,在多种病理条件下,如脓毒症、感染性休克、严重创伤、腹部手术等引起肠黏膜缺血再灌注损伤,均会导致肠黏膜屏障结构和功能受损。研究发现肠黏膜缺氧会引起肠黏膜炎症,释放大量的炎症因子如 TNF-α、INF-γ、IL-1、IL-6和氧自由基等,这些炎症因子进一步加重缺氧,造成肠黏膜屏障功能受损[21]。研究发现TNF-α单独作用即可引起肠黏膜屏障功能损害,其机制可能是通过诱导肠上皮细胞的MLCK蛋白表达,从而引起MLC磷酸化增加及TJ蛋白ZO-1、Occludin、Claudin-1重新分布,最终导致肠黏膜屏障功能损害[22]。
3.3 肠道菌群 健康的人肠道内各种细菌共生,形成了一个动态的微生物区系,当大量外源致病菌入侵肠道或肠道内正常的微生物菌群被破坏时会引起肠道菌群失调,进而通过多种方式破坏TJ,诱导肠上皮细胞凋亡、增加肠上皮细胞间的通透性,进一步促进病原菌、毒素等易位,引发内源性感染。王宏刚等[23]在多黏菌素E诱导肠道菌群失调的研究中发现,各菌群的数量和比例发生明显变化,双歧杆菌、乳杆菌等有益菌受到抑制,肠杆菌、肠球菌等条件致病菌大量繁殖,从而黏附和定植于肠黏膜,破坏并突破肠上皮细胞TJ,导致细菌易位。此外,有研究证明益生菌等对病原菌感染、炎症性肠病等多种原因引起的TJ破坏及肠黏膜损伤均具有保护与修复作用,其通过直接促进肠上皮细胞TJ蛋白表达或间接通过抑制多种细胞因子如IL-6、IFN-γ、NO等信号传导通路来调节TJ蛋白表达,进而降低肠黏膜的通透性,阻止病原菌对肠黏膜屏障功能的损伤[24-27]。
3.4 激素影响 目前研究证明,多种激素参与肠上皮细胞的TJ及肠黏膜屏障功能的调节及修复过程。如生长激素(GH)、生长抑素(SST)、肾上腺髓质激素(AM)、糖皮质激素(GCS)、雌激素(EH)等。GH具有明显促进蛋白质合成的作用,GH受体在肠道吸收细胞、隐窝基底柱状细胞和肠道内分泌细胞等均有大量分布。研究表明GH可激活MAPK/ERK、MAPK/JNK等通路,调节TJ蛋白磷酸化,进而影响TJ结构及功能[28]。肠上皮细胞是SST重要的靶细胞,表达多种生长抑素受体(SSTR),SST通过与肠上皮的SSTR结合而发挥生物作用,通过抑制MAPK/ERK通路的激活而明显改善脂多糖引起的肠上皮细胞TJ蛋白表达及分布异常,并增加Occludin、ZOs的表达,改善肠上皮细胞屏障功能[29]。有研究表明,AM可通过下调肌球蛋白轻链的磷酸化而调节TJ蛋白表达,从而稳定肠黏膜屏障功能[30]。田铸等[31]发现在缺氧/复氧条件下,AM可上调TJ蛋白的表达,减轻肠上皮屏障功能的破坏,其机制可能与抑制NF-κB有关。GCS可通过激活GCS受体而抑制肠道炎症,保护TJ结构与功能的完整[32]。EH通过雌激素受体β(ERβ)上调Occludin和JAM-1的表达,从而降低细胞旁的通透性[33]。
3.5 中医措施 在我国传统医学中,中药、针灸对肠上皮细胞TJ功能结构的完整以及相关疾病的治疗同样发挥着独特的作用。有研究发现,健脾清热活血方药可能通过增加Claudins的表达来促进肠黏膜修复,以达到缓解溃疡性结肠炎的效果[34]。翟金海等[35]发现,运用清肠化湿方药可抑制大鼠结肠组织中TNF-α水平,从而降低对Claudins的破坏,起到治疗大鼠结肠炎的作用。Shang等[36]发现在治疗克罗恩病患者的过程中,针刺天枢、气海、足三里、上巨虚等穴位时,可增加TJ中Claudin-1、ZO-1表达,促进TJ结构及功能的修复。
4 总结与展望
肠上皮细胞TJ是构成肠黏膜屏障中机械屏障的重要组成部分之一,对维持肠屏障结构与功能的完整性具有重要意义。随着对肠上皮细胞TJ的深入研究,尤其是对TJ结构、功能机制以及其影响因素的探索,为感染、肿瘤、炎症性肠病、缺血再灌注损伤等相关疾病的防治提供了新思路。在传统医学中,中药、针刺相关穴位等对于维持肠上皮细胞TJ功能结构的完整性同样有着促进作用,从而防治肠上皮细胞间TJ结构功能异常相关疾病。今后在消化系统及危重病的临床诊治中,将有越来越多的措施关注与改善肠黏膜上皮细胞TJ,从而保护肠黏膜屏障功能并改善疾病预后。
[2]Suzuki H,Tani K,Fujiyoshi Y.Crystal structures of claudins:insights into their intermolecular interactions[J].Annals of the New York Academy of Sciences,2017,1397(1):25-34.
[3]Zhao H,Hefen YU,Martin TA,et al.The role of JAM-B in cancer and cancer metastasis(Review)[J].Oncology Reports,2016,36(1):3-9.
[4]Müller SL,Portwich M,Schmidt A,et al.The tight junction protein occludin and the adherens junction protein alpha-catenin share a common interaction mechanism with ZO-1[J].Journal of Biological Chemistry,2005,280(5):3747-3756.
[5]Kim B,Breton S.The MAPK/ERK-Signaling Pathway Regulates the Expression and Distribution of Tight Junction Proteins in the Mouse Proximal Epididymis1[J].Biology of Reproduction,2016,94(1):1-12,22.
[6]Pizzino G,Bitto A,Pallio G,et al.Blockade of the JNK signalling as a rational therapeutic approach to modulate the early and late steps of the inflammatory cascade in polymicrobial sepsis[J].Mediators of Inflammation,2015(2015):591572.doi:10.1155/2015/591572.
[7]Wardill HR,Gibson RJ,Logan RM,et al.TLR4/PKC mediated tight junction modulation:Aclinical marker of chemotherapy-induced gut toxicity?[J].Int J Cancer,2014,135(11):2483-2492.
[8]Cao M,Wang P,Sun C,et al.Amelioration of IFN-γ and TNF-α-Induced Intestinal Epithelial Barrier Dysfunction by Berberine via Suppression of MLCK-MLC Phosphorylation Signaling Pathway[J].Plos One,2013,8(5):e61944.doi:10.1371/journal.pone.0061944.
[9]Meyer TN,Hunt J,Schwesinger C,et al.Galpha12 regulates epithelial cell junctions through Src tyrosine kinases[J].Am J Physiol Cell Physiol,2003,285(5):C1281-1293.
[10]Morikawa T,Baba Y,Mai Y,et al.STAT3 Expression,Molecular Features,Inflammation Patterns and Prognosis in a Database of 724 Colorectal Cancers[J].Clinical Cancer Research,2011,17(17):1452-1462.
[11]韩宾,盛百伐,张治草,等.小鼠肠急性缺血再灌注模型中芳香烃受体活化对肠黏膜屏障功能的影响[J].第三军医大学学报,2016,38(10):1090-1095.
[12]Wu RL,Vazquezroque MI,Carlson P,et al.Gluten-induced symptoms in diarrhea-predominant irritable bowel syndrome are associated with increased myosin light chain kinase activity and claudin-15 expression[J].Laboratory investigation;a journal of technical methods and pathology,2017,97(1):14-23.
[13]Vivinus-Nébot M,Frin-Mathy G,Bzioueche H,et al.Functional bowel symptoms in quiescent inflammatory bowel diseases:role of epithelial barrier disruption and low-grade inflammation[J].Gut,2014,63(5):744-752.
[14]Barmeyer C,Schulzke JD,Fromm M.Claudin-related intestinal diseases[J].Seminars in Cell&Developmental Biology,2015,42:30-38.
[15]李燕,吴密璐,骆玉霜,等.紧密连接蛋白1和血管内皮生长因子C蛋白与大肠癌的关系研究[J].重庆医学,2016,45(7):909-911.
[16]de Souza WF,Fortunatomiranda N,Robbs BK,et al.Claudin-3 Overexpression Increases the Malignant Potential of Colorectal Cancer Cells:Roles of ERK1/2 and PI3K-Akt as Modulators of EGFR signaling[J].Plos One,2013,8(9):e74994.doi:10.1371/journal.pone.0074994.
[17]张强.肠致病性大肠杆菌EPEC及其突变株UMD874感染对肠黏膜屏障功能及肠道菌群的影响[D].南京大学,2011.
[19]陈生林.肠道病毒71型感染人肠道细胞的入侵机制研究[D].第二军医大学,2016.
[20]Nazli A,Chan O,Dobson-Belaire WN,et al.Exposure to HIV-1 directly impairs mucosal epithelial barrier integrity allowing microbial tuanslocation[J].PLoS Pathogens,2010,6(4):e1000852.doi:10.1371/journal.ppat.1000852.
[21]Lekkou A,Mouzaki A,Siagris D,et al.Serum lipid profile,cytokine production,and clinical outcome in patients with severe sepsis[J].Journal of Critical Care,2014,29(5):723-727.
[22]Wang F,Graham WV,Wang Y,et al.Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression[J].American Journal of Pathology,2005,166(2):409-419.
[23]王宏刚,张伟,朱维铭,等.多黏菌素E诱导肠道菌群失调对肠屏障功能和细菌易位的影响[J].肠外与肠内营养,2012,19(2):102-106.
[24]Srutkova D,Schwarzer M,Hudcovic T,et al.Bifidobacterium longum CCM 7952 Promotes Epithelial Barrier Function and Prevents Acute DSS-Induced Colitis in Strictly Strain-Specific Manner[J].Plos One,2015,10(7):e0134050.doi:10.1371/journal.pone.0134050.
[25]Smith IM,Baker A,Arneborg N,et al.Non-Saccharomyces yeasts protect against epithelial cell barrier disruption induced by Salmonella enterica subsp.enterica serovar Typhimurium[J].Letters in Applied Microbiology,2015,61(5):491-497.
[26]Yu Q,Yuan L,Deng J,et al.Lactobacillus protects the integrity of intestinal epithelial barrier damaged by pathogenic bacteria[J].Frontiers in Cellular&Infection Microbiology,2015,5:26.doi:10.3389/fcimb.2015.00026.
[27]Yang F,Wang A,Zeng X,et al.Lactobacillus reuteri I5007 modulates tight junction protein expression in IPEC-J2 cells with LPS stimulation and in newborn piglets under normal conditions[J].BMC Microbiology,2015,15(1):1-11.
[28]Soendergaard C,Young JA,Kopchick JJ.Growth Hormone Resistance-Special Focus on Inflammatory Bowel Disease[J].International Journal of Molecular Sciences,2017,18(5):1019.doi:10.3390/ijms18051019.
[29]雷姗.生长抑素对肠上皮细胞屏障功能的保护作用及机制研究[D].南方医科大学,2014.
[30]Yi Z,Fan H,Liu X,et al.Adrenomedullin improves intestinal epithelial barrier function by downregulating myosin light chain phosphorylation in ulcerative colitis rats[J].Molecular Medicine Reports,2015,12(3):3615-3620.
[31]田铸,周维均,苟亚军.肾上腺髓质素对肠上皮细胞缺氧/复氧后屏障功能的影响[J].局解手术学杂志,2016,25(4):251-254.
[32]Fischer A,Gluth M,Weege F,et al.Glucocorticoids regulate barrier function and claudin expression in intestinal epithelial cells via MKP-1[J].American Journal of Physiology Gastrointestinal&Liver Physiology,2014,306(3):218-228.
[33]Braniste V,Leveque M,Buisson-Brenac C,et al.Oestradiol decreases colonic permeability through oestrogen receptor beta-mediated up-regulation of occludin and junctional adhesion molecule-A in epithelial cells[J].Journal of Physiology,2009,587(13):3317-3328.
[34]洪流东,黄会云,陈玉,等.健脾清热活血类方药对溃疡性结肠炎肠黏膜功能障碍及claudin-2、claudin-5的影响[J].中国中西医结合消化杂志,2015(9):599-603.
[35]翟金海,沈洪,倪菲菲,等.清肠化湿方对实验性大鼠结肠炎结肠黏膜上皮细胞紧密连接蛋白claudin-1的影响[J].南京中医药大学学报,2013,29(2):151-154.
[36]Shang HX,Wang AQ,Bao CH,et al.Moxibustion combined with acupuncture increases tight junction protein expression in Crohn's disease patients[J].World Journal of Gastroenterology,2015,21(16):4986-4996.
