甲状腺乳头状癌中PRL-3表达与肿瘤相关巨噬细胞及淋巴管生成的相关性
2018-05-10孙振华蒋华平陶文华
孙振华 蒋华平 陶文华
江苏大学附属医院1甲乳外科,2头颈外科,3中医肿瘤科(江苏镇江212000)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺疾病中最常见的恶性肿瘤类型,其发病率近年来有上升的趋势,早期易发生淋巴结的转移[1-3]。研究[4-5]表明,肿瘤微环境中的基质细胞在甲状腺癌发生发展和侵袭转移的进程中发挥了重要的作用,微环境中肿瘤相关巨噬细胞(tumor associated macrophags,TAMs)中可以有表型的变化,产生促使肿瘤生长的能力。而肝再生磷酸酶3(phosphatase of regenerating liver-3,PRL-3)作为具有促进细胞增殖、迁移和侵袭的蛋白酪氨酸磷酸酶,在PTC中高表达,且与肿瘤大小及淋巴结转移相关[6-8]。本研究拟检测PTC中PRL-3、TAMs标志物CD68和淋巴管内皮标记物D2-40的表达,分析PRL-3表达与TAMs及淋巴管生成的相关性。
1 资料与方法
1.1 标本收集江苏大学附属医院甲乳外科2014年1月至2017年6月部分PTC手术切除病理标本70例,其中男24例,女46例;年龄22~68岁,中位年龄46.5岁;有颈部淋巴结转移39例,无淋巴结转移31例。另取20例甲状腺腺瘤组织作为良性疾病对照组。
1.2 试剂及方法PRL-3、CD68和D2-40蛋白表达用SP免疫组织化学法检测。免抗人PRL-3多克隆抗体购自英国Abcam公司,鼠抗人CD68单克隆抗体、鼠抗人D2-40单克隆抗体及SP试剂盒均购自北京中杉公司。阳性对照使用已知阳性切片,阴性对照用PBS代替一抗,按试剂盒说明书进行检测。
1.3 切片免疫组化结果根据阳性细胞百分比及染色强度评分判定,依照阳性细胞比例:<5%、5%~25%、25%~50%、50%~75%、>75%分别得0分、1分、2分、3分、4分;依照显色强度:未着色、浅黄色、棕黄色、棕褐色分别得0分、1分、2分、3分;将两项得分相乘得到该视野的最终得分,选取的5个视野得分的平均值为最后得分。最后该切片按照得分为以下四个等级:0~1分为(-),2~4分为(+),5~7分(++),≥8分(+++),++以上为阳性表达[9-10]。D2-40标记的淋巴管数目计数参照Weidner标准。低倍镜(×40)下选取密度较高淋巴管区域,然后在高倍镜(×200)下5个高倍视野计数被染色的淋巴管数,染成棕色的内皮细胞或内皮细胞簇计为一个淋巴管,取其平均值作为淋巴管密度(LVD)[11]。
1.4 统计学方法应用SPSS 22.0软件进行统计分析。计数资料采用χ2检验,以P<0.05为统计学有差异。相关性采用Spearman等级相关分析,连续变量采用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 PRL-3、CD68和D2-40在PTC及甲状腺腺瘤中的表达PRL-3阳性表达定位于肿瘤细胞的细胞浆和细胞膜,PTC、甲状腺腺瘤中PRL-3蛋白的阳性表达率分别为64.3%和15.0%,二组相比差异有统计学意义(P<0.01);CD68阳性表达定位于TAMs的细胞浆和细胞膜,主要是细胞浆。PTC中TAMs的密度高于甲状腺腺瘤中的密度(P<0.01);D2-40在PTC组织中的表达水平高于在甲状腺腺瘤组织中的表达水平(P<0.01)。见表1。

表1 PRL-3、CD68和D2-40蛋白表达的比较Tab.1 Comparison of each protein expression between the two groups of specimens
2.2 PRL-3、CD68和D2-40表达与PTC病理特征的关系PTC组织中,PRL-3、CD68和D2-40的表达水平与患者年龄、性别及肿瘤大小无关(P>0.05),但与淋巴结有无转移相关(P<0.01)(表2,图1)。Spearman相关性分析表明,PRL-3、CD68和D2-40三者表达水平呈现正相关性(P<0.05)(表3)。

表2 PRL-3、CD68及D2-40与PTC临床病理特征的关系Tab.2 The relations of each protein expression with the clinicopathologic variables of papillary thyroid carcinoma patients

图1 免疫组化(SP法)检测PRL-3、CD68及D2-40蛋白的表达(×200)Fig.1 Immunohistochemical staining for PRL-3(A),CD68(B)and D2-40(C)expressions(×200)
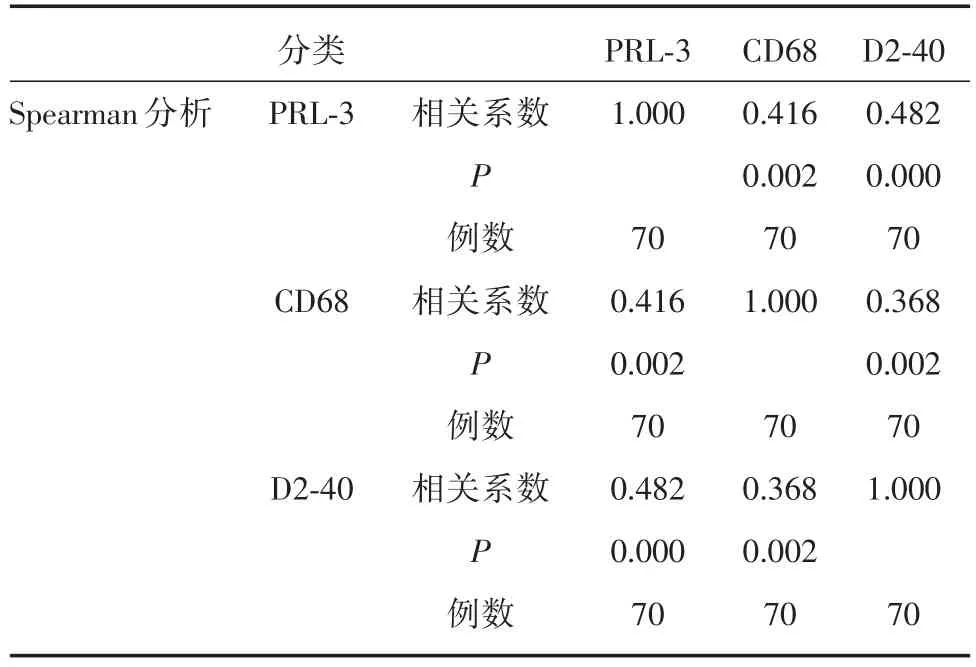
表3 PRL-3、CD68及D2-40在甲状腺乳头状癌中表达的相关性Tabl.3 The correlation among three proteins in papillary thyroid carcinoma
3 讨论
PTC是甲状腺疾病中最常见的肿瘤类型,其发病率近年来呈现上升趋势,早期易发生区域性淋巴结转移。而PRL-3是PRLs基因家族成员之一,是新近发现的蛋白酪氨酸磷酸酶家族成员,其分子结构体现了双重特异性磷酸酶的典型特征[12-13]。目前已经证明某些恶性肿瘤发生发展与PRL-3关系密切,其作为靶点在肿瘤治疗中的潜力已经体现,但PRL-3在PTC侵袭转移中的作用及其分子机制未得到充分研究[14-16]。关于PRL-3诱导PTC微环境中巨噬细胞的募集和分化、促进PTC淋巴转移、肿瘤侵袭的分子机制尚未见报道。本研究检测PTC中的PRL-3、TAMs标记物CD68和淋巴管内皮标记物D2-40的表达,并对性别、年龄、淋巴结转移、肿瘤大小病理学特征进行分析,探讨PRL-3在PTC发生、发展中的作用。
PRL-3基因在肿瘤进展中的作用具有多效性,Al-Aidaroos等在多种人肿瘤细胞系中发现了PRL-3诱导表皮生长因子受体(EGFR)的过度激活和级联放大的下游信号[17]。本研究发现,PTC组中PRL-3表达的阳性率为64.3%,高于其在甲状腺腺瘤组中的阳性率15.0%(P<0.05),提示PRL-3可能参与甲状腺乳头状癌的发生过程。对于PTC而言,PRL-3在淋巴结转移组中的阳性率为79.5%,高于其在无淋巴结转移组中的阳性率45.2%,差异有统计学意义(P<0.01);而其在性别、年龄、肿瘤大小分组中的表达水平无明显差异(P>0.05)。Spearman相关性分析后表明,PRL-3的表达与CD68、D2-40的表达水平呈正相关性(P<0.05)。以上结果说明PRL-3的高表达可以促进TAMs的增殖和淋巴管生长,在PTC肿瘤的进展演进及淋巴转移过程中发挥了重要的作用。
PTC最主要的转移方式是颈部淋巴结转移,约70%的患者发病时就可能合并区域性淋巴结转移。研究证实,TAMs主要是通过自分泌和(或)旁分泌途径参与肿瘤淋巴管的生成[18]。研究肿瘤发生发展过程中的TAMs的功能状态具有重要意义,而CD68是目前研究TAMs的特异性标志物,检测其表达水平可以了解TAMs的功能状态[19-20]。本研究表明,CD68在PTC组中的阳性表达(71.8%)高于甲状腺腺瘤组(20.0%),差异有统计学意义(P<0.01);而在PTC组中,CD68阳性表达与年龄、性别及肿瘤大小无关(P>0.05),但是其在淋巴结转移组中的阳性率(87.2%)高于无淋巴结转移组(54.8%),差异有统计学意义(P<0.01);Spearman相关分析结果表明,CD68与D2-40的表达水平呈正相关,说明了TAMs不仅在PTC发生发展中起作用,而且也参与了肿瘤淋巴转移的过程,其也可能作为甲状腺乳头状癌的预后参考指标。
某些具有转移特性或血管侵袭性的肿瘤组织内部淋巴管密度增加,这说明肿瘤内部淋巴管既关系到肿瘤的局部复发、淋巴结转移及预后,还可能参与了肿瘤细胞的恶性演进[21]。D2-40的特点是可以特异性的标记淋巴管,血管却不被标记,因此可以准确的检测组织淋巴管的密度[22]。本研究发现LVD在PTC组中的水平(11.26±5.12)高于甲状腺腺瘤组(3.78±2.13),差异有统计学意义(P<0.01);而LVD密度在PTC组中与性别、年龄及肿瘤大小无关,与淋巴结转移相关,表明PTC肿瘤组织中淋巴管的数量与肿瘤的淋巴结转移密切相关。而淋巴管在数量上的增加,将会使肿瘤细胞进一步沿淋巴管的播散成为可能,这也是甲状腺乳头状癌容易发生淋巴转移的原因。
综上所述,PRL-3在PTC中高表达,其表达水平与CD68、D2-40呈正相关性,三者在PTC的发生发展以及淋巴结转移进程中发挥了重要的作用,而其中的分子机制有待进一步揭示。
[1]CELIK H,AKGUL O,YıLDıZ B D,et al.Predictors of central lymph node metastasis in papillary thyroid cancer[J].Ann Ital Chir,2017,88:193-197.
[2]GAO M,GE M,JI Q,et al.2016 Chinese expert consensus and guidelines for the diagnosis and treatment of papillary thyroid microcarcinoma[J].Cancer Biol Med,2017,14(3):203-211.
[3]ZHENG G,ZHANG H,HAO S,et al.Patterns and clinical significance of cervical lymph node metastasis in papillary thyroid cancer patients with Delphian lymph node metastasis[J].Oncotarget.,2017,8(34):57089-57098.
[4]CAN N Y,AYTURK S,CELIK M,et al.Histological perspective on the effects of tumor-associated macrophages in the tumor microenvironment surrounding papillary thyroid carcinoma[J].Pol J Pathol,2016,67(4):332-344.
[5]GILL K S,TASSONE P,HAMILTON J,et al.Thyroid cancer metabolism:a review[J].J Thyroid Disord Ther,2016,Feb;5(1).pii:200.
[6]YE Z,AL-AIDAROOS A Q,PARK J E,et al.PRL-3 activates mTORC1 in cancer progression[J].Sci Rep,2015,Nov 24;5:17046.
[7]THURA M,AL-AIDAROOS A Q,et al.PRL3-zumab,a first-inclass humanized antibody for cancer therapy[J].JCI Insight,2016,Jun 16;1(9):e87607.
[8]QIN R ,SHEN M ,TU Y.Expression and significance of PRL-3 in thyroid papillary carcinoma[J].Acta Universitatis Medicinalis Nanjing,2013,33(3):342-345.
[9]RADU T G,CIUREA M E,MOGOANTĂ S Ş,et al.Papillary thyroid cancer stroma-histological and immunohistochemical study[J].Rom J Morphol Embryol,2016,57(2 Suppl):801-809.
[10]张学东,陈士超,焦德,等.Slug在甲状腺乳头状癌中的表达及其临床意义[J].实用医学杂志,2016,32(19):3197-3199.
[11]ABDUL-AZIZ M A,AMIN A K,EL-ROUBY D H,et al.Lymphangiogenesis in oral squamous cell carcinoma:correlation with VEGF-C expression and lymph node metastasis[J].Int J Dent,2017,2017:7285656.
[12]LIAN S,MENG L,YANG Y,et al.PRL-3 promotes telomere deprotection and chromosomal instability[J].Nucleic Acids Res,2017,Jun 20;45(11):6546-6571.
[13]ZHOU J,CHAN Z L,BI C,et al.LIN28B Activation by PRL-3 promotes leukemogenesis and a stem cell-like transcriptional program in AML[ J].Mol Cancer Res,2017,Mar;15(3):294-303.
[14]SONI P,HUSAIN N,CHANDRA A,et al.Do phosphatase of regenerating liver-3,matrix metalloproteinases-2,matrix metalloproteinases-9,and epidermal growth factor receptor-1 predict response to therapy and survival in glioblastoma multiforme?[J]Indian J Pathol Microbiol,2016,Jul-Sep;59(3):287-93.
[15]WANG L,LIU J,ZHONG Z,et al.PTP4A3 is a target for inhibition of cell proliferatin,migration and invasion through Akt/mTOR signaling pathway in glioblastoma under the regulation of miR-137[J].Brain Res,2016,Sep 1;1646:441-450.
[16]FOY M,ANÉZO O,SAULE S,et al.PRL-3/PTP4A3 phosphatase regulates integrin β1 in adhesion structures during migration of human ocular melanoma cells[J].Exp Cell Res,2017,Apr 15;353(2):88-99.
[17]AL-AIDAROOS A Q,YUEN H F.Metastasis-associated PRL-3 induces EGFR activation and addiction in cancer cells[J].J ClinInvest,2013,123(8):3459-3471.
[18]冯稳,陈奎生,于庆凯,等.肿瘤相关巨噬细胞、基质金属蛋白酶-9与食管鳞癌浸润、转移的关系[J].实用医学杂志,2016,32(2):235-238.
[19]YIN Y,YAO S,HU Y,et al.The immune-microenvironment confers chemoresistance of colorectal cancer through macrophage-derived IL-6[J].Clin Cancer Res,2017,Sep 19.pii:clincanres.1283.2017.
[20]ATANASOV G,DIETEL C,FELDBRÜGGE L,et al.Tumor necrosis and infiltrating macrophages predict survival after curative resection for cholangiocarcinoma[J].Oncoimmunology,2017,Jun 28;6(8):e1331806.
[21]ZHANG S,ZHANG D,GONG M,et al.High lymphatic vessel density and presence of lymphovascular invasion both predict poor prognosis in breast cancer[J].BMC Cancer,2017,May 17;17(1):335.
[22]ABE N,OHTAKE T,SAITO K,et al.Clinicopathological significance of lymphangiogenesis detected by immunohistochemistry using D2-40 monoclonal antibody in breast cancer[J].Fukushima J Med Sci,2016,Jun 8;62(1):57-63.
