甲状腺癌基因检测在甲状腺结节早期诊断中的临床应用
2018-05-10张红梅周红燕汪佩喻佛定王娟娟易兰
张红梅 周红燕 汪佩 喻佛定 王娟娟 易兰
华中科技大学同济医学院附属武汉中心医院内分泌科(武汉 430015)
甲状腺结节和甲状腺癌(thryoid cancer)是内分泌系统的多发病和常见病。传统超声检查以其无创性、无放射性,已成为甲状腺疾病的首选辅助检查。彩色多普勒超声根据甲状腺结节大小、形态、周围及内部的血供、内部回声类型及分布、边界、有无钙化等各种特征,来判断其良恶性,但国内外学者均认为单独一个特征不能很好地鉴别结节的良恶性,即使结合目前兴起的超声弹性应变率检测,仍存在一定的主观性[1]。甲状腺细针穿刺抽吸活检(FNAB)被认为是术前鉴别诊断的最佳指标,但仍有10%~30%不能明确诊断,研究证实,60%~70%的甲状腺癌存在至少一种分子遗传学改变,而这些分子遗传学改变可作为潜在的分子标志物,用于临床诊断、危险分级、疗效及预后预测[2]。目前国内外诊疗指南均推荐:经FNAB不能确诊的甲状腺结节,可行甲状腺癌分子标记物检测[3],但其循证医学证据尚不充足,我们的研究拟对甲状腺结节术前行FNAB联合分子诊断及彩色超声联合检测分析,探讨其对甲状腺癌早期诊断的临床意义,为甲状腺结节的规范化治疗提供循证医学证据。
1 资料与方法
1.1 对象选取2015年1月到2016年5月在华中科技大学武汉市中心医院行甲状腺全切或次全切的患者61例,纳入标准:均为术前同意行甲状腺细针穿刺抽吸活检及癌基因分子诊断检测项目,首次入院行手术治疗,术后行病理组织学检查,有完整的病理描述资料的患者。排除标准:既往曾患有甲状腺功能性疾病并服用药物治疗者、既往有甲状腺手术史、凝血机制异常者、有甲状腺癌家族史者。本研究经我院伦理委员会批准,受试者均按自愿原则,签署知情同意书。
1.2 方法本研究为回顾性分析研究,所有病例按术后病理检查结果分为:良性甲状腺结节组和甲状腺恶性肿瘤组。回顾性分析患者人口学特征及FNAB、甲状腺癌基因检测及彩色超声特征。各项指标检测方法如下:
1.2.1 彩色超声检查使用飞利浦IU22彩色多普勒超声诊断仪(荷兰皇家飞利浦电子集团生产),探头型号:L12-5 Linear Probe,探头频率为5~12 MHz。患者取仰卧位、垫肩,颈部过伸,充分暴露颈前区,常规行多切面扫查,仔细观察并记录病灶大小、质地、边界、纵横比是否>1、内部回声是否均匀及有无钙化,病灶周围和内部血流情况等,并常规扫查颈部淋巴结有无肿大。
1.2.2 FNAB所有患者术前进行血常规及凝血功能检查。超声引导下细针穿刺,抽取组织液送检细胞学及癌基因分子诊断。患者取仰卧位,垫肩,颈部过伸,充分暴露颈前区,超声引导应用高频线阵探头,频率12 MHz,对甲状腺进行常规检查的同时消毒颈前区,2%利多卡因局部麻醉手术部位,将穿刺针(23 G*8 cm)于超声定位点进针,不接负压装置,在5 s内变换不同针道进行反复提插,再用超声实时观察进针点,全程监视穿刺针方向和位置,到达病灶区,吸出组织液注于载玻片上,病理科医师实时涂片染色并在显微镜下评估细胞。穿刺部位棉球压迫15 min。
彩色超声检查和FNAB两种检查结果分别由2位经验丰富的副主任医师完成。
1.2.3 甲状腺癌基因检测细针穿刺物同时送武汉康圣环球医学检测集团,运用miRInform分子检测及Luminex液态芯片技术,检测FNAB样本中BRAF基因点突变、RET/PTC重排、Pax8/PPARγ重排和RAS基因点突变。
1.2.4 病理学检查结果所有病例都对术中探查发现的每一个甲状腺结节进行冰冻病理切片检查,手术后再进行石蜡切片核实。
1.3 统计学方法采用SPSS 24.0和MedCalc15.0软件进行统计学分析。分析流程是:(1)2组基线特征统计分析,对计量资料进行正态性检验,符合正态分布的计量资料采用t检验,以均数±标准差表示,计数资料采用χ2检验以百分率表示;(2)用KAPPA值检验不同检测方法的诊断一致性;(3)以术后病检结果为因变量,各项临床特征为为自变量建立甲状腺癌Logistic回归模型;(4)用病检结果为金指标,用ROC曲线计算甲状腺癌预测概率和病例诊断的诊断阈值、灵敏度和特异度。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较61例甲状腺结节患者,平均年龄(44.97±12.05)岁,其中女50人,占82%,男10人,仅占18%,良性甲状腺结节组31人,占50.8%,恶性结节组30人,占49.2%,其中29例均为微小乳头状癌,1例为滤泡状癌,两组在年龄和性别分布上差异无统计学意义(表1)。
2.2 两组FNAB结果比较恶性组的阳性检出率为70%,良性组阴性检测率为93.5%,两组比较差异有统计学意义(P值为0.000)。
2.3 两组甲状腺癌基因突变检测结果比较恶性组有24例基因突变阳性病例,占80%,均为BRAF基因c.1799T>A突变,导致氨基酸发生p.Val600Glu改变,未见RET/PTC1及RET/PTC3改变,而良性组的阴性率为96.8%,两组比较差异有统计学意义(P值为0.000)。
2.4 FNAB和癌基因检测诊断的一致性经KAPPA检验二者的诊断一致性指数为0.73,一致性较好,且有统计学差异。
2.5 两组在彩色超声特征上比较结节大小比较,良性组<1 cm的有29人,占93.5%,恶性组>1 cm的有9例,占31.0%,两组比较差异有统计学意义(P值为0.02);结节为低回声的在恶性组有26例,占86.7%,良性组有17例,占54.8%,两组比较差异有统计学意义(P值为0.011);两组在结节质地、钙化与否、结节个数、周边血流、纵横比、周围淋巴结是否肿大等特征方面比较,差异无统计学意义(P>0.05)。
2.6 以术后病检结果为因变量,各项临床特征为为自变量建立甲状腺癌Logistic回归模型结果显示:与甲状腺癌诊断相关的指标依次为癌基因检测、结节大小、低回声和细针穿刺细胞学,且只有癌基因检测对甲状腺结节性质的诊断有统计学意义(表2),其回归方程为:


表1 甲状腺结节良性组和恶性组的临床特征比较Tab.1 The comparison of clinical features between benign thyroid nodules group and malignant group 例(%)

表2 非条件Logistic回归分析结果Tab.2 The results of the non-conditional logistic regression analysis
2.6 由ROC曲线下面积判断临床指标价值与甲状腺癌显著相关的诊断指标及其AUC分别是:癌基因检测0.915(95%CI:0.814 ~ 0.971)、细针穿刺细胞学 0.813(95%CI:0.691 ~ 0.902)、低回声0.657(95%CI:0.523 ~ 0.775)、结节大小0.623(95%CI:0.488 ~ 0.745),联合诊断模型AUC为0.957(95%CI:0.871~0.993),所建的联合诊断模型价值最高,其灵敏度为93.1%,特异度为90.3%,最佳诊断点为0.134 1,即通过模型计算病例的恶性概率,如果恶性概率≥0.134 1,则认为该病例的甲状腺结节为恶性(图1)。
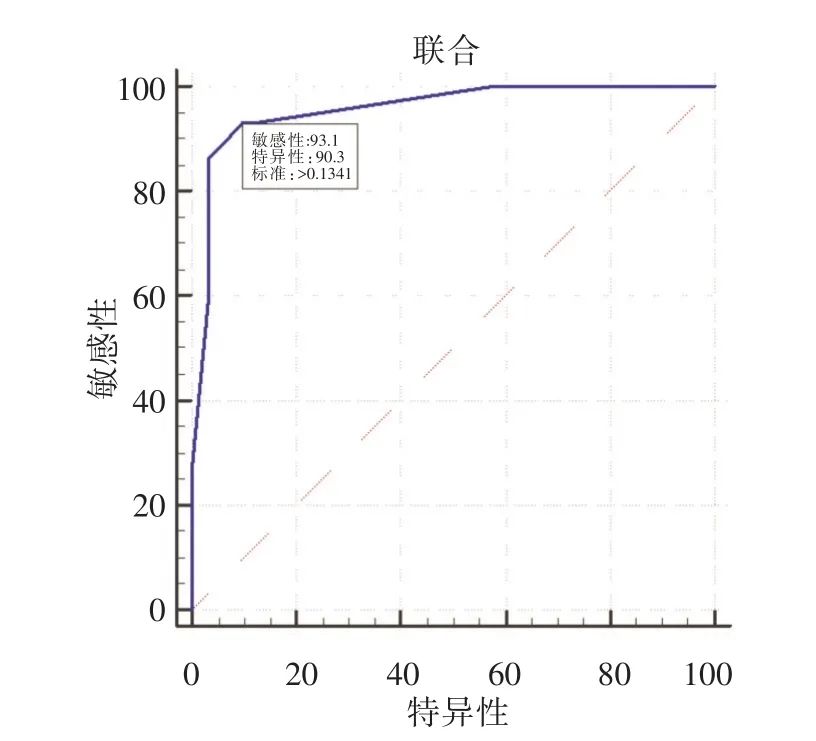
图1 联合诊断模型预测概率与甲状腺结节性质的ROC曲线Fig.1 The ROC curve of the predictive probability of combined diagnostic model and the properties of thyroid nodules
3 讨论
在过去的几十年里,随着TC的全球发病率迅速上升,发达国家TC的年龄标化发病率女性升至9.1/10万,男性为2.9/10万[4]。TC的高发生率及甲状腺结节的过度手术已引起医学界的广泛关注[5],当超声或查体检测出甲状腺结节后,如何诊断其良恶性成为指导下一步治疗的关键。
随着甲状腺超声的逐渐普及,以及我国碘营养状态从缺碘走向富碘,TC的流行病学特点发生了明显变化,如分化型甲状腺癌增加,滤泡型甲状腺癌减少,微小癌明显增多[6],且女性占比远高于男性,本研究显示:甲状腺结节患者中女性占比82%,,恶性结节组30例中,29例均为微小乳头状癌,1例为滤泡状癌,与国内外流行病学资料一致[7],在这部分术前行FNAB和甲状腺癌基因检测的61例中,TC的百分比为49.2%,二者的诊断一致性较好,这一结果提示FNAB和癌基因分子标记物检测对术前诊断的重要性。本研究中癌基因检测的敏感度均达91.5%,高于FNAB细针穿刺细胞学(81.3%)、低回声(65.7%)和结节大小(62.3%),且癌基因检测的特异性高达96.5%,FNAB为93.5%,如果联合癌基因检测、FNAB、超声特征诊断敏感性提高到93.1%,特异性为90.3%。高于国内其他研究者联合FNAB和分子检测[8],从此可以看出:虽然FNAB作为评估甲状腺结节性质,指导治疗决策的“金标准”,被国内外指南所推荐[3],但癌基因分子标记物的检测其特异性和敏感性更高,如果结合FNAB和彩色超声检查,有助于进一步在术前明确结节性质,减少不必要手术。
在PTC和FTC中,有4种突变类型被认为是最主要的突变,对肿瘤的诊断和预后意义重大,分别是:BRAF点突变基因、RET/PTC重排、Pax8/PPARγ重排和RAS点突变基因。BRAF基因突变在PTC发生发展中的作用机制是研究的热点,其参与RAS-RAF-有丝分裂原活化蛋白(MEK)-细胞外信号调节激酶(ERK)-丝裂原活化蛋白激酶(MAPK)途径的信号传导。BRAF基因第15外显子上的T1799A突变导致BRAF蛋白产物的600残基中的缬氨酸被谷氨酸替代(V600E),因而引起了MAPK通路中REK和MEK的肿瘤基因的级联激活反应,导致细胞无限制分裂、增殖、肿瘤形成[9]。V600E点突变是BRAF基因中最常见的遗传病变,约占PTC的45%。BRAF基因突变作用机制可能还与一些重要的肿瘤因子(金属蛋白酶组织抑制因子3,死亡相关蛋白激酶等)的甲基化有关[10],也可能通过促进 NF-κB[11]及 VEGF 的表达[12],促进血管生成,肿瘤侵袭和转移等。因而许多学者提出对BRAF阳性者治疗上需要施行甲状腺全切术加中心淋巴结清除,术后需要更高剂量的放射性碘治疗,更低的促甲状腺激素抑制。
研究发现:联合检测多个分子标记物比单一标志物有更大的诊断意义。细胞学病理诊断为恶性肿瘤的标本,最后组织学病理证实恶性率为40%,而如果是检测多个分子标记物,在突变阳性的标本中恶性率达到100%,而在突变阴性的标本中约有14%为恶性。分子检测能将细胞学检测假阴性率由2.1%降至0.9%。
在我们的研究中,有6例FNAB结果为阴性,而病检结果为阳性,其中4例癌基因检测发现有BRAF基因突变,推测其与细针穿刺所取组织细胞有限,而分子诊断能很好弥补FNAB的不足,进一步提高甲状腺癌的术前诊断准确率,我们的研究发现开展分子诊断的不足之处在于:能接受穿刺的人群比例较低,需加强对甲状腺结节患者的宣教,另检测费用偏高,如果能进一步改进检测技术,降低检测成本,分子诊断有可能发展为常规检测方法,从而为现代甲状腺癌的诊断和治疗策略提供有力的依据。
[1]梁婷,丛淑珍.超声弹性应变率在甲状腺结节良恶性鉴别诊断中的应用价值[J].实用医学杂志,2011,27(22):4120-4122.
[2]黄铀新,刘家锋,刘少强,等.甲状腺癌患者血浆循环肿瘤DNA含量及BRAFV600E突变联合检测的临床意义[J].实用医学杂志,2017,33(14):2318-2321.
[3]HAUGEN B R,ALEXANDER E K,BIBLE K C,et al.2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer:the american thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J].Thyroid,2016,26(1):1-133.
[4]LA VECCHIA C,MALVEZZI M,BOSETTI C,et al.Thyroid cancer mortality and incidence:a global overview[J].Int J Cancer,2015,136(9):2187-2195.
[5]腾卫平.我国面临甲状腺癌“过度诊断”的挑战[J].中华内分泌代谢杂志,2016,32(7):531-532.
[6]李翔,程爱群,葛睿,等.302例老年甲状腺手术临床分析[J].老年医学与保健,2010,16(1):25-27.
[7]翟建敏,原韶玲.甲状腺癌危险因素研究进展[J].中华肿瘤防治杂志,2012,19(10):791-795.
[8]罗雁,安宁,宋丽娟,等.FNAB联合BRAF基因突变检测在术前甲状腺结节诊断中的应用[J].临床与实验病理学杂志,2016,32(11):1248-1251.
[9]GERTZ R J,NIKIFOROV Y,REHRAUER W,et al.Mutation in BRAF and other members of the MAPK pathway in papillary thyroid carcinoma in the pediatric population[J].Arch Pathol Lab Med,2016,140(2):134-139.
[10]BELTRAMI C M,DOS REIS M B,BARROS-FILHO M C,et al.Integrated data analysis reveals potential drivers and pathways disrupted by DNA methylation in papillary thyroid carcinomas[J].Clin Epigenetics,2017,9:45.
[11]ZHOU D,LI Z,BAI X.BRAFV600E and RET/PTC promote proliferation and migration of papillary thyroid carcinoma cells in Vitro by regulating nuclear factor-κB[J].Med Sci Monit.2017,23:5321-5329.
[12]COMUNANZA V,CORA D,ORSO F,et al.VEGF blockade enhances the antitumor effect of BRAFV600E inhibition[J]..EMBO Mol Med,2017,9(2):219-237.
