腹膜透析患者发生代谢综合征的影响因素
2018-05-10韦海媛黎伟甘兰蒙东梅潘玲
韦海媛 黎伟 甘兰 蒙东梅 潘玲
1广西医科大学研究生学院(南宁530021);2广西医科大学第二附属医院肾内科(南宁 530021);3广西医科大学第一附属医院肾内科(南宁 530021)
腹膜透析(peritoneal dialysis,PD)是终末期肾病(ESRD)患者有效的肾脏替代疗法之一,虽然近年来腹膜透析技术日臻成熟,但仍存在发生一系列合并症的可能,制约着患者的预后,影响患者的生存质量。近年来有研究发现,代谢综合征(metabolic syndrome,MS)在腹膜透析患者中患病率较高,可高达40%~60%,是PD患者常见的并发症[1]。而且,合并MS的腹透患者5年生存率明显低于不合并MS的腹透患者,MS可促进肾功能进展、加剧氧化应激甚至增加心血管并发症的风险[2],是影响PD患者预后的重要危险因素[3]。但总体来说,目前关于PD和MS及各代谢组分的相关研究论文仍非常有限,本文拟对我院规律随访的PD患者的临床资料进行分析,旨在了解PD患者中MS及各代谢组分的患病情况,探讨PD患者发生MS的相关影响因素,对治疗PD合并症、改善PD患者预后提供一定理论依据。
1 资料与方法
1.1 一般资料选取2014年9月至2016年9月在广西医科大学第一及第二附属医院腹透中心随访的持续性不卧床腹膜透析(CAPD)患者104例,取最后一次随访时的资料,回顾性分析患者的临床资料。入选标准:18岁以上,规律腹透3个月以上,每日腹透量6~10 L。排除标准:急性心衰、急性脑血管意外、恶性肿瘤、严重肝病、急性腹膜炎及近1个月内使用激素及免疫抑制剂患者。104例患者中,男58例,女46例。男女比为1.26∶1,年龄19~75岁,平均(49.3±12.1)岁。腹透龄3个月至12年,平均腹透(22.15±23.78)个月。病因:慢性肾小球肾炎70.2%、高血压肾病17.3%、糖尿病肾病2.9%、其他病因占9.6%。
1.2 方法采集入选病例所有临床资料,包括性别、年龄、腹透龄及血压等,所有调查对象均隔夜空腹8 h以上,抽静脉血测血常规、肝功能、肾功能、电解质、血糖、血脂等。估算肾小球滤过率,予心脏彩超检查。并行腹膜平衡试验(PET),评估腹膜转运类型(D/P),测定24 h尿及腹透液生化,计算透析充分性指标KT/V,评估透析充分性[4]。血糖用氧化酶法测定,血脂用酶法测定。根据中华医学会糖尿病分会(CDS)2004年MS诊断标准[5],具备以下3项及以上者判定为MS:(1)超重和(或)肥胖:体质量指数(BMI)≥ 25.0 kg/m2;(2)高血糖:空腹血糖(FPG)≥6.1 mmol/L及(或)餐后2 h血糖(2 h PG)≥ 7.8 mmol/L,及(或)已确诊为糖尿病并治疗者;(3)高血压:血压 ≥140/90 mmHg,及(或)已确认为高血压并治疗者;(4)血脂紊乱:空腹血甘油三酯(TG)≥1.7 mmol/L,及(或)空腹血高密度脂蛋白(HDL)<0.9 mmol/L(男)或<1.0 mmol/L(女)。回顾性分析患者的横断面资料,了解MS及各代谢组分的组成如高血压、高血糖、超重和血脂紊乱的患病率。并将患者分为MS组及非MS组进行临床资料的比较,且进一步分析腹透患者发生MS的影响因素。
1.3 统计学方法应用SPSS 17.0统计软件进行数据分析,计量数据采用均数±标准差表示,计量资料比较采用t检验,计数资料的比较采用χ2检验,MS的独立危险因素分析用二分类Logistic回归分析,P<0.05认为差异有统计学意义。
2 结果
2.1 MS组与非MS组资料比较将代谢综合征与非代谢综合组患者的临床资料进行比较,两组患者在年龄、尿量、血尿酸(UA)及血磷(P)有统计学意义(均P<0.05),见表1。MS组尿量更少、年龄、P及UA更高。而两组间全段甲状旁腺素(iPTH)、白蛋白(Alb)、血钾(K)、血钠(Na)、血钙(Ca)、P、Fe等比较差异无统计学意义(P均>0.05),详见表1。MS组与非MS组在男女之间差异亦无统计学意义(χ2=0.183,P=0.669)。
表1 MS组与非MS组的临床和实验室资料比较Tab.1 Comparison of general information in MS group and non-MS group ±s

表1 MS组与非MS组的临床和实验室资料比较Tab.1 Comparison of general information in MS group and non-MS group ±s
注:iPTH=全段甲状旁腺激素,Alb=白蛋白,EF=心脏射血分数,Hb=血红蛋白,Scr=血肌酐,BUN=尿素,UA=尿酸,Ccr=内生肌酐清除率,eGFR=肾小球滤过率估计值,KT/V=透析充分性,D/P=腹透液尿素浓度/血尿素浓度,SBP=收缩压,DBP=舒张压,K=血钾,Na=血钠,Ca=血钙,Fe=血清铁,P=血磷
2.2 各代谢组成分中患病情况超重者20例(患病率19.2%),超重组与非超重组比较,年龄、HDL、P、Fe及BMI差异有统计学意义(P<0.05),尿量、K、Na、Ca、D/P、eGFR、KT/V、Hb、Scr、BUN、UA、TG、Ccr及FPG未见明显差异(P>0.05),见表2。超重组与非超重组男女之间差异亦无统计学意义(χ2=0.334,P=0.563)。
表2 超重组与正常组的临床和实验室资料比较Tab.2 Comparison of clinical and laboratory data in overweight group and normal group ±s
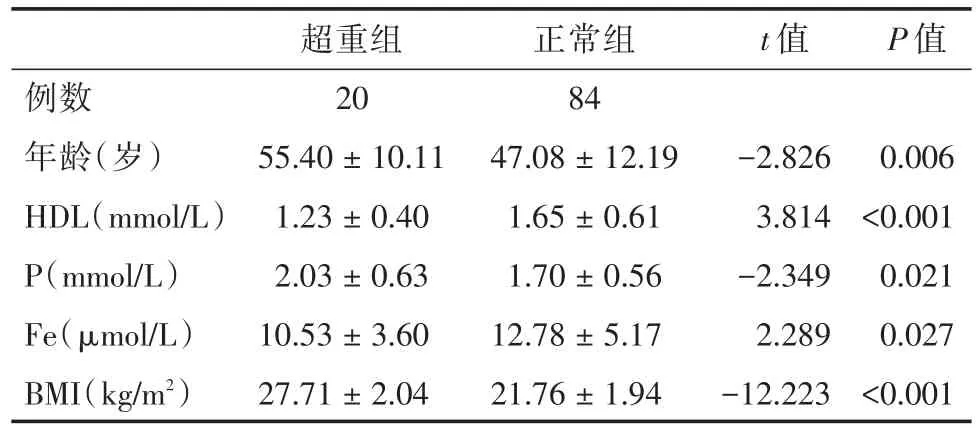
表2 超重组与正常组的临床和实验室资料比较Tab.2 Comparison of clinical and laboratory data in overweight group and normal group ±s
注:HDL=血清高密度脂蛋白,BMI=体质量指数
t值P值例数年龄(岁)HDL(mmol/L)P(mmol/L)Fe(μmol/L)BMI(kg/m2)超重组20 55.40±10.11 1.23±0.40 2.03±0.63 10.53±3.60 27.71±2.04正常组84 47.08±12.19 1.65±0.61 1.70±0.56 12.78±5.17 21.76±1.94-2.826 3.814-2.349 2.289-12.223 0.006<0.001 0.021 0.027<0.001
血脂紊乱者31例,患病率29.8%,血脂紊乱组与正常组比较,D/P、Alb、UA、BMI差异有统计学意义(P<0.05),尿量、K、Na、Ca、P、Fe、eGFR、KT/V、Hb、Scr、BUN、Ccr、EF及FPG未见明显差异(P>0.05),见表3。血脂紊乱组与正常组男女之间差异亦无统计学意义(χ2=2.633,P=0.105)。
表3 血脂紊乱组与正常组的临床和实验室资料比较Tab.3 Comparison of clinical and laboratory data in dyslipidemia group and normal group ±s

表3 血脂紊乱组与正常组的临床和实验室资料比较Tab.3 Comparison of clinical and laboratory data in dyslipidemia group and normal group ±s
注:Alb=白蛋白,BMI=体质量指数,UA=尿酸,D/P=腹透液尿素浓度/血尿素浓度
P值例数Alb(g/L)UA(μmol/L)D/P BMI(kg/m2)血脂紊乱组31 35.83±4.35 415.77±77.57 0.60±0.09 24.05±3.40正常组73 33.63±4.92 371.53±103.24 0.69±0.13 22.42±2.79 t值-2.162-2.138 4.296-2.552 0.033 0.035<0.001 0.012
高血糖者10例,患病率9.6%,Hb和DBP有统计学意义(P<0.05),尿量、K、Na、Ca、P、Fe、D/P、KT/V、eGFR、BUN、UA、Ccr、Scr、BMI、HDL 及 TG未见明显差异(P>0.05),见表4。高血糖组与正常组男女之间差异亦无统计学意义(χ2=0.976,P=0.323)。
2.3 影响因素分析多因素的二分类Logistic回归分析提示:年龄及血磷是腹透患者发生MS的独立危险因素(P<0.05)。
表4 高糖组与正常组的临床和实验室资料比较Tab.4 Comparison of clinical and laboratory data inhyperglycemia group and normal group ±s

表4 高糖组与正常组的临床和实验室资料比较Tab.4 Comparison of clinical and laboratory data inhyperglycemia group and normal group ±s
注:Hb=血红蛋白,DBP=舒张压
t值P值例数Hb(g/L)DBP(mmHg)高糖组10 108.06±19.25 81.10±6.26正常组94 86.09±18.75 87.61±13.45-3.513 2.686 0.001 0.018
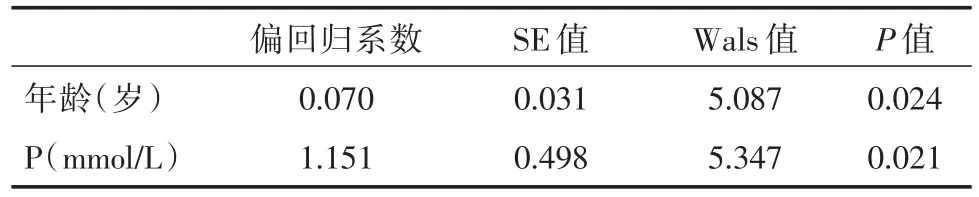
表5 多因素Logistic回归分析Tab.5 Multiariable Logistic regression analysis in metabolic syndrome
3 讨论
MS是一组代谢成分异常聚集的症候群:包括肥胖(尤其是中央型肥胖)、血脂紊乱(甘油三酯增高/高密度脂蛋白降低)、高血压、高血糖等动脉粥样硬化危险因子,其共同基础一般认为是胰岛素抵抗(IR)[6],是影响人类健康的重要的慢性非传染性疾病之一。在过去的数十年里,随着肥胖、糖尿病、高血压等慢性病发病率在全世界范围内的不断升高,代谢综合征的患者也逐年增多。在一般人群中的研究提示MS与心血管事件[7]、2型糖尿病及恶性肿瘤的发生密切相关[8]。研究还发现,代谢综合征可能通过胰岛素抵抗、高血压、血脂异常、激活炎症过程和促进氧化应激的产生,导致肾脏微血管病变,从而促进慢性肾脏病(CKD)进展,甚至可增加透析患者心血管疾病患病率和整体病死率。CKD患者尤其是ESRD患者合并MS的患病率较高,腹膜透析是ESRD患者的主要治疗手段之一,但与血液透析相比,一般腹透液的常见成分是葡萄糖,规律腹透后持续大量的葡萄糖被灌输到腹腔内被吸收,透析液带来的糖负荷[10]使得PD患者发生MS的风险更大。本研究提示PD患者中MS患病率为11.5%,较欧美国家(44%~50%)的调查结果低,可能与中国例口的肥胖患病率较欧美低、糖尿病是欧美国家ESRD的最主要病因及种族差异等因素有关。
年龄是公认的引起MS的重要危险因素。美国第三次国家营养与健康调查就提示年龄≥60岁的老年男性MS患病率比20~39岁的年轻男性升高了29.0%的患病率,≥60岁的老年女性MS患病率则比20~39岁的年轻女性升高了28.1%[11],HUH等[12]针对6 065例一般人群随访队列研究中发现,最终进展为MS的人群较其他人群具有高龄、高BMI、高血压等特点。在终末期肾病患者中的研究亦是如此,这些与本研究结果一致。与其他研究不同的是,本研究还发现血磷是MS的独立危险因素。钙磷代谢紊乱是ESRD患者常见的并发症,陈蓟等[13]研究发现,血清瘦素与血磷含量成正相关。血清瘦素水平与肥胖及高血压程度明显相关[14]。高瘦素血症已经被证实可促进胰岛素抵抗及诱发氧化应激[15],而这些因素都是MS发生的重要机制,故血磷可能通过影响血清瘦素从而促进MS发生。此外高血磷可以通过负反馈机制促进甲状旁腺激素(PTH)的分泌,而PTH浓度升高已有研究表明与MS的患病率呈正相关[16]。但本研究仅提示血磷是MS独立危险因素,而PTH并不是MS独立危险因素,可能与样本量偏少,或是因为本研究对象人群MS组(12例)和非MS组例数(92例)差异较大导致结果有一定偏移。
研究表明,尿酸水平与代谢综合征及其代谢组分均密切相关[17],尿酸可作为MS的一个重要危险因素[18]。高尿酸血症人群当中肥胖、高血压、高甘油三酯及高血糖的发生率均较普通人群增加,且随血尿酸增加,BMI和甘油三酯变化幅度最大[19]。其中,高尿酸引起高血压的可能机制为减少一氧化氮的合成,上调肾素,损伤肾小管及入球小动脉[20],尿酸对血压的影响在剔除相关混杂因素的情况下仍然可以独立存在[21]。而尿酸对血糖的影响机制可能为其影响了胰岛素分泌及代谢。鉴于尿酸与MS各组分的显著联系,甚至有学者认为尿酸应当作为MS的一个组分存在。
本研究的不足之处在于:仅为横断面研究,非队列研究,不能明确MS与ESRD及腹透预后的因果关系。此外,本研究未设立对照组(如健康人群、慢性肾脏病非透析患者)进行比较,且样本量偏小,故研究存在一定局限性,有待日后扩大样本量并进行队列分析研究来进一步证实研究结果。
综上,腹膜透析患者较易发生MS,合并MS的腹透患者表现为年龄偏大、血尿酸及血磷更高、尿量偏少等特点。其中,高龄、高血磷是腹透患者发生MS的独立影响因素。
[1]LO W K.Metabolic syndrome and obesity in peritoneal dialysis[J].Kidney research and clinical practice,2016,35(1):10-14.
[2]JOHNSON D W,ARMSTRONG K,CAMPBELL S B,et al.Metabolic syndrome in severe chronic kidney disease:prevalence,predictors,prognostic significance and effects of risk factor modification[J].Nephrology,2007,12(4):391-398.
[3]PARK J T,CHANG T I,KIM D K,et al.Metabolic syndrome predicts mortality in non-diabetic patients on continuous ambulatory peritoneal dialysis[J].Nephrol Dial Transplant,2010,25(2):599-604.
[4]TWARDOWSKI Z J,NOLPH K O,KHANNA R,et al.Peritoneal equilibration test[J].Peritoneal Dialysis International Journal of the International Society for Peritoneal Dialysis,1987,7(3):138-147.
[5]中华医学会糖尿病学分会代谢综合征研究协作组.中华医学会糖尿病学分会关于代谢综合征的建议[J].中华糖尿病杂志,2004,12(3):5-10.
[6]于方,左松芳.高尿酸血症与代谢综合征[J].中国疗养医学,2012,21(4):329-331.
[7]GREFFIN S,ANDRE M B,MATOS J P S,et al.Chronic kidney disease and metabolic syndrome as risk factors for cardiovascular disease in a primary care program [J].J Bras Nefrol,2017,39(3):246-252.
[8]CALLE E E,KAAKS R.Overweight,obesity and cancer:epidemiological evidence and proposed mechanisms[J].Nature reviews Cancer,2004,4(8):579-591.
[9]JOYCE T,CHIRINO Y I,NATALIA M T,et al.Renal damage in the metabolic syndrome(MetSx):Disorders implicated[J].Eur J Pharmacol,2017,818(5):54-68.
[10]JIANG N,QIAN J,LIN A,et al.Initiation of glucose-based peritoneal dialysis is associated with increased prevalence of metabolic syndrome in non-diabetic patients with end-stage renal disease[J].Blood purification,2008,26(5):423-428.
[11]FORD E S,GILES W H,MOKDAD A H.Increasing prevalence of the metabolic syndrome among u.s.Adults[J].Diabetes care,2004,27(10):2444-2449.
[12]HUH J H,YADAV D,KIM J S,et al.An association of metabolic syndrome and chronic kidney disease from a 10-year prospective cohort study[J].Metabolism:clinical and experimental,2017,67(1):54-61.
[13]陈蓟,肖德明,林博文,等.大鼠骨质疏松模型中血清瘦素与钙磷含量相关性研究[J].中国骨肿瘤骨病,2006,5(4):233-235,252.
[14]董华伟,申艳红,张雪娟.代谢综合征患者瘦素水平与肥胖及血压的关系[J].实用医学杂志,2010,26(1):78-79.
[15]林克宣,刘冠贤,石咏军.瘦素与肥胖相关性肾病研究进展[J].中国医学创新,2013,10(7):161-163.
[16]SAAB G,WHALEY-CONNELL A,BOMBECK A,et al.The Association between Parathyroid Hormone Levels and the Cardiorenal Metabolic Syndrome in Non-Diabetic Chronic Kidney Disease[J].Cardiorenal Med,2011,1(2):123-130.
[17]许衍甲,刘静,张琦,等.兰州地区不同尿酸水平与代谢综合征的患病率及其关系[J].实用医学杂志,2016,32(15):2556-2559.
[18]罗春华,杨绍玉,龚峰,等.宜昌市职业例群高尿酸血症流行病学调查及其与代谢综合征的相关性[J].实用医学杂志,2015,31(19):3250-3253.
[19]邵继红,沈霞,李东野,等.高尿酸血症与代谢综合征组分关系的研究[J].中华流行病学杂志,2007,28(2):180-183.
[20]PERLSTEIN T S,GUMIENIAK O,HOPKINS P N,et al.Uric acid and the state of the intrarenal renin-angiotensin system in humans[J].Kidney Int,2004,66(4):1465-1470.
[21]MELLEN P B,BLEYER A J,ERLINGER T P,et al.Serum uric acid predicts incident hypertension in a biethnic cohort:the atherosclerosis risk in communities study[J].Hypertension,2006,48(6):1037-1042.
