上调miR-493靶向E2F1抑制骨肉瘤细胞增殖及迁移
2018-05-10曹平
曹平
武汉科技大学天佑医院骨科(武汉430064)
骨肉瘤好发于儿童及青少年,致死率和复发率很高,常转移至肺部及胸膜[1]。深入研究骨肉瘤发病的分子机制对提高骨肉瘤基因治疗水平具有重要意义。miRNA是一类小分子非编码RNA,约18~24个碱基,由发夹结构的单链RNA前体经过Dicer酶加工合成,miRNA通过mRNA的3′端非编码区域结合而调控下游基因[2]。miRNA参与了骨肉瘤细胞增殖、周期、凋亡等多个生理过程。研究报道,miR-493 抑制肺癌[3]、肝癌[4]、胃癌[5]的增殖和侵袭转移过程。然而,miR-493对骨肉瘤细胞增殖迁移影响的机制不明确,本文通过荧光定量PCR分析方法确定了骨肉瘤组织与瘤旁组织miR-493表达量的差异,发现miR-493在骨肉瘤组织中表达量显著低于瘤旁组织,因此miR-493可能为抑癌基因,然后通过MTT及Transwell小室实验检测miR-493对骨肉瘤143B细胞增殖及侵袭能力的影响,并深入探讨其可能的分子机制,为临床应用提供可能的理论依据。
1 材料与方法
1.1 材料回顾性分析我科2010年1月至2016年6月收治的38例骨肉瘤患者的人骨肉瘤组织及瘤旁组织标本,所有标本从手术台上取下后立即转入液氮罐保存。涉及人体标本实验通过了我院伦理委员会审查后实施。人骨肉瘤细胞系143B、MG63、U2OS及人成骨细胞系hFOB1.19购自武汉大学细胞典藏中心,DMEM培养基、α-MEM、胎牛血清和胰蛋白酶等均购自武汉谷歌生物有限公司,Trizol购自美国Invitrogen公司,Lipofectamine2000转染专用试剂购自美国Invitrogen公司,实验室所用一抗均购自武汉三鹰生物有限公司,miR-493 mimic及其对照物均由广州锐博生物提供,细胞培养瓶、6孔板、24孔板、MTT试剂、DMSO、Transwell小室、结晶紫等耗材均购自武汉谷歌生物公司。
1.2 细胞培养、转染和分组人骨肉瘤细胞系采用DMEM培养基(含有10%胎牛血清和1%抗生素)培养,置于37℃、5%二氧化碳及饱和湿度的恒温培养箱中培养,细胞间和培养箱定期消毒。为研究miR-493过表达对143B细胞系增殖和迁移的作用,本实验将细胞系分为两组,miR-493 mimic转染组(miR-493组)和miR-493阴性对照组转染组(对照组),将细胞置于6孔板中培养,当细胞融合达到70%左右时进行转染,转染操作按照Lipofectamine 2000说明书进行,转染最终浓度为50 nmol,每孔液体体积为2 mL。
1.3 荧光定量PCR实验Trizol法提取组织或细胞总RNA,检测RNA浓度,然后按照TagMan RNA逆转录试剂盒(美国ABI公司)说明书进行逆转录,获得cDNA。采用SYBR Green PCR master mix试剂盒(日本TAKARA公司)进行qRT-PCR。miR-493正向引物;反向引物,采用2-ΔΔ方法进行定量分析,以U6作为内参,计算miR-493相对表达量。
1.4 MTT检测细胞增殖实验瞬时转染24 h后,将细胞以每孔3 000个细胞接种于96孔板中,每孔体积为100 μL,每组设置5个复孔,同时设置空白对照孔,培养24、48、72及96 h后采用MTT检测各组细胞增殖情况。去除培养基后,每孔中加入5 mg/L的MTT溶液,置于37℃下4 h后,弃掉培养基,每孔加入150 μL的DMSO孵育10 min,振荡器上微震荡15 min,使得结晶充分溶解于DMSO中,用空白对照孔进行调零操作,采用酶标仪检测各组的吸光度值(OD值),计算各组细胞增殖速率。本研究绘制的调零后各组吸光度值曲线。
1.5 Transwell小室迁移实验实验前先将小室在超净台中取出,加入100 μL培养基,置于培养箱中孵育10 min,使得聚碳酸酯膜亲水。细胞瞬时转染24 h后,胰蛋白酶消化,无血清的细胞培养及重悬细胞,制备成浓度为5×105/mL细胞悬浮液,每个小室中加入100 μL的细胞悬浮液,在下室中每孔加入500 μL的有血清培养基,置于细胞培养箱中培养12小室。取出小室,用棉签擦掉小室内部未穿过底膜的细胞,注意不要擦掉小室底部外面的细胞。用多聚甲醛固定15 min,弃掉甲醇溶液,晾干后置于0.1%结晶紫溶液中染色10 min,用双蒸水冲洗数次,空气中风干。显微镜下(×200)随机选取10个视野进行细胞计数。
1.6 Wentern blotting实验提取细胞总蛋白。配置SDS-PAGE分离胶和浓缩胶,加样,电泳,浓缩胶80 V电泳35 min,分离胶100 V电泳90 min,分离蛋白,注意设置marker蛋白。采用湿转发进行转膜,350 mA,转膜120 min,将蛋白转至PVDF膜上。然后进行免疫杂交操作。取出PVDF膜,用BSA封闭1 h,兔抗人一抗孵育过夜(4℃条件下),TBST系膜3次,每次5 min,二抗(山羊抗兔)孵育1 h,TBST洗膜,每次5 min,化学发光法显影,在暗室中进行曝光操作,扫描胶片上蛋白条带并用软件分析蛋白条带灰度值。
1.7 统计学方法采用SPSS 17.0进行软件统计,计量资料以±s表示,采用两独立样本t检验,计数资料(transwell小室实验跨膜细胞数目)采用卡方检验。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-493在骨肉瘤组织瘤旁组织表达差异荧光定量PCR检测结果表明,骨肉瘤组织中miR-493相对表达量显著低于瘤旁组织(P<0.05),表明miR-493可能起到抑癌基因的作用,见图1。
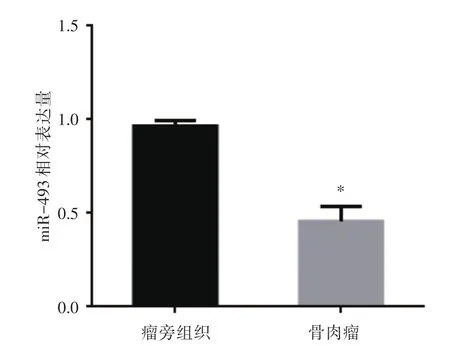
图1 miR-493在骨肉瘤组织及瘤旁组织的表达Fig.1 miR-493 expression osteosarcoma tissue and para tumor tissue
2.2 miR-493在骨肉瘤细胞系中表达差异本研究进一步采用荧光定量PCR法检测人骨肉瘤细胞系143B、MG63、U2OS及人成骨细胞系hFOB1.19中miR-493表达差异,结果表明3种骨肉瘤细胞系中miR-493相对表达量均低于人成骨细胞系hFOB1.19(P<0.05),进一步表明miR-493可能是抑癌基因。并且,骨肉瘤细胞系143B中miR-493的相对表达量最低,见图2。
2.3 上调miR-493抑制骨肉瘤143B细胞增殖为探讨miR-493对骨肉瘤生物学作用,本研究采用瞬时转染上调骨肉瘤细胞143B的miR-493,RT-PCR法检测结果表明,转染组143B的miR-493相对于对照组表达量为1.43±0.55,表明瞬时转染成功,采用MTT法检测miR-493组与对照组细胞增殖,结果表明,上调miR-493组细胞的24、48、72及96 h的细胞增殖能力低于对照组细胞(P<0.05),见图3。

图2 miR-493在骨肉瘤细胞系中表达差异Fig.2 miR-493 expression in osteosarcoma cell lines
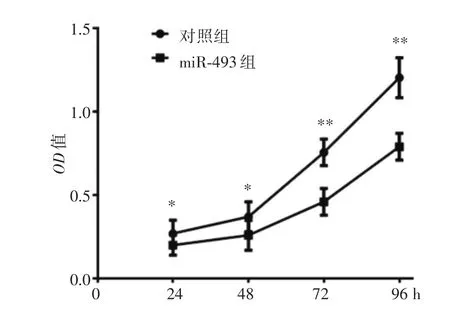
图3 miR-493抑制骨肉瘤143B细胞增殖Fig.3 miR-493 inhibits the proliferation of osteosarcoma 143B cells
2.4 上调miR-493抑制骨肉瘤细胞迁移能力本研究采用transwell法检测细胞迁移能力,与对照组相比,上调miR-493的细胞(miR-493组)跨膜细胞数目低于对照组(P<0.05),表明miR-493抑制了骨肉瘤细胞143B的迁移能力,见图4。
2.5 上调miR-493通过靶基因E2F1抑制143B细胞迁移为进一步探讨miR-493抑制骨肉瘤细胞增殖和迁移能力机制,本研究采用Targetscan在线miRNA靶基因预测软件分析,获得miR-493靶基因为转录因子E2F1,E2F1 mRAN 3′UTR与miR-493结合位点见图5A。采用Western blotting实验检测两组细胞基因表达,结果表明,miR-493上调组细胞E2F1基因及侵袭转移关键基因MMP-2、MMP-9蛋白表达量显著降低,见图5B。该实验结果表明,miR-493可能通过靶基因E2F1抑制143B细胞迁移能力。
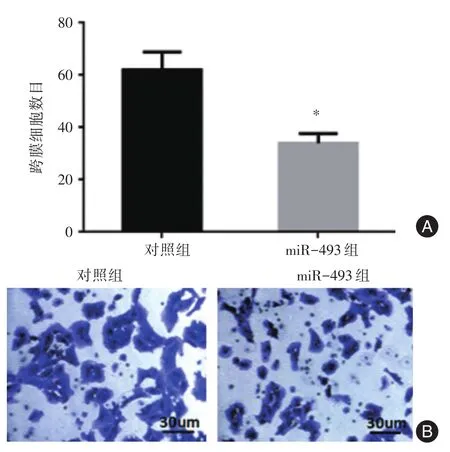
图4 miR-493抑制骨肉瘤细胞迁移能力Fig.4 miR-493 inhibition of osteosarcoma cell migration
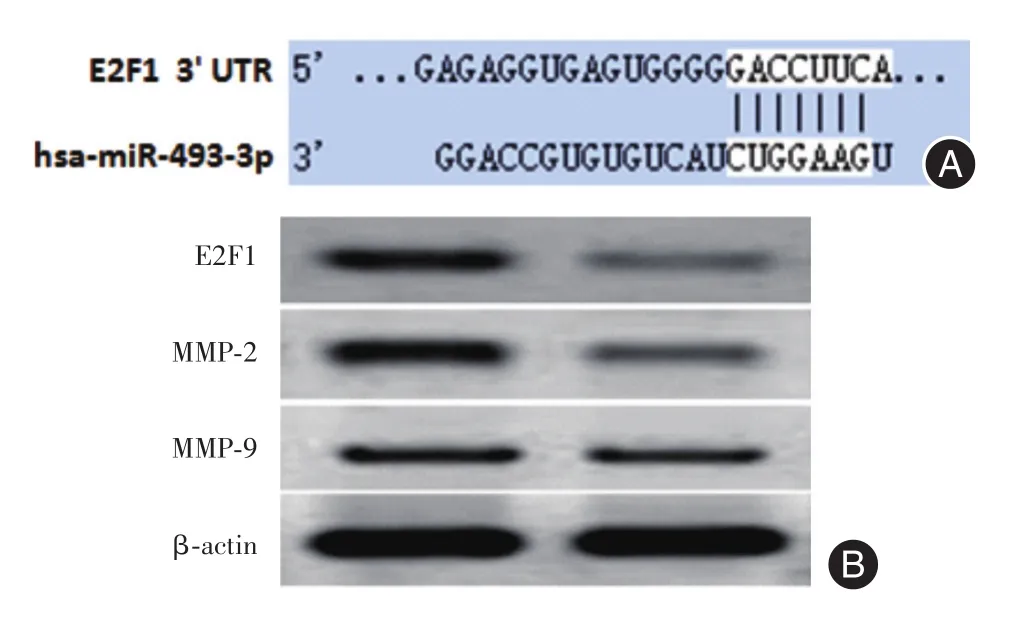
图5 上调miR-493通过靶基因E2F1抑制143B细胞迁移Fig.5 miR-493 inhibited migration of 143B cells through target gene E2F1
3 讨论
miRNA作为转录后调控系统中的重要调节基因,其重要性备受关注[6-8]。miRNA常定位于与恶性肿瘤相关的基因组区域和脆性位点,参与肿瘤发生、发展和侵袭转移[9]。本研究表明,miR-493在骨肉瘤组织和骨肉瘤细胞系中表达分别低于其相对照的瘤旁组织和人成骨细胞系,提示miR-493可能是抑癌的候选基因。实验进一步上调骨肉瘤细胞系143B的miR-493,结果显示miR-493抑制了骨肉瘤细胞增殖和迁移。
细胞迁移是骨肉瘤细胞发生局部侵袭扩增和远处转移的重要环节。本研究通过生物信息学在线软件分析得出,miR-493的可能靶基因为转录因子E2F1,且上调miR-493后,骨肉瘤细胞E2F1蛋白水平表达被抑制。转录因子E2F1是细胞周期相关转录因子E2F家族成员之一,同时在调控肿瘤侵袭转移中起着关键作用。WANG等[10]研究表明,下调E2F1可抑制骨肉瘤细胞侵袭转移及上皮间质转化,同时侵袭转移标志基因MMP-2和MMP-9被抑制,E2F1/DDR1/STAT3信号轴在骨肉瘤发生发展过程中起着关键作用。因此,下调E2F1基因能通过基质金属蛋白酶通路抑制骨肉瘤生物学活性,这与本实验结果一致。miRNA与E2F1调控关系密不可分,例如,李成等[11]发现微小RNA-329通过调控靶基因E2F1抑制人骨肉瘤U-2OS细胞增殖及分化,microR-29通过E2F1和E2F3抑制骨肉瘤U2OS 和 SAOS-2 细胞侵袭转移[12],miR-320[13]抑制骨肉瘤U2OS细胞增殖和周期进展,生物信息学分析结果显示其靶基因为E2F1。这些结果均支持本研究,miR-493下调了骨肉瘤细胞E2F1表达水平,从而达到抑制骨肉瘤增殖和侵袭转移。
此外,本研究显示miR-493还抑制了基质金属蛋白MMP-2和MMP-9表达。MMP-2和MMP-9是基质金属蛋白酶家族成员之一,参与肿瘤侵袭转移[14-17]。MMP-2和MMP-9与其他家族成员具有相似的蛋白空间结构,一般由5个功能不同的结构域组成,以保持酶原稳定性、催化活性等[14]。MMP-2和MMP-9可降解骨肉瘤细胞外基质成分,骨肉瘤细胞更加容易脱离原位肿瘤部位,进入血液循环系统从而向远处转移[18]。所以,miR-493抑制骨肉瘤侵袭转移的机制可能与下调MMP-2、MMP-9表达有关,但生物信息学分析并未预测到MMP-2、MMP-9作为miR-493的靶基因。笔者推测,miR-493可能通过下调E2F1基因表达,从而间接调节MMP-2和MMP-9,从而抑制骨肉瘤侵袭。
然而,本实验还存在不足之处。尽管生物信息学分析和蛋白实验均表明miR-493的靶基因可能是E2F1,但本研究缺乏双荧光素酶报告实验,因此不能明确验证miR-493是否直接作用于靶基因E2F1。因此,本课题下一步将深入研究miR-493的直接作用靶点,并在动物水平完成相关验证实验。
[1]郭梦瑶,王拥军,杨燕萍.现代医学治疗骨肉瘤现状分析及展望[J].实用医学杂志,2017,33(4):507-509.
[2]闵小春,伍婷婷,曾吉,等.miRNA-199a-3p调控MAP3K4在胃癌中的表达[J].实用医学杂志,2017,33(17):2817-2820.
[3]GU Y,ZHANG Z,YIN J,et al.Epigenetic silencing of miR-493 increases the resistance to cisplatin in lung cancer by targeting tongue cancer resistance-related protein 1(TCRP1)[J].J Exp Clin Cancer Res,2017,36(1):114.
[4]ZHAO J,XU T,WANG F,et al.miR-493-5p suppresses hepatocellular carcinoma cell proliferation through targeting GP73[J].Biomed Pharmacother,2017,90:744-751.
[5]JIA X,LI N,PENG C,et al.miR-493 mediated DKK1 down-regulation confers proliferation,invasion and chemo-resistance in gastric cancer cells[J].Oncotarget,2016,7(6):7044-7054.
[6]WANG M,XIE R,SI H,et al.Integrated bioinformatics analysis of miRNA expression in osteosarcoma[J].Artif Cells Nanomed Biotechnol,2017,45(5):936-943.
[7]DONG J,LIU Y,LIAO W,et al.miRNA-223 is a potential diagnostic and prognostic marker for osteosarcoma[J].J Bone Oncol,2016,5(2):74-79.
[8]DI FIORE R,DRAGO-FERRANTE R,PENTIMALLI F,et al.Let-7d miRNA shows both antioncogenic and oncogenic functions in osteosarcoma-derived 3AB-OS cancer stem cells[J].J Cell Physiol,2016,231(8):1832-1841.
[9]ZHANG W,HAN S,SUN K.Combined analysis of gene expression,miRNA expression and DNA methylation profiles of osteosarcoma[J].Oncol Rep,2017,37(2):1175-1181.
[10]WANG Z,SUN X,BAO Y,et al.E2F1 silencing inhibits migration and invasion of osteosarcoma cells via regulating DDR1 expression[J].Int J Oncol,2017,51(6):1639-1650.
[11]李成,梅英武,吴留源,等.微小RNA-329通过调控E2F1对人骨肉瘤U-2OS细胞增殖及分化的影响[J].中华实验外科杂志,2017,34(2):271-273.
[12]ZHANG W,QIAN J X,YI H L,et al.The microRNA-29 plays a central role in osteosarcoma pathogenesis and progression[J].Mol Biol(Mosk),2012,46(4):622-627.
[13]WU H,LI W,ZHANG M,et al.Inhibitory roles of miR-320 in osteosarcoma via regulating E2F1[J].J Cancer Res Ther,2016,12(Supple):68-71.
[14]CHENG G,GAO F,SUN X,et al.Paris saponin VII suppresses osteosarcoma cell migration and invasion by inhibiting MMP2/9 production via the p38 MAPK signaling pathway[J].Mol Med Rep,2016,14(4):3199-3205.
[15]KUNZ P,SAHR H,LEHNER B,et al.Elevated ratio of MMP2/MMP9 activity is associated with poor response to chemotherapy in osteosarcoma[J].BMC Cancer,2016,16:223.
[16]ZHANG Z,WANG F,LI Q,et al.CD151 knockdown inhibits osteosarcoma metastasis through the GSK-3beta/beta-catenin/MMP9 pathway[J].Oncol Rep,2016,35(3):1764-1770.
[17]卢善明,薛玲,邓汪东.基质金属蛋白酶-9对骨肉瘤细胞可溶性MICA蛋白形成的影响[J].实用医学杂志,2015,31(11):1741-1744.
[18]LIN H,HAO Y,ZHAO Z,et al.Sirtuin 6 contributes to migration and invasion of osteosarcoma cells via the ERK1/2/MMP9 pathway[J].FEBS Open Bio,2017,7(9):1291-1301.
