保元排毒丸对单侧输尿管梗阻大鼠肾脏Wnt/β-catenin信号通路的影响*
2018-05-10王身菊朱美凤郑宏香
王身菊,朱美凤,郑宏香,张 玲,陈 岱
(南京中医药大学附属常州市中医医院 常州 213000)
据流行病学调查结果[1]显示,我国年龄18岁以上的成人慢性肾脏病(CKD)的患病率为10.8%,据此估算中国现有CKD患者达到1.2亿。CKD的发病率和病死率逐年升高,目前CKD已成为全球急待解决的健康问题[2]。肾间质纤维化(Renal interstitial fibrosis RIF)的严重程度能判断肾功能受损害程度,对CKD的预后有决定性作用。延缓和防治肾纤维化是防治慢性肾脏病进展的关键。本课题组在以往的临床实践中,采用纯中药制剂保元排毒丸(保元排毒丸由生黄芪、黄精、生晒参、冬虫夏草、生大黄、六月雪、接骨木、丹参、陈皮、六神曲、木灵芝)治疗CKD患者,取得了较满意的临床疗效[3-5]。本实验通过制作UUO大鼠肾脏纤维化模型,观察保元排毒丸对UUO模型大鼠肾脏病理的影响及对Wnt/β-catenin信号转导通路的调控,以探讨保元排毒丸延缓肾纤维化的机理。
1 材料
1.1 实验动物
清洁级健康雄性SD大鼠48只,7-8周,体质量190±8 g,购自南京医科大学实验动物中心,动物生产许可证号码SCXK(苏):2016-0002。进食标准普通饲料,自由饮水,日常光照。适应性饲养3天后进入实验。
1.2 实验药品
保元排毒丸(药物批号160902)来源于南京中医药大学附属常州市中医医院制剂室。制作工艺:取生黄芪、黄精、生晒参、冬虫夏草、陈皮、黄精、六神曲、半量的生大黄共7味中药混合研成细粉过80-100目筛备用;另取丹参、六月雪、木灵芝、接骨木及半量生大黄及上述各药的粗粉共加水煎煮二次,第一次1.5 h,第二次1 h,合并滤液,静置,取上清液浓缩至相对密度为1.01以上备用。取上述粉末用浓缩液泛丸,丸粒制成梧桐子大小,整粒,60-80℃热风循环干燥即得。每丸重0.14 g,相当于生药含量0.38 g。厄贝沙坦(商品名:安博维),由赛诺菲杭州制药有限公司生产,规格150 mg/片。
1.3 主要试剂
苏木素-伊红染液(武汉谷歌生物科技有限公司货号G1005)、Masson染色试剂盒(武汉谷歌生物科技有限公司 货号G1006),DAB显色试剂盒(DAKO);TRIS(Solarbio T8060),Trizol Reagent、BCA蛋白定量检测试剂盒及SDS-PAGE凝胶制备试剂盒(武汉塞维尔生物科技有限公司),兔源性E-cadherin抗体(三鹰公司,货号20874-1-AP),兔源性Ⅰ型胶原抗体(三鹰公司,货号14695-1-AP),兔源性β-catenin抗体(servicebio,GB11015);兔源性β-actin(servicebio GB13001-1)。引物设计合成(武汉擎科创新生物科技有限公司),Revert Aid First Strand cDNA Synthesis Kit(Thermo K1622)、Fast Start Universal SYBR Green Master(Rox)(Roche 04 913 914 001)、HyPure TMMolecular Biology Grade Water(HyClone SH30538.02)。
1.4 主要仪器
JJ-12J型脱水机、JB-P5包埋机(武汉俊杰电子有限公司)、烤箱、RM2016病理切片机(上海徕卡仪器有限公司)、Nikon Eclipse CI正置光学显微镜。752-P紫外分光光度计(上海现科仪器有限公司)、neofuge 15R冷冻离心机(heal force)、DYY-6C电泳仪(北京六一仪器厂)、alphaEaseFC灰度分析软件(Alpha Innotech)、Stepone plus荧光定量PCR仪(ABI)、多样品研磨珠均质仪(Omni)。
2 方法
2.1 分组及UUO大鼠模型建立
48只清洁级健康雄性SD大鼠,按随机数字表随机分六组:假手术组、UUO组、厄贝沙坦组和保元排毒丸低、中、高剂量组,每组8只。除假手术组外,其余各组均按文献[6]方法造模。以3%戊巴比妥钠,按照0.2mL/100g腹腔注射麻醉,麻醉成功后,固定大鼠,剃去右背部毛发,暴露皮肤,聚维酮碘消毒皮肤3遍,铺无菌手术巾。在距脊柱约1-1.5 cm,肋缘下做长约1-1.5 cm纵行切口,逐层剥离皮下筋膜,切开肌肉,暴露出肾盂及输尿管,玻璃分针分离出右输尿管,近肾盂处结扎输尿管两次,从两结扎中间剪断输尿管,后逐层缝合,关闭腹腔,以聚维酮碘消毒皮肤切口,用无菌敷料覆盖包扎。假手术组只分离右输尿管,不结扎,然后逐层缝合。
2.2 给药
将保元排毒丸溶于蒸馏水中,分别配成浓度为25%、12.5%、6.25%的溶液,放置冰箱冷藏以备用。造模第2天开始给药,共灌胃14天。保元排毒丸低、中、高剂量组分别给予保元排毒丸1.25g·kg-1/天、2.5g·kg-1/天、5.0g·kg-1/天;厄贝沙坦组:给予厄贝沙坦12.5g·kg-1/天;假手术组和UUO组给予自由进食及等容积生理盐水灌胃。大鼠给药剂量参照文献[7],低剂量设为平均临床等效剂量,中、高剂量分别相当于平均临床等效剂量的2倍和4倍。
2.3 观察指标及检测方法
2.3.1 肾组织病理
于末次灌胃禁食不禁水24 h后按前法麻醉取右肾,剔除包膜,用无菌纱布吸干水份,电子天平称取右侧肾脏湿重后,纵切一半右肾置于4%多聚甲醛中固定;右肾另一半分装于EPP管中于-80℃保存,待进一步检测。固定24 h后,常规脱水、透明、浸蜡、包埋,切4.0 μm薄片。按试剂盒方法进行HE、Masson染色,显微镜下观察肾脏病理学改变。HE染色肾小管间质损伤按Banff分级进行0-3级半定量计分。记录连续不重叠的10个200倍视野的数值,取其平均值比较每例切片的肾小管间质区域病变的程度。Masson染色半定量统计肾间质纤维化情况。在光学显微镜200倍高倍镜下连续观察每张切片不重叠的10个视野,计算出每个视野下肾间质苯胺蓝染色面积占整个视野的比例,记录每张切片的数值后取其平均值来比较各组肾间质纤维化情况。
2.3.2 Western Blot法测肾组织E-cadherin、Collagen I、β-Catenin表达水平
取保存于-80℃的肾组织,用冷PBS洗涤2-3次,去除血污,剪成小块置于匀浆器,加入适量裂解液后冰上彻底匀浆。1 500 g离心10 min,收集上清,即为总蛋白溶液,BCA法测蛋白浓度。每上样孔加4 μg总蛋白行10%SDS-PAGE胶电泳。湿转法电转移至PVDF膜,用封闭液封闭1-2 h后,各组分别加入适当稀释后的 E-cadherin(1∶2000)、Collagen I(1∶1 000)、β-Catenin(1∶1 000)抗体4℃过夜。辣根过氧化物酶(HRP)标记的二抗用TBST稀释3 000倍,室温孵育30 min后,用TBST在室温下脱色摇床上洗三次,每次5 min,化学发光剂ECL反应5 min,曝光,扫描蛋白条带,将胶片进行扫描存档,PhotoShop整理去色,Alpha软件处理系统分析以所测得的各指标吸光度与内参照β-actin吸光度的比值代表定量值。
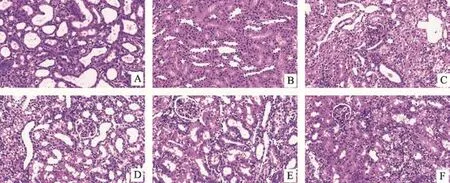
图1 各组大鼠肾组织HE染色(×200)
2.3.3 Real-time PCR检测Wnt4、β-catenin mRNA表达
Wnt4、β-catenin的引物设计合成由武汉擎科创新生物科技有限公司完成。引物序列:WNT4:正义链5′-GGA AGG TGG TGA CAC AAG GGA-3′,反义链5′-CAT AGG CGA TGT TGT CCG AGC-3′,片段长度189 bp。β-catenin:正义链 5′-TGG TGA AAA TGC TTG GGT CG-3′,反义链5′-TCT GAA GGC AGT CTG TCG TAA TAG-3′片段长度189 bp。内参GAPDH:正义链5′-TTC CTA CCC CCA ATG TAT CCG-3′,反义链5′-CATGAGGTCCACCACCCTGTT-3′,片段长度281bp。
提取大鼠肾组织总RNA、应用微量核酸分光光度计检测总RNA的浓度和纯度;以20 μL为体系进行cDNA第一链的合成,采用荧光定量PCR仪,以25 μL为反应体系进行PCR扩增,取0.2 mL PCR管,配制如下反应体系(每个反转录产物配制3管):2×qPCR Mix12.5 μL、7.5 μM基因引物2.0 μL、反转录产物2.5 μL、dH2O8.0μL。PCR扩增:预变性95℃,10min;循环(40次)95℃,15 s→60℃,60 s;溶解曲线75℃→95℃,每20 s升温1℃。反应完成后,采用2-△△CT计算法进行数据统计分析。
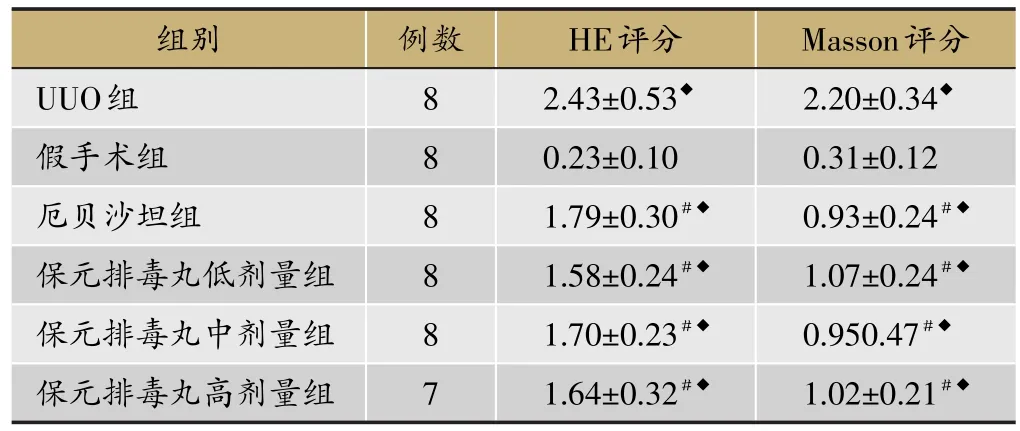
表1 各组对肾脏病理的影响(HE和Masson评分)
2.4 统计学分析
采用spss17.0统计软件进行统计分析。计量资料用均数±标准差表示(sd),组间均数比较采用t检验,多组间比较采用单因素方差分析,P值小于或等于0.05将被认为差异有统计学意义。
3 结果
保元排毒丸高剂量组在造模过程中因麻醉而死亡一只。
3.1 肾组织HE染色和Masson染色
HE染色:UUO组见大部分肾小管管腔扩张明显,部分可见有蛋白或细胞管型,肾间质弥漫性炎性细胞浸润,部分肾小管萎缩或塌陷,部分肾小管上皮细胞脱落、溶解。保元排毒丸低、中、高剂量组和厄贝沙坦组肾小管轻度扩张,肾小管上皮细胞结构较完整,间质炎细胞浸润比UUO组减少(P<0.01)。厄贝沙坦组与保元排毒丸各剂量组的病理变化大致相当(见图1、表1)。
Masson染色见假手术组肾小管间质、肾小球基底膜、系膜区无明显胶原沉积,UUO组见增宽的间质有较多蓝紫色条索状胶原,保元排毒丸各剂量组和厄贝沙坦组蓝紫色胶原沉积明显少于UUO组(P<0.01)(计结果见图2、表1)。
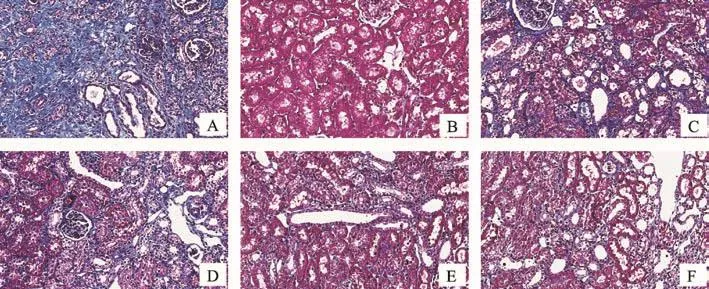
图2 各组大鼠肾组织Msson染色(×200)
3.2 肾组织E-cadherin、Collagen I、β-Catenin表达水平
如图3、表2所示,与假手术组比较,UUO组E-cadherin表达均明显减少(P<0.01),与UUO组比较,保元排毒丸低、中、高剂量组和厄贝沙坦组E-cadherin的表达增强(P<0.01);与假手术组比较,UUO组Collagen I、β-Catenin表达显著升高(P<0.01);保元排毒丸低、中、高剂量组和厄贝沙坦组Collagen I、β-Catenin表达明显少于UUO组(P<0.01)。
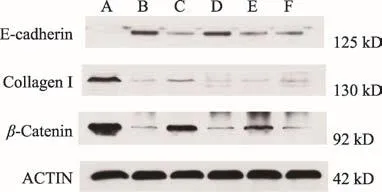
图3 各组肾组织E-cadherin、Collagen I、β-Catenin蛋白的表达
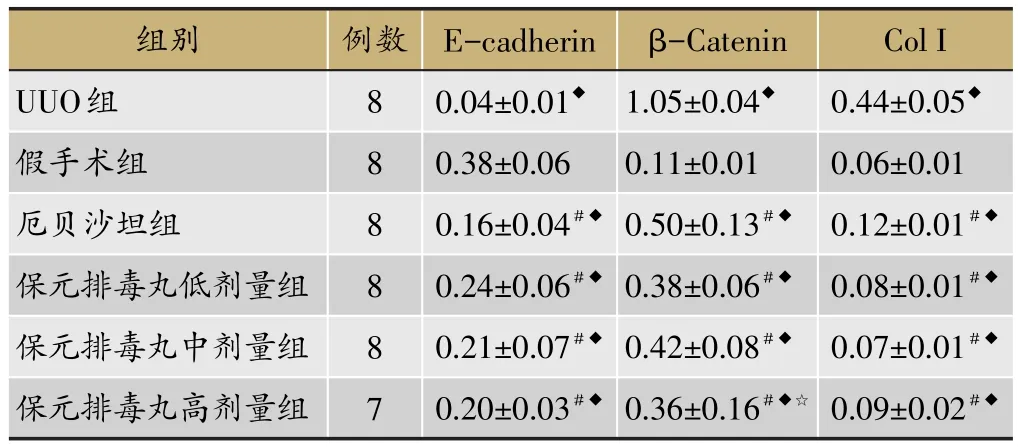
表2 各组E-cadherin、Collagen I、β-Catenin蛋白结果比较
3.3 Real-time PCR检测Wnt4、β-catenin mRNA表达
如表3所示,与假手术组比较,UUO组和各给药组Wnt4、β-catenin表达均明显升高(P<0.01);与UUO组比较,各给药组Wnt4、β-catenin mRNA表达明显低于UUO 组(P<0.05,P<0.01),保元排毒丸低剂量组Wnt4的表达低于厄贝沙坦(P<0.05)。

表3 各组对大鼠Wnt4、β-catenin mRNA的表达
4 讨论
肾间质纤维化(renal interstitial fibrosis,RIF)主要表现为成纤维细胞的增多及胶原、纤维连接蛋白、层粘连蛋白等细胞外基质的沉积[8]。RIF的发生发展受转化生长因子、结缔组织生长因子等细胞因子和TGF-β/smad、Wnt/β-catenin等信号通路的调控,其中,Wnt/βcatenin信号通路在促进RIF的发生发展中发挥重要的作用。
正常情况机体肾脏Wnt信号是沉默的[9]。当βcatenin在细胞核内蓄积时,能激活Wnt信号通路,启动靶基因转录,导致细胞增生、侵袭和转移。β-catenin是Wnt/β-catenin信号通路关键的信号转导分子,是该信号通路激活的标志[10]。Surendran等[11]发现UUO模型中Wnt4在集合管中有表达,肾小管上皮细胞胞浆中βcatenin表达增高。He等[12]证实UUO模型小鼠肾脏Wnt/β-catenin信号活性明显增强,Wnt/β-catenin信号通路的激活可促进肾纤维化。Villa等[13]表示,在UUO模型中,抑制β-catenin信号通路可减少肾脏纤维化。He等[14]发现抑制Wnt/β-catenin信号通路可以减少阿霉素肾病小鼠蛋白尿,抑制肾损伤和肾纤维化,均证实了Wnt信号通路在肾间质纤维化中发挥了重要作用。故本实验通过UUO模型大鼠观察保元排毒丸对Wnt4、β-catenin表达的影响。肾间质纤维化的主要成分是Ⅰ型胶原(collagensⅠ,ColⅠ)和Ⅲ型胶原(collagensⅢ,ColⅢ),其mRNA能合理地评估胶原的合成[15],本实验选用Ⅰ型胶原的蛋白表达反映肾间质纤维化的程度。
保元排毒丸是全国名老中医张志坚教授治疗CKD及肾纤维化的经验方。张老将肾纤维化的病机归纳为“虚”、“湿”、“瘀”三个方面,肾元亏虚是肾纤维化始动原因,湿热、湿浊贯穿整过病程中、久病致瘀,浊聚成毒,病机关键是“肾元亏虚、湿浊毒瘀”,故治疗以补益肾元、祛湿化瘀、泄浊排毒为法。保元排毒丸据此病机治法研制而成,由生黄芪、黄精、生晒参、冬虫夏草、接骨木、生大黄、六月雪、丹参、陈皮、六神曲、木灵芝组成,为常州市中医医院使用了三十余年的治疗CKD的专科制剂,临床疗效可靠[3-5]。方中生黄芪甘温益气健脾、补肺固表、利水消肿;黄精甘平,归肺、脾、肾三经,补肾润肺健脾;生晒参,大补元气、补脾生津;冬虫夏草甘温益气,益肾补肺,金水同补;四药共奏补益肾元之功,治病之本。接骨木甘苦平,祛风利湿、活血化瘀;六月雪性平偏凉,活血化瘀、通经利水、清热解毒、利湿泄浊;生大黄苦寒泻下、荡涤肠胃、解毒化瘀、降泄浊邪;丹参,苦寒活血祛瘀;四药共奏祛湿化瘀、泄浊排毒之功,治病之标。陈皮,补气健脾、和胃止呕;六神曲,消食和胃;木灵芝益气养心安神。诸药相伍,补益肾元、祛湿化瘀、泄浊排毒。纵观全方补泄共施、升降相伍、清消并用,使清得以升,浊得以降,湿得以祛,毒得以解,从而气机通顺,三焦畅达。
本实验HE染色UUO组见大部分肾小管管腔扩张明显、部分可见有蛋白或细胞管型、肾间质弥漫性炎性细胞浸润、肾小管萎缩或塌陷、部分肾小管上皮细胞脱落、溶解;Masson染色见UUO组见增宽的间质有较多蓝紫色条索状胶原。UUO组E-cadherin表达明显少于假手术组和保元排毒丸各剂量组(P<0.01),提示UUO组肾小管上皮的受损严重。UUO组ColⅠ的表达明显高于假手术组及保元排毒丸各剂量组,提示UUO组纤维化程度重,这说明造模成功。保元排毒丸各剂量组肾小管扩张程度轻、肾间质病变程度轻、肾间质纤维化程度轻,保元排毒丸各剂量组ColⅠ的表达明显低于UUO组(P<0.01),提示保元排毒丸有延缓肾纤维化的作用。
本实验用Western Blot法和Real-time PCR法均证实UUO组β-catenin表达均明显高于假手术组(P<0.01),UUO组Wnt4表达亦明显高于假手术组(P<0.01);说明在UUO模型大鼠中,Wnt4和β-catenin的表达增强,Wnt/β-catenin信号通路被激活,这与文献报道符合[16];经过保元排毒丸治疗Wnt4和β-catenin表达均低于UUO组(P<0.01),提示保元排毒丸能够下调Wnt4和β-catenin的表达,保元排毒丸可能通过抑制Wnt/β-catenin信号通路起到延缓肾纤维化的作用。
厄贝沙坦能减少肾小球细胞外基质蓄积,延缓肾小球硬化和肾间质纤维化的进展[17],可部分通过下调β-catenin/Snail的表达抑制UUO大鼠RIF[18]。本实验保元排毒丸各剂量组抑制肾纤维化与厄贝沙坦效果相似。本实验将保元排毒丸设计了低、中、高三个剂量组,低剂量相当于平均临床等效剂量,低、中、高剂量组未见明显剂量依赖性量效关系,有可能低剂量是最有效剂量。
综上所述,在UUO模型大鼠中Wnt4和β-catenin的表达增强,Wnt/β-catenin信号通路被激活,保元排毒丸可下调Wnt4和β-catenin的表达;保元排毒丸有延缓肾纤维化的作用,其机理可能是通过抑制Wnt/βcatenin信号通路起到延缓肾纤维化的作用。
1 张路霞,王海燕.中国慢性肾脏病的现状及挑战—来自中国慢性肾脏病流行病学调查的启示.中华内科杂志,2012,51(7):497-498.
2 Hoerger T J,Simpson S A,Yarnoff B O,et al.The future burden of CKD in the United States:a simulation model for the CDC CKD Initiative.Am J Kidney Dis,2015,65(3):403-411.
3 王身菊,朱美凤,邓祥军,等.保元排毒丸对维持性血液透析患者残余肾功能的影响.中成药,2016,38(1):46-49.
4 朱美凤,陈岱,王身菊.中西医结合延缓2~3期慢性肾脏病进展的临床研究.江苏中医药,2011,43(1):27-28.
5 陈岱,王身菊,张福产,等.保元排毒丸为主治疗糖尿病肾病临床观察.山东中医杂志,2004,23(12):731-732.
6 张均田,杜冠华主编《现代药理试验方法(下册)》.北京:中国协和医科大学出版社,2012,07:2007.
7 黄继汉,黄晓晖,陈志扬,等.药理实验中动物间和动物与人体间的等效剂量换算.中国临床药理学与治疗学,2004,9(9):1069-1072.
8 Liu Y.Cellular and molecular mechanisms of renal fibrosis.Nat Rev Nephrol,2011,7:684-696.
9 He X.Cilia put a brake on Wnt signaling.Nat Cell Biol,2008,10(1):11-13.
10 Xiao L,Wang M,Yang S,et al.A glimpse of the pathogenetic mechanisms of Wnt/β-catenin signaling in diabetic nephropathy.Biomed Res Int,2013,2013:987064.
11 Surendran K,Schiavi S,Hruska K A.Wnt-dependent β-catenin signaling is activated after unilater alureteral obstruction and recombinant secreted frizzled-related protein4 alters the progression of renal fibrosis.J Am Soc Nephrol,2005,16(8):2373-2384.
12 He W,Dai C,Li Y,et al.Wnt/beta-catenin signaling promotes renal interstitial fibrosis.J Am Soc Nephrol,2009,20(4):765-776.
13 Villa L,Boor P,Konieczny A,et al.Effects and mechanisms of angiotensin II receptor blockade with telmisartan in a normotensive model of mesangioproliferative nephritis.Nephrol Dial Transplant,2011,26(10):3131-3143.
14 He W,Kang Y S,Dai C,et al.Blockade of Wnt/beta-catenin signaling by paricalcitol ameliorates proteinuria and kidney injury.J Am Soc Nephrol,2011,22(1):90-103.
15 Eddy A A,López-Guisa J M,Okamura D M,et al.Investigating mechanisms of chronic kidney disease in mouse models.Pediatr Nephrol,2012,27(8):1233-1247.
16付旭,李均,阳小敏,等.黄芪丹参颗粒药对干预肾纤维化Wnt/βcatenin信号通路的实验研究.世界科学技术-中医药现代化,2014,16(1):103-108.
17 Meier P,Maillard M P,Meier J R,et a1.Combining blockers of the renin-angiotensin system or increasing the dose of an angiotensin II receptor antagonist in proteinuric patients:a randomized triple crossover study.J Hypertens,2011,29:1228-1235.
18孙蔚楠,阎磊,邵凤民.厄贝沙坦对单侧输尿管梗阻大鼠肾间质纤维化的抑制作用.中华实用诊断与治疗杂志,2015,29(12):1157-1159.
