不同脏腑虚损慢性阻塞性肺疾病稳定期患者骨骼肌含量的研究*
2018-05-10闫雪娇李风森
闫雪娇,李风森,徐 丹,荆 晶,金 晶,3
(1.新疆医科大学中医学院 乌鲁木齐 830011;2.新疆医科大学附属中医医院国家中医临床研究基地 乌鲁木齐 830000;3.新疆医科大学第一附属医院 乌鲁木齐 830011)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续呼吸症状和气流受限为特征的可预防和治疗的疾病,慢阻肺患者除呼吸困难、咳嗽、咳痰等症状外,常合并其它慢性疾病[1],其中骨骼肌功能障碍(skeletal muscle dysfunction,SMD)作为慢阻肺死亡率的独立预测之一[2]在疾病早期部分患者即可发生肌肉含量减少[3],严重影响到患者运动能力、生活质量及预后[4]。近年来,对于慢阻肺患者SMD的发生机制已有大量研究,而中医对该病的发生并未阐明。本研究将从不同脏腑虚损的角度观察慢阻肺稳定期患者骨骼肌含量及骨骼肌功能障碍的发生情况,为中医治疗慢阻肺及改善患者症状提供参考。
1 材料与方法
1.1 研究对象
收集在2017年4月至2017年10月间于新疆维吾尔自治区中医医院肺病科就诊的慢阻肺稳定期患者,共140例。
1.2 研究方法
研究方法采用横断面研究。
记录患者姓名、性别、年龄、双下肢乏力情况;进行肺功能测定及人体成分分析,记录肺功能及身高、体重、体质量指数(BMI)、体脂百分比、去脂质量指数(FFMI);
人体成分分析采用生物电阻抗法进行测量。严格测量患者身高,嘱患者测量前8小时内禁食并排空大小便,避免剧烈活动,以生物电阻抗仪(InBody 720)测的患者体重及体脂百分比,利用公式FFMI=体重(kg)×(1-体脂百分比)/身高的平方(m2)得出患者去脂质量指数。
1.3 纳入和排除标准
1.3.1 纳入标准
符合“Global Initiative for Chronic Obstructive Lung Disease(GOLD)2017版”慢性阻塞性肺病诊断标准及稳定期标准;符合慢阻肺稳定期中医脏腑虚损评定标准;入选年龄40-80岁。所有患者均已完成知情同意。
1.3.2 排除标准
慢阻肺急性期患者;合并其他呼吸系统疾病患者;合并严重心脑血管、肝肾和造血系统等原发性疾病患者;精神病患者及无法配合完成相关检查患者或有检查禁忌症患者。
1.4 骨骼肌功能障碍判断标准
骨骼肌功能障碍标准为:BMI≤21 kg·m-2,或男性FFMI≤16 kg·m-2,女性FFMI≤15 kg·m-2。
1.5 中医辨证分型标准
根据中华中医药学会制定的《中医内科常见疾病诊疗指南-中医病症部分(2008版)》肺胀(ZYYXH/T4-49-2008)和《慢性阻塞性肺疾病中医诊疗指南(2011版)》制定,常见以下三种证型。
肺气虚证:咳嗽或喘息、气短,动则加重;神疲、乏力,或自汗;恶风,易感冒;舌质淡、苔白,脉沉细或细弱。
肺脾气虚证:咳嗽或喘息、气短等肺气虚症状并伴有纳呆、食少或胃脘胀满、腹胀或便溏;舌胖大或有齿痕,苔薄白或白腻,脉沉细或沉缓或细弱。
肺肾气虚证:喘息,气短,动则加重等肺气虚症状并伴有腰膝酸软、耳鸣,头昏或面目虚浮,小便频数、夜尿多,或咳而遗溺;舌质淡、舌苔白,脉沉细或细弱。
1.6 统计学方法
使用SPSS 17.0统计软件,计量资料以均数(x)±标准差(s)表示,主要指标均进行正态性分析,组间比较采用方差分析。两组比较方差齐性采用T检验,方差不齐采取校正T检验。多组比较釆用单因素方差分析(One-Way ANOVA),方差齐时用LSD检验,方差不齐时用Dunnett's T3检验。检验水准:α=0.05。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
纳入对象共140例,其中男性92例,女性48例,年龄范围为49-80岁,平均年龄为67.96±8.07岁。3组间男女性别、年龄比差异无统计学意义(P>0.05)。
2.2 不同脏腑虚损COPD稳定期患者相关骨骼肌含量及SMD发生情况的比较
2.2.1 不同脏腑虚损COPD稳定期患者SMD发生情况的比较
如表1,3组患者发生SMD的构成比分别为:肺气虚组10.87%,肺脾气虚组54.76%,肺肾气虚30.77%。三组患者合并SMD情况有差异(P<0.0001)。
2.2.2 不同脏腑虚损COPD患者FFMI、骨骼肌含量比较
如表2,3组间比较,肺脾气虚组患者FFMI值及骨骼肌含量均较其余两组低(P<0.05),且该组患者双下肢肌肉含量明显低于其余两组(P<0.05)。肺气虚组与肺肾气虚组之间,上述指标无明显差异(P>0.05)
2.2.3 不同脏腑虚损COPD患者双下肢肌肉含量低合并骨骼肌障碍比较分析
如表3,3组中肺脾气虚组患者更易发生骨骼肌功能障碍并且伴有双下肢骨骼肌含量降低(P<0.05)。肺气虚组与肺肾气虚组之间未见明显差异(P>0.05)。
2.2.4 2.2不同脏腑虚损COPD稳定期患者六分钟步行试验比较
如表4所示,3组COPD稳定期患者六分钟步行距离无明显差异(P>0.05)。但肺脾气虚组患者平均步行距离较其余两组稍少。
3 讨论
慢阻肺患者SMD的发生与长期慢性炎症及缺氧、氧化应激、蛋白合成/分解失衡、线粒体功能障碍、细胞自噬、营养不良、维生素D缺乏等原因有关,使骨骼肌纤维改变,氧化代谢减弱[5],蛋白降解增加[6]。有研究发现慢阻肺患者骨骼肌功能障碍发生率在24%-70%[7],而前期课题组发现慢阻肺患者的肺功能情况受不同脏腑虚损类型的影响[8],因此,不同脏腑虚损类型对慢阻肺患者的骨骼肌功能障碍的发生是否有影响值得探讨。
本研究所有纳入对象中,3组均出现数量不等的合并骨骼肌功能障碍患者共44例,占总人数的31.43%。其中肺脾气虚患者发生骨骼肌功能障碍23例,占52.27%;肺肾气虚组16例,占36.37;肺气虚组5例,占11.36%。就研究结果而言,不同脏腑虚损类型中肺脾气虚证慢阻肺稳定期患者骨骼肌含量较其余两个证型有所减少,SMD发生的可能性也较其余两个证型偏高。
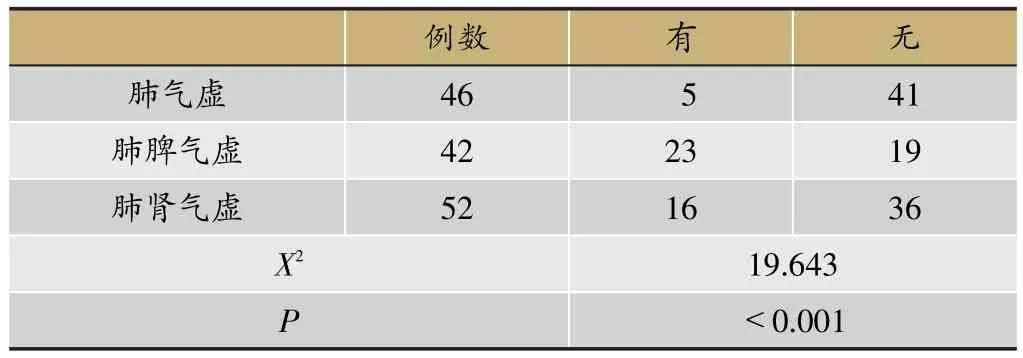
表1 不同脏腑虚损COPD稳定期患者SMD发生情况的比较
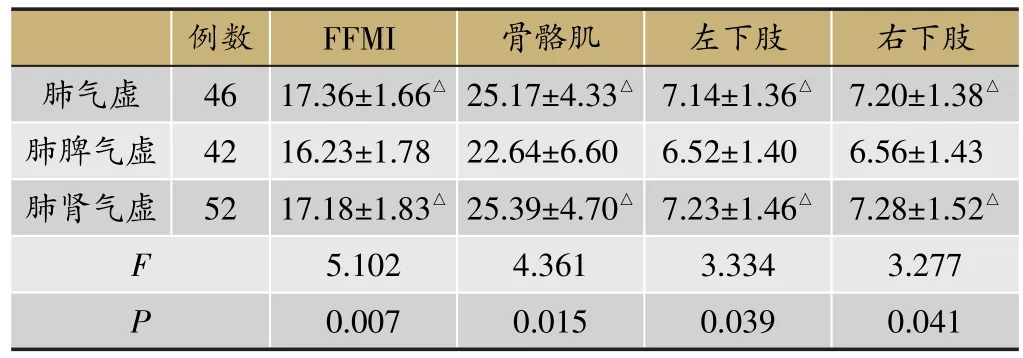
表2 不同脏腑虚损COPD患者FFMI、骨骼肌含量比较
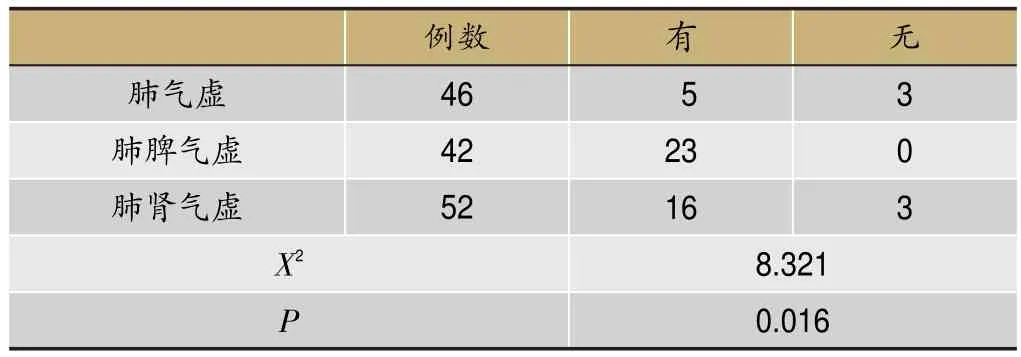
表3 不同脏腑虚损COPD患者双下肢肌肉含量低合并骨骼肌障碍比较分析
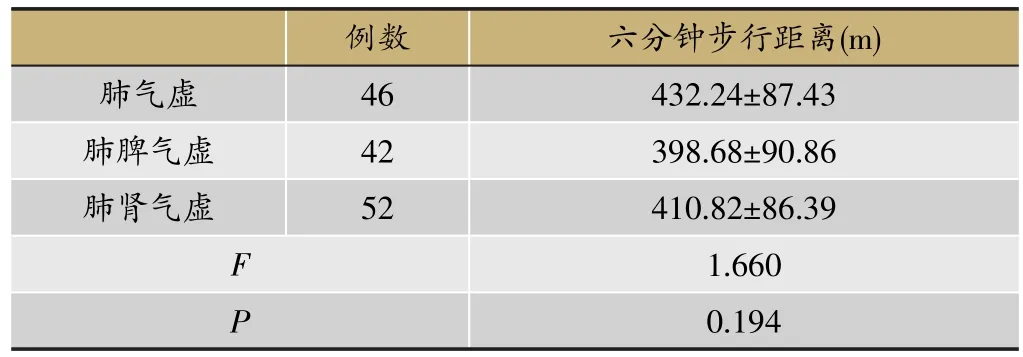
表4 不同脏腑虚损COPD患者六分钟步行距离的比较。
骨骼肌功能障碍属中医“痿症”、“痿蹩”等病症的范畴。《素问集注·五脏生成篇》云:“脾主运化水谷之精,以生养肌肉,故主肉。”中医认为,脾主肌肉、四肢,肺脾两经同属太阴,互为表里。慢阻肺患者“肺本虚,气为不足复为邪所乘,壅痞不能宣畅”(隋·巢元方《诸病源候论·咳逆短气候》)。肺气不足,卫外不固,易感外邪,邪郁于内,痰湿内生,阻碍气机;病久痰饮水停,子病及母则伤脾;或年老体弱,中气本虚,脾运不健,土不生金,肺气愈加不足。由此,肺虚不能通调水道,脾虚不能布散津液,运化失司,水谷精微无以荣养肌肉,则肌肉瘦削,甚或痿废。
本次研究发现SMD患者双下肢肌肉量均有减少,而肺气虚组和肺肾气虚组少数患者双下肢肌肉量已经有所减少而在体重和FFMI值上尚未体现,这部分患者随病程的增长是否会发展成SMD尚不清楚,双下肢肌肉量的减少能否提示骨骼肌功能障碍发生的可能,还需随访观察。这一现象是否与肺脏受损,失于输布,无以濡润营养经脉皮毛骨肉有关尚待讨论。此外,在之前的研究中发现,50.2%的患者易出现乏力症状[9],此次调查发现患者多为双下肢乏力,这一症状是否与患者下肢骨骼肌含量的改变有关尚待进一步论证。
然而,就六分钟步行试验结果而言,3组患者步行距离无明显差异,但平均步行距离:肺脾气虚组<肺肾气虚组<肺气虚组,平均步行距离有减少趋势,推测骨骼肌含量的减少可能对患者步行距离有影响,需要扩大样本量以验证该推测。
综上,推测慢阻肺患者不同脏腑虚损类型与患者骨骼肌含量减少及骨骼肌功能障碍的发生有关。目前尚无明确的治疗措施以防治慢阻肺患者骨骼肌功能障碍的发生,运动可改善骨骼肌功能,减缓骨骼肌萎缩[10]。针对有脾虚症状或伴有双下肢乏力的患者,运用健脾益气之法,补脾之不足,使阳明充盛,水谷精微运化输布改善,得以营养、充实肌肉,或可改善患者双下肢乏力症状,进而改善患者生活质量。
1 From the Global Strategy for the Diagnosis,Management and Prevention of COPD,Global Initiative for Chronic Obstructive Lung Disease(GOLD)2017.Available from:http://goldcopd.org.
2 Choudhury G,Rabinovich R,MacNee W.Comorbidities and systemic effects of chronic obstructive pulmonary disease.Clin Chest Med,2014,35(1):101-130
3 Kharbanda S,Ramakrishna A,Krishnan S.Prevalence of quadriceps muscle weakness in patients with COPD and its association with disease severity.Int J Chron Obstruct Pulmon Dis,2015,10:1727-1735.
4 Seymour J M,Spruit M A,Hopkinson N S,et al.The prevalence of quadriceps weakness in COPD and the relationship with disease severity.Eur Respir J,2010,36(1):81-88.
5 Maltais F,Decramer M,Casaburi R,et al.An official American Thoracic Society/European Respiratory Society statement:update on limb muscle dysfunction in chronic obstructive pulmonary disease.Am J Respir Crit Care Med,2014,189(9):e15-e62.
6 Puig-Vilanova E,Rodriguez D A,Lloreta J,et al.Oxidative stress,redox signaling pathways,and autophagy in cachectic muscles of male patients with advanced COPD and lung cancer.Free Radic Biol Med,2015,79:91-108.
7 Barnes P J,Celli B R.Systemic manifestations and contribution of COPD.Eur Respire J,2009,33:1165-1185.
8 孟驰,白文梅,李风森.慢性阻塞性肺病稳定期患者脏腑虚损程度与肺功能的相关性研究.临床医学研究与实践,2016,1(5):7.
9 徐丹,高振,荆晶,等.新疆410例慢性阻塞性肺疾病患者中医证型分布规律.中国实验方剂学杂志,2012,18(3):206-210.
10 Conlon J A,Newton R U,Tufano J J,et al.The efficacy of periodised resistance training on neuromuscular adaptation in older adults.Eur J Appl Physiol,2017.
