骆驼蓬碱对胃癌细胞增殖、凋亡的影响及其机制研究
2018-05-10蒋世烨金星星张文灵李晓林朱国琴周逸婵孙为豪南京医科大学第一附属医院老年消化科210029
张 婷 蒋世烨 金星星 张文灵 余 纳 李晓林 朱国琴 周逸婵 邵 耘 孙为豪南京医科大学第一附属医院老年消化科(210029)
胃癌是常见的消化系统恶性肿瘤,其发病率和死亡率在世界范围内居恶性肿瘤第四位和第二位[1]。我国是胃癌发病率最高的国家之一,胃癌已严重影响国人生命健康,是癌症相关死亡的主要原因。目前治疗胃癌最有效的方法是根治性手术和术后辅助化疗,然而手术治疗无法完全避免胃癌局部复发和远处转移的可能性,而传统化疗药物的不良反应则严重影响患者生活质量。因此寻找无毒或低毒的有效治疗药物对胃癌治疗具有重要意义。目前中草药及其提取物的抗癌作用越来越受到国内外学者的重视。骆驼蓬为蒺藜科植物骆驼蓬属多年生草本植物的全草,是维吾尔族传统医学使用已久的药材。骆驼蓬碱(harmine)是骆驼蓬中的有效单体化合物,具有抑制肿瘤细胞增殖、诱导细胞凋亡、抗肿瘤血管生成等作用,已成为近年肿瘤化学预防研究的热点[2-4]。本课题组前期研究[5]发现,骆驼蓬碱可通过下调环氧合酶-2(COX-2)表达抑制胃癌细胞增殖、迁移、侵袭,并诱导胃癌细胞凋亡,其具体分子机制尚未完全明确。
PTEN基因作为一种抑癌基因,在多种细胞内信号转导通路中发挥关键作用,可经由PI3K/Akt途径调控胃癌细胞增殖、分化、凋亡[6-7]。鼠双微体2(murine double minute 2,MDM2)是原癌基因mdm2的产物,可结合抑癌基因p53,并诱导其泛素化降解,进而对细胞周期阻滞、细胞凋亡以及DNA损伤修复等发挥调节作用。已有研究[8-9]证实MDM2与多种肿瘤,尤其是胃癌、结直肠癌等消化系统肿瘤的发生、发展密切相关。本研究旨在检测骆驼蓬碱对两种不同分化程度、COX-2高表达的人胃腺癌细胞株SGC-7901、MKN-45增殖和凋亡的影响,探讨PTEN/Akt/MDM2信号通路在该过程中的作用。
材料与方法
一、细胞株和主要试剂
人胃腺癌中分化细胞株SGC-7901购自中国科学院上海生命科学研究院细胞资源中心,人胃腺癌低分化细胞株MKN-45购自南京凯基生物科技发展有限公司。骆驼蓬碱、MTT(Sigma-Aldrich LLC.);Hoechst 33342(碧云天生物);COX-2、MDM2、磷酸化MDM2(p-MDM2)、GAPDH抗体和HRP标记的二抗(Abcam plc.);PTEN、Akt、磷酸化 Akt(p-Akt)抗体(Cell Signaling Technology,Inc.)。
二、方法
1.药物配制:骆驼蓬碱以DMSO溶解后加入RPMI-1640培养基稀释至所需浓度,DMSO终浓度不超过0.1%,以0.22 μm孔径滤膜过滤除菌后4℃保存备用。
2.细胞培养:SGC-7901和MKN-45细胞常规传代培养于含10%胎牛血清、100 kU/L青霉素和100 mg/L链霉素的RPMI-1640培养基中,于37℃、5%CO2、饱和湿度孵箱中培养生长,隔天换液,3 d传代一次。
3.MTT法检测细胞增殖活性:取对数生长期细胞,以0.25%胰酶消化,低速离心,收集细胞,制成浓度2×107/L的单细胞悬液,接种于96孔培养板(200 μL/孔),常规培养24 h至细胞贴壁,换无血清RPMI-1640培养基再培养24 h。以骆驼蓬碱(2、4、8、16、32 μg/mL)干预,并设置不予药物处理的对照组。培养 24 h、48 h、72 h 后,加入 20 μL MTT(5 g/L)继续培养 4 h,弃上清液,加入 150 μL DMSO终止反应。将96孔板移入平板震荡器,水平震荡10 min,使MTT充分溶解,于酶联免疫检测仪波长570 nm处测定吸光度(A)值,以未接种细胞、仅加入培养基的空白孔调零。实验独立重复3次,每组设4个复孔。细胞增殖抑制率(%)=(1-A实验组/A对照组) × 100%。
4.Hoechst染色检测细胞凋亡:取对数生长期细胞,制成1×105/L的单细胞悬液,接种于12孔培养板(2 mL/孔),常规培养24 h至细胞贴壁,弃培养基,以骆驼蓬碱(4、8、16 μg/mL)干预,并设置不予药物处理的对照组。培养48 h后,弃培养基,预冷PBS洗涤3次,预冷4%甲醛4℃固定10 min,PBS洗涤3次;加入DNA染料Hoechst 33342(5 mg/L),室温避光染色10 min,PBS洗涤3次。于倒置相差荧光显微镜下观察细胞核形态,拍照并保存成像记录。
5.细胞蛋白提取和蛋白质印迹法:取对数生长期细胞,以骆驼蓬碱(4、8、16 μg/mL)干预,并设置不予药物处理的对照组;培养48 h后,预冷PBS洗涤3次,加入100 μL细胞裂解液(Nonidet P-40 1%,脱氧胆酸钠 5 g/L,SDS 1 g/L,PMSF 0.1 g/L,抑肽酶10 mg/L),4℃裂解细胞1 h,11 000×g 4℃离心10 min,取上清,BCA法测定蛋白浓度。以等量蛋白行SDS-PAGE电泳后转印至 PVDF膜,室温封闭1 h,分别加入一抗(PTEN抗体、Akt抗体、p-Akt抗体、MDM2抗体、p-MDM2抗体、COX-2抗体和GAPDH 抗体,工作浓度分别为:1∶1 000、1∶1 000、1∶2 000、1∶2 000、1∶50 000、1∶1 000 和1∶10 000),4℃孵育过夜,加入HRP标记的二抗,室温孵育2 h。ECL发光,X线胶片感光,使用ImageJ图像分析软件对蛋白电泳条带灰度进行半定量分析。实验重复3次。
三、统计学分析
应用SPSS 22.0统计学软件,实验结果以¯x±s表示,两组间均数比较采用两独立样本t检验;多组间均数比较采用单因素方差分析,两两比较采用LSD法。药物浓度与细胞增殖抑制率关系的分析采用线性回归分析。P<0.05为差异有统计学意义。
结 果
一、骆驼蓬碱对SGC-7901、MKN-45细胞增殖的影响
MTT法检测显示,随着骆驼蓬碱浓度的增加和作用时间的延长,SGC-7901、MKN-45细胞增殖抑制率呈升高趋势,表明骆驼蓬碱可呈剂量和时间依赖性地抑制胃癌细胞增殖(图1)。
对骆驼蓬碱浓度(X)与细胞增殖抑制率(Y)进行一元线性回归分析,得到直线回归方程。骆驼蓬碱对SGC-7901细胞干预24 h、48 h和72 h的回归方程分别为:^Y=1.740 776X+2.713 328(R2=0.985,P <0.01);^Y=1.953 186X+13.334 820(R2=0.829,P <0.01);^Y=2.276 888X+14.559 218(R2=0.847,P<0.01)。骆驼蓬碱对MKN-45细胞干预24 h、48 h和72 h的回归方程分别为:^Y=2.157 440X+10.069 486(R2=0.892,P <0.01);^Y=2.638 137X+18.245 632(R2=0.796,P <0.01);^Y=2.559 371X+31.418 852(R2=0.680,P<0.01)。证实骆驼蓬碱对胃癌细胞的增殖抑制作用具有剂量依赖性。根据回归方程计算骆驼蓬碱对SGC-7901、MKN-45细胞干预24 h、48 h和72 h的50%抑制浓度(IC50),其值分别为(27.16±1.56)μg/mL和(18.51±0.68)μg/mL、(18.77±0.25) μg/mL 和(12.04±0.07) μg/mL、(15.56±0.37) μg/mL和(7.26±0.25) μg/mL。
二、骆驼蓬碱对SGC-7901、MKN-45细胞凋亡的影响
经骆驼蓬碱干预48 h后,SGC-7901、MKN-45细胞出现典型的凋亡形态学改变,荧光显微镜下可见细胞核浓聚深染,核内可见致密的颗粒状荧光,细胞核固缩形成凋亡小体,细胞膜和核膜完整(图2)。
三、骆驼蓬碱对 PTEN、COX-2表达以及 Akt、MDM2磷酸化的影响
蛋白质印迹法检测显示,骆驼蓬碱可呈剂量依赖性地上调SGC-7901、MKN-45细胞的PTEN表达(图3A),抑制 Akt、MDM2 磷酸化(图 3B、3C)以及COX-2表达(图3D)。
讨 论
COX-2是花生四烯酸合成前列腺素的限速酶。本课题组前期研究[5,10-12]发现,COX-2 在胃癌发生、发展中发挥重要作用,特异性COX-2抑制剂可有效抑制胃癌细胞增殖并诱导其凋亡,骆驼蓬碱可通过下调COX-2表达,抑制胃癌细胞增殖、迁移和侵袭。然而,骆驼蓬碱抑制COX-2表达的具体分子机制尚不明确。

图1 骆驼蓬碱干预对SGC-7901、MKN-45细胞增殖的影响(MTT法)

图2 骆驼蓬碱干预对SGC-7901、MKN-45细胞凋亡的影响(Hoechst染色,×100)
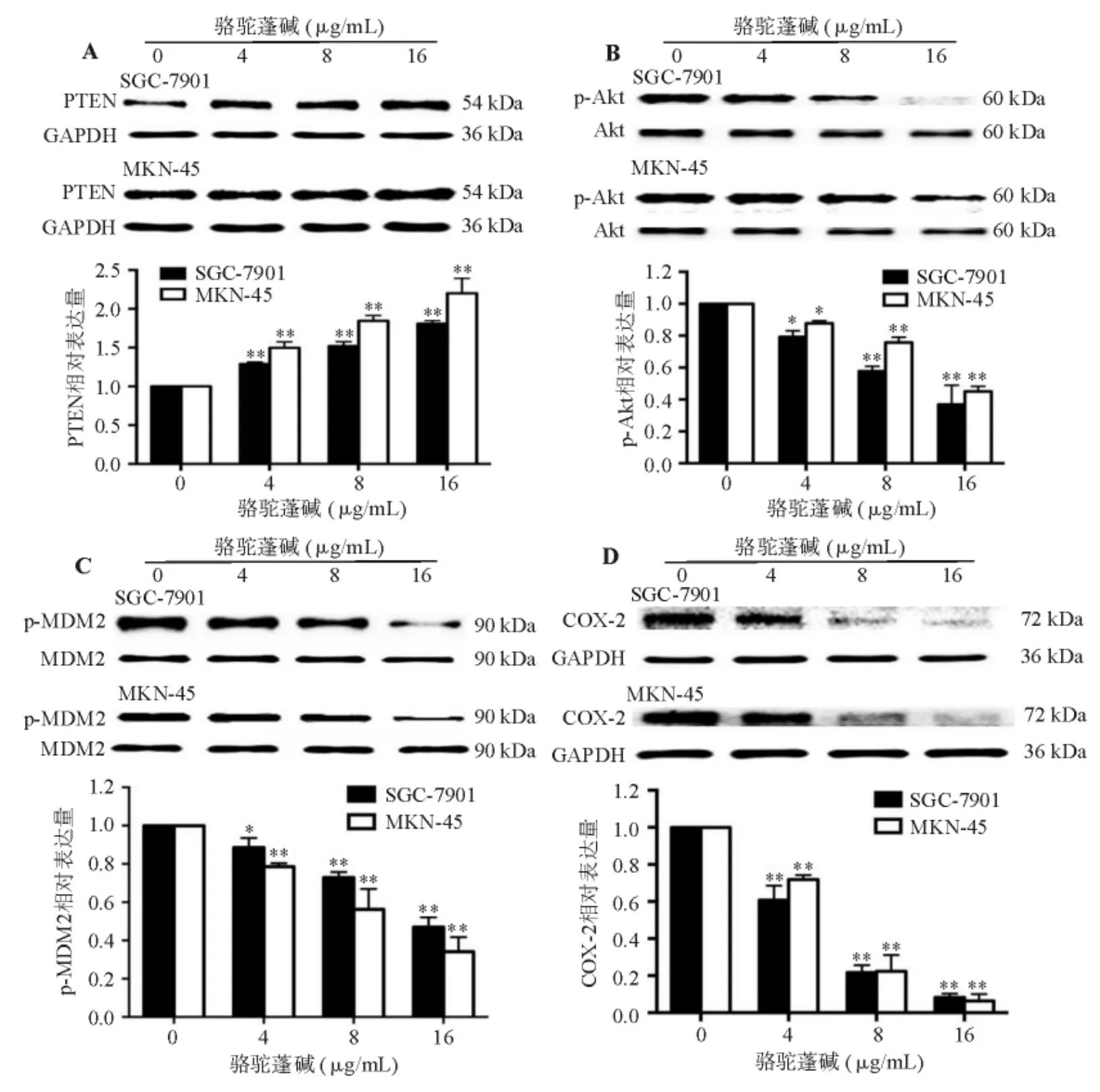
图3 骆驼蓬碱干预对SGC-7901、MKN-45细胞PTEN、COX-2表达以及Akt、MDM2磷酸化的影响(蛋白质印迹法)
本研究发现骆驼蓬碱可呈剂量依赖性地上调人胃腺癌细胞株SGC-7901、MKN-45 PTEN表达,抑制Akt、MDM2磷酸化以及COX-2表达,表明骆驼蓬碱抑制胃癌细胞COX-2表达以及胃癌进展的机制可能与PTEN/Akt/MDM2信号通路有关。PI3K/Akt信号通路可诱导MDM2表达,在肿瘤细胞内信号转导过程中发挥重要调节作用[13-14],而PTEN可通过调节PI3K/Akt信号通路调控胃癌细胞的分化、增殖[6-7]。本课题组前期研究[15]证实 PI3K/Akt信号通路活化后可促进COX-2表达,进而调控胃癌细胞增殖。Liu等[16]发现骆驼蓬碱可通过抑制Akt磷酸化,降低恶性胶质瘤细胞活力并诱导其凋亡。Kuo等[17]证实黄连素(berberine)可通过调节PI3K/Akt信号通路抑制乳腺癌细胞侵袭和转移。Dung等[18]发现地奥司明(diosmin)可通过阻断 PI3K/Akt/MDM2信号转导以及下调细胞周期调控蛋白表达,抑制肝癌细胞增殖和肿瘤生长。Proietti等[19]证实褪黑素(melatonin)可通过下调PI3K/Akt信号通路依赖的MDM2磷酸化,抑制乳腺癌细胞增殖并诱导其凋亡。Nag等[20]发现传统中药组分人参皂苷(ginsenosides)的抗肿瘤作用与其对PI3K/Akt/MDM2信号通路和COX-2表达的抑制作用有关。由此推测,骆驼蓬碱可能通过PTEN/Akt/MDM2信号通路下调COX-2表达,进而抑制胃癌细胞增殖并诱导其凋亡。然而该结论仍需进一步研究验证,如在各信号分子激动剂、抑制剂的作用下检测PTEN、COX-2表达以及Akt、MDM2磷酸化水平。此外,由于细胞内信号转导机制非常复杂,骆驼蓬碱对胃癌细胞COX-2表达的抑制作用可能还与其他信号通路以及不同信号通路间的交互作用(如cross-talk等)有关,欲全面了解其分子机制尚需进一步深入研究。
1 Mackenzie M,Spithoff K,Jonker D.Systemic therapy for advanced gastric cancer:a clinical practice guideline[J].Curr Oncol,2011,18(4):e202-e209.
2 Li S,Wang A,Gu F,et al.Novel harmine derivatives for tumor targeted therapy[J].Oncotarget,2015,6(11):8988-9001.
3 Bei YY,Yuan ZQ,Zhang L,et al.Novel self-assembled micelles based on palmitoyl-trimethyl-chitosan for efficient delivery of harmine to liver cancer[J].Expert Opin Drug Deliv,2014,11(6):843-854.
4 Dai F,Chen Y,Song Y,et al.A natural small molecule harmine inhibits angiogenesis and suppresses tumour growth through activation of p53 in endothelial cells[J].PLoS One,2012,7(12):e52162.
5 Zhang H,Sun K,Ding J,et al.Harmine induces apoptosis and inhibits tumor cell proliferation,migration and invasion through down-regulation of cyclooxygenase-2 expression in gastric cancer[J].Phytomedicine,2014 ,21(3):348-355.
6 Jing X,Cheng W,Wang S,et al.Resveratrol induces cell cycle arrest in human gastric cancer MGC803 cells via the PTEN-regulated PI3K/Akt signaling pathway[J].Oncol Rep,2016,35(1):472-478.
7 Zheng T,Meng X,Wang J,et al.PTEN-and p53-mediated apoptosis and cell cycle arrest by FTY720 in gastric cancer cells and nude mice[J].J Cell Biochem,2010,111(1):218-228.
8 Sepideh S,Mohammadreza JN,Ali D,et al.Study of the Murine Double Minute 2 status in patients with gastric and colorectal carcinomas and its correlation with prognostic factors[J].Indian J Pathol Microbiol,2012,55(2):192-195.
9 Jung CR,Lim JH,Choi Y,et al.Enigma negatively regulates p53 through MDM2 and promotes tumor cell survival in mice[J].J Clin Invest,2010,120(12):4493-4506.
10 He XP,Shao Y,Li XL,et al.Downregulation of miR-101 in gastric cancer correlates with cyclooxygenase-2 overexpression and tumor growth[J].FEBS J,2012,279(22):4201-4212.
11 Sun WH,Sun YL,Fang RN,et al.Expression of cyclooxygenase-2 and matrix metalloproteinase-9 in gastric carcinoma and its correlation with angiogenesis[J].Jpn J Clin Oncol,2005,35(12):707-713.
12 Sun WH, Zhu F, Chen GS, etal. Blockadeof cholecystokinin-2 receptor and cyclooxygenase-2 synergistically induces cell apoptosis,and inhibits the proliferation of human gastric cancer cells in vitro[J].Cancer Lett,2008,263(2):302-311.
13 Abraham AG,O’Neill E.PI3K/Akt-mediated regulation of p53 in cancer[J].Biochem Soc Trans,2014,42(4):798-803.
14 Du W,Yi Y,Zhang H,et al.Rapamycin inhibits IGF-1-mediated up-regulation of MDM2 and sensitizes cancer cells to chemotherapy[J].PLoS One,2013,8(4):e63179.
15 Xu W,Chen GS,Shao Y,et al.Gastrin acting on the cholecystokinin2 receptor induces cyclooxygenase-2 expression through JAK2/STAT3/PI3K/Akt pathway in human gastric cancer cells[J].Cancer Lett,2013,332(1):11-18.
16 Liu H,Han D,Liu Y,et al.Harmine hydrochloride inhibits Akt phosphorylation and depletes the pool of cancer stem-like cells of glioblastoma[J].J Neurooncol,2013,112(1):39-48.
17 Kuo HP,Chuang TC,Tsai SC,et al.Berberine,an isoquinoline alkaloid,inhibits the metastatic potential of breast cancer cells via Akt pathway modulation[J].J Agric Food Chem,2012,60(38):9649-9658.
18 Dung TD,Day CH,Binh TV,et al.PP2A mediates diosmin p53 activation to block HA22T cell proliferation and tumor growth in xenografted nude mice through PI3KAkt-MDM2 signaling suppression[J].Food Chem Toxicol,2012,50(5):1802-1810.
19 Proietti S,Cucina A,Dobrowolny G,et al.Melatonin down-regulates MDM2 gene expression and enhances p53 acetylation in MCF-7 cells[J].J Pineal Res,2014,57(1):120-129.
20 Nag SA,Qin JJ,Wang W,et al.Ginsenosides as Anticancer Agents:In vitro and in vivo Activities,Structure-Activity Relationships,and Molecular Mechanisms of Action[J].Front Pharmacol,2012,3:25.
