黄连素调节肠道菌群减轻非酒精性脂肪性肝病肝脏炎症的实验研究*
2018-05-10张园园严君君周希乔
张园园 严君君 张 培 周希乔
南京医科大学第一附属医院消化内科(210029)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是全球最常见的慢性肝病之一,其疾病谱演变包括单纯性脂肪肝、非酒精性脂肪性肝炎、肝硬化和肝细胞癌。近年统计显示,全球约四分之一的人口罹患NAFLD,每年约有0.044%的NAFLD进展为肝细胞癌[1]。在我国,NAFLD患病率已超过慢性病毒性肝病,成为第一大肝病。目前NAFLD的治疗主要为调整生活方式以及预防和控制合并疾病,即治疗肥胖、高血脂、高血糖、高血压等[2],尚缺乏针对特异性靶点的治疗药物。
黄连素(berberine,C20H18NO4)是一种异喹啉类生物碱,作为中草药在中国用于治疗肠道细菌感染导致的腹泻已有数千年历史,具有可以信赖的疗效和安全性[3-4]。肠道菌群是影响代谢性疾病的主要环境因素,参与维持并调节宿主的能量代谢和免疫功能,肠道菌群失调可能导致包括NAFLD在内的多种代谢性和免疫性疾病并促进疾病进展[5]。药理学研究表明,黄连素可能具有多个作用靶点和作用机制,包括降低胆固醇、调控肝脏内参与糖脂代谢的基因表达以及调节肠道菌群稳态[6]。本研究旨在探讨黄连素对高脂饮食诱导的小鼠肝脏脂毒性的保护作用及其减轻肝脏炎症损伤的相关机制。
材料与方法
一、实验动物和主要试剂
雄性C57BL/6J小鼠40只,6~8周龄,体质量20~25 g,由南京医科大学医药实验动物中心提供。高脂饲料(脂肪含量60%)、普通饲料(脂肪含量10%)(Research Diets,Inc.);黄连素(上海源叶生物科技有限公司);Percoll分离液、棕榈酸(PA)(Sigma-Aldrich LLC.);油红染料(南京因贝生物技术有限公司);脂多糖(LPS)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)ELISA试剂盒(南京森贝伽生物科技有限公司);real-time PCR相关试剂盒(上海皓嘉科技发展有限公司)。
二、方法
1.动物分组和模型建立:研究方案经南京医科大学动物伦理委员会批准。实验小鼠饲养于SPF级动物房,自由进食、饮水,动物房通风良好,室温25℃,相对湿度55% ~65%,每日光照12 h。适应性饲养1周后,30只小鼠随机分为3组:对照组、高脂饮食组和治疗组,每组10只。治疗组在高脂饮食的同时每天予200 mg/kg黄连素灌胃(黄连素粉末以0.5%羧甲基纤维素钠溶液配制成悬液,灌胃前将悬液颠倒混匀),持续12周;对照组和高脂饮食组予相同体积羧甲基纤维素钠溶液灌胃。
2.肝巨噬细胞分离、培养:10只小鼠用于细胞实验。小鼠饥饿处理16~24 h,麻醉后暴露门静脉和下腔静脉,将穿刺套管针插入门静脉固定。缓慢匀速向肝内泵入常温PBS 30~40 mL,剪开下腔静脉,继续灌注含Ⅰ型胶原酶的Hank’s液20 mL。摘取肝脏移入DMEM培养基中剪碎,37℃水浴摇床中孵育20 min,得到的单细胞悬液定容至50 mL,以细胞筛网除去未消化完全的组织块;50×g离心10 min×3次,去除大部分肝实质细胞,上清液转入新的离心管;Percoll密度梯度离心分离肝巨噬细胞,收集中间液体,离心,洗涤2次。6孔板无血清DMEM培养基培养细胞24 h,进行后续实验。
3.血清生化指标检测:第 12周末动物禁食12 h,1%戊巴比妥钠麻醉,眼眶取血约 1 mL,3 000 r/min 4℃离心15 min,吸取上层血清,以全自动生化分析仪检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆固醇(TC)、三酰甘油(TG)和空腹血糖。
4.肝组织病理学检查:取小鼠肝脏,称取湿重。部分肝组织4%甲醛固定24 h,石蜡包埋、切片,行HE染色;部分肝组织立即置于液氮中,冰冻切片,行油红染色;剩余肝组织-80℃冰箱保存。病理切片由病理学专家读片,Image-Pro Plus 6.0软件分析油红染色切片中脂滴面积(×400)。
5.16SrRNA基因测序检测肠道菌群:每组随机采集5只小鼠的回盲部粪便样品,共15个样品,交由华大基因科技有限公司高通量测序实验室行肠道菌群焦磷酸测序和生物信息学分析。检测前以荧光计或酶标仪检测样品浓度,琼脂糖凝胶电泳检测样品完整性。比较三组小鼠组内和组间肠道细菌丰度指数;对门、纲、目、科、属、种分类进行热图聚类分析;通过与数据库比对,对OTU(operational taxonomic units,运算分类单位)进行物种分类,并对各个样品作物种profiling面积图和柱状图;根据群落热图颜色梯度的变化分析各组小鼠全部菌属和菌种的比例变化。
6.ELISA法检测血清和肝组织炎症因子水平:ELISA试剂盒室温放置至少30 min,冻存血清样品平衡至室温。参照相应试剂盒说明书进行操作,检测小鼠血清LPS和肝组织TNF-α、IL-6水平,每一样品设4个复孔。读取酶标仪450 nm波长处吸光度值(A值),采用相应软件绘制标准曲线,得到各样品检测值。
7.透射电子显微镜观察肝巨噬细胞超微结构:小鼠原代肝巨噬细胞以无血清DMEM培养基培养24 h后,换液分组为对照组(不予处理)以及1 μmol/L黄连素、0.5 mmol/L PA和两者联合处理组,培养24 h后,细胞以4%戊二醛4℃固定,PBS洗涤30 min,1%锇酸固定1 h,缓冲液漂洗3次,梯度脱水,乙酸铀染色,透射电子显微镜观察、拍照。
8.Real-time PCR检测肝巨噬细胞促炎细胞因子表达:小鼠原代肝巨噬细胞以无血清DMEM培养基培养24 h后,换液分组为对照组(不予处理)以及0.1 μg/mL LPS 和 0.1 μmol/L 黄连素 +0.1 μg/mL LPS处理组,培养24 h后提取细胞总RNA,逆转录合成cDNA,以之为模板行real-time PCR扩增,操作步骤参照相应试剂盒说明书。PCR引物序列见表1,由南京金斯瑞生物科技公司合成。2-△△CT法计算目的基因mRNA相对表达量。
三、统计学分析
应用GraphPad Prism 5.0统计学软件,符合正态分布的计量资料以¯x±s表示,多组间比较采用单因素方差分析,两两比较采用Tukey法,P<0.05为差异有统计学意义。

表1 PCR引物序列
结 果
一、一般情况和血清生化指标变化
三组小鼠体质量基数差异无统计学意义(P>0.05),饮食量基本一致。高脂饮食组小鼠体质量从第6周开始明显增高,趋于肥胖,第12周末体质量为(34.4±3.3)g;治疗组小鼠经12周黄连素灌胃,体质量与对照组基本齐平[(25.1±3.2)g对(27.7±1.8)g,P>0.05]。肉眼观察高脂饮食组小鼠肝脏明显增大,色偏黄,表面覆有油脂,切面结构模糊;治疗组小鼠肝脏湿重较高脂饮食组明显降低,差异有统计学意义[(0.82±0.08)g对(1.18±0.09)g,P<0.05]。高脂饮食组小鼠血清 ALT、AST、TC、TG和空腹血糖较对照组明显升高,差异有统计学意义(P<0.05);治疗组ALT、TC、TG和空腹血糖较高脂饮食组明显降低,差异有统计学意义(P<0.05),AST降幅不明显(P>0.05)(表2)。
二、肝组织病理学改变
肝组织HE染色切片光学显微镜下观察显示,对照组小鼠肝细胞形态结构完整,在中央静脉周围呈放射状排列,肝细胞内未见脂滴;高脂饮食组小鼠肝细胞脂肪变,细胞肿大变圆,小叶中央区受累明显,细胞排列紊乱,胞质内出现大小不等的球形脂滴,间质炎性细胞浸润,可见炎症坏死灶融合成片;治疗组小鼠肝小叶脂滴聚集和炎症病灶明显减少。冰冻切片油红染色可更明显地观察到高脂饮食组小鼠肝内大颗粒脂滴沉积,治疗组小鼠脂滴数量明显减少(图1)。高脂饮食组脂滴面积明显大于对照组[(170 149.6±29 920.4)像素2对(75 663.3±25 686.2)像素2,P <0.05],治疗组脂滴面积较高脂饮食组明显减小[(79 450.6±30 787.8)像素2对(170 149.6±29 920.4)像素2,P <0.05],差异均有统计学意义。
表2 各组小鼠血清生化指标比较
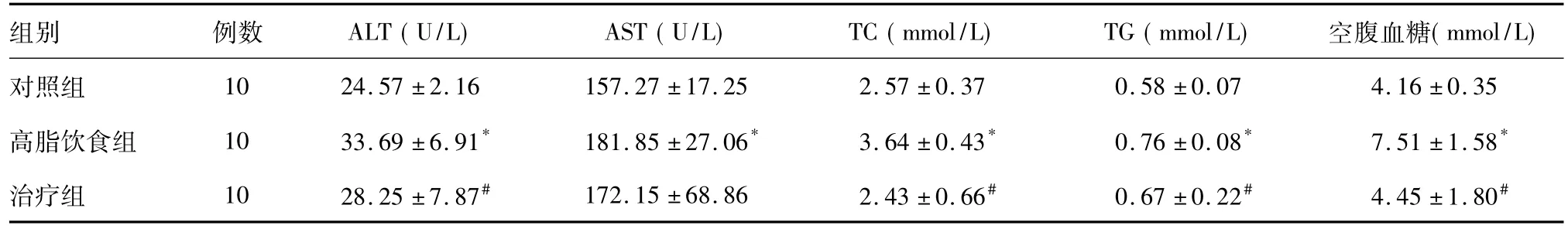
表2 各组小鼠血清生化指标比较
*与对照组比较,P<0.05;#与高脂饮食组比较,P<0.05
组别 例数 ALT(U/L) AST(U/L) TC(mmol/L) TG(mmol/L) 空腹血糖(mmol/L)对照组 10 24.57±2.16 157.27±17.25 2.57±0.37 0.58±0.07 4.16±0.35高脂饮食组 10 33.69±6.91* 181.85±27.06* 3.64±0.43* 0.76±0.08* 7.51±1.58*治疗组 10 28.25±7.87# 172.15±68.86 2.43±0.66# 0.67±0.22# 4.45±1.80#
三、肠道菌群丰度变化
15个样品共得到564 366条序列,每一样品平均37 624条。α和β多样性分析显示,高脂饮食组小鼠肠道菌群组分与对照组相比有较大差异,治疗组小鼠肠道菌群丰度明显降低。16S rRNA基因测序物种热图分析肠道菌群相对丰度,并在门分类上进行物种分析,结果显示对照组回盲部微生物主要为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),高脂饮食组厚壁菌门和变形菌门减少,治疗组变形菌门和疣微菌门(Verrucomicrobia)增加(P<0.05)。对科的分类热图聚类分析发现,与对照组相比,高脂饮食组拟杆菌(Bacteroidaceae)、双歧杆菌(Bifidobacteriaceae)、脱硫弧菌(Desulfovibrionaceae)减少,帕拉普氏菌(Paraprevotellaceae)增加;治疗组拟杆菌、脱硫弧菌增加,帕拉普氏菌减少(图2)。
四、黄连素减轻小鼠体内炎症反应
ELISA检测显示,高脂饮食组小鼠血清LPS和肝组织IL-6水平较对照组明显升高,治疗组LPS、IL-6水平较高脂饮食组明显降低,差异均有统计学意义(P<0.05),三组间肝组织TNF-α水平无明显变化(P>0.05)(图3)。上述结果表明黄连素能有效减轻小鼠体内炎症反应。
五、黄连素体外改善肝巨噬细胞脂质沉积和促炎细胞因子表达
透射电子显微镜观察显示,经黄连素处理的原代肝巨噬细胞在结构和形态上与未予处理的巨噬细胞无明显差异;经PA处理的巨噬细胞可见明显脂质沉积,胞质中出现大量不规则脂滴;如同时予黄连素和PA处理,巨噬细胞内脂滴明显减小,数量减少(图4)。经LPS处理的巨噬细胞,TNF-α、IL-6 mRNA相对表达量较未予处理的巨噬细胞明显增高,如同时予黄连素和LPS处理,两者表达水平明显降低,差异均有统计学意义(P<0.05)(图5)。上述结果表明黄连素在体外能改善肝巨噬细胞脂质沉积和促炎细胞因子表达。
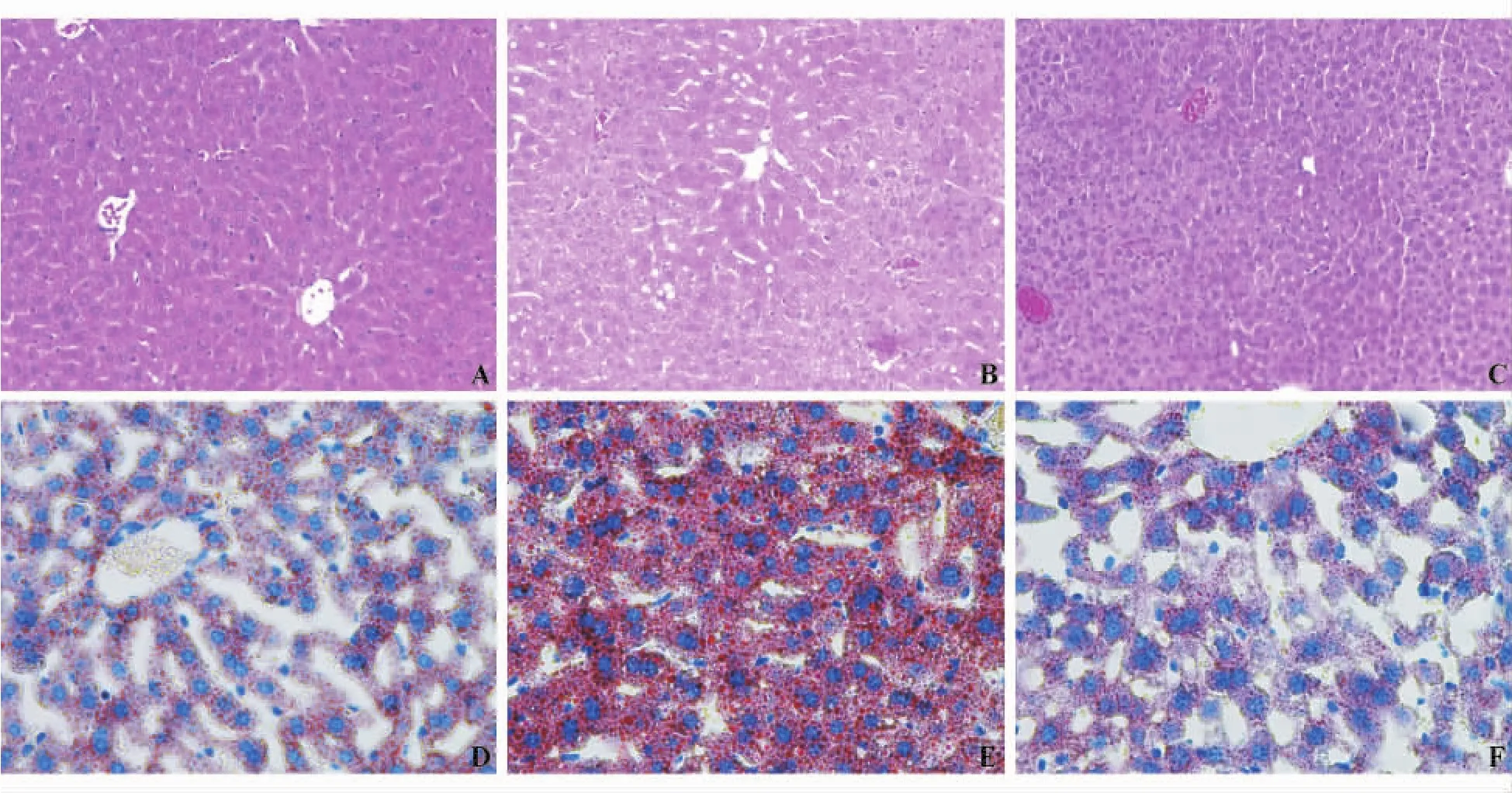
图1 各组小鼠肝组织病理学改变
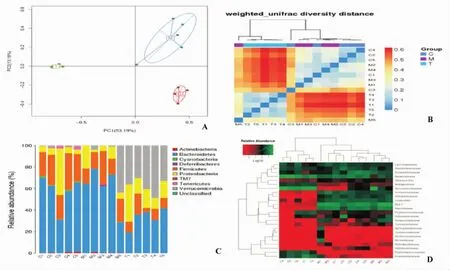
图2 各组小鼠回盲部菌群丰度变化
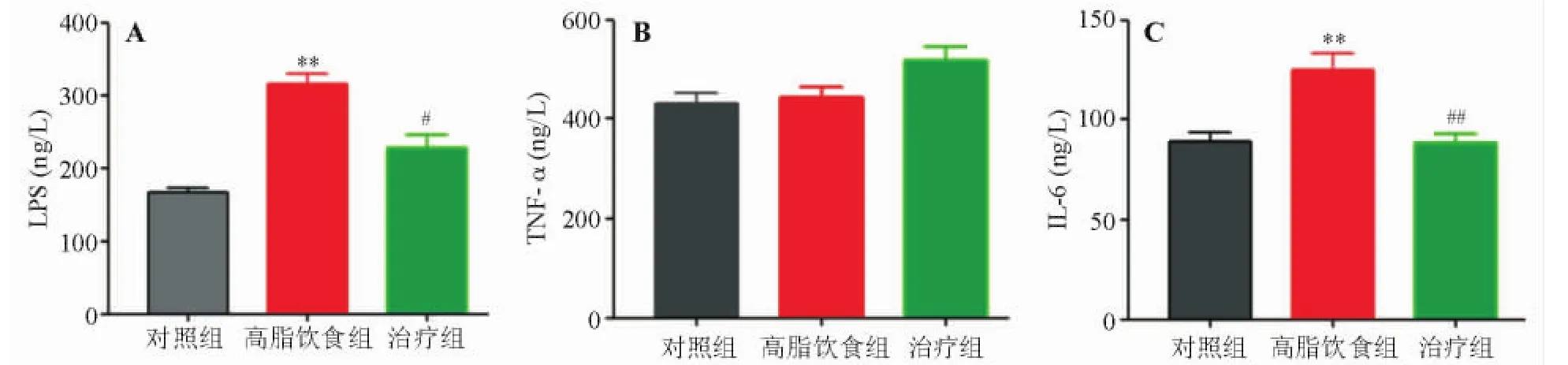
图3 黄连素减轻小鼠体内炎症反应

图4 黄连素改善PA诱导的原代肝巨噬细胞脂质沉积
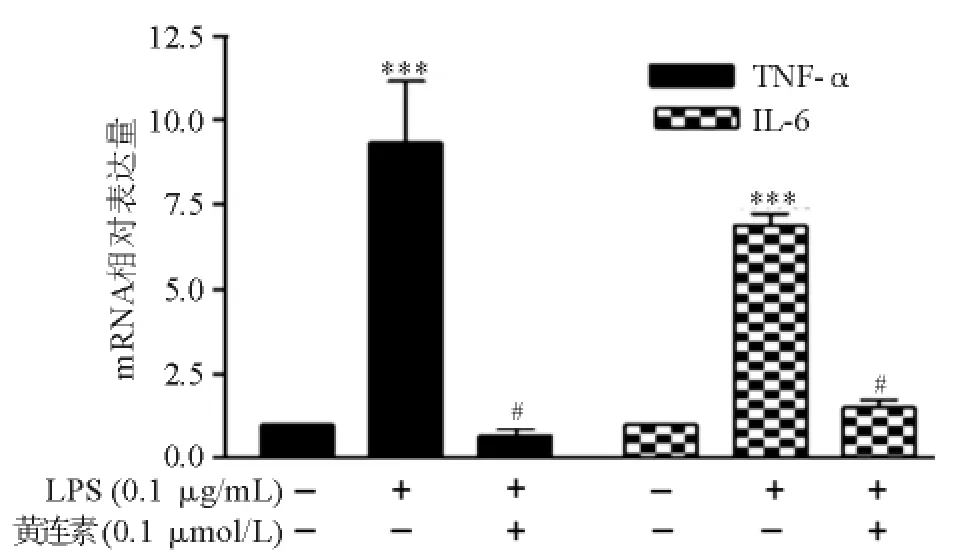
图5 黄连素改善LPS诱导的原代肝巨噬细胞促炎细胞因子表达增加
讨 论
NAFLD是一种以肝脏表现为主的代谢综合征,病理特点为肝内脂肪颗粒沉积、肝细胞气球样变和炎性细胞浸润。该病影响发达国家约30%的成年人,在糖尿病和肥胖患者中的检出率高达60% ~70%[7-8]。尽管NAFLD为良性疾病,但可进展为肝纤维化、肝硬化甚至肝细胞癌,因此探索、研发靶向治疗NAFLD的药物迫在眉睫。
过去20年中,大量研究报道了黄连素对2型糖尿病和高脂血症的治疗作用,近年研究发现黄连素还可用于治疗NAFLD[9-10]。黄连素口服后,在肝脏中的分布浓度是血浆浓度的50~70倍,可调节肝脏内代谢相关基因表达,改善肝脏脂质代谢、增加胰岛素敏感性、促进肝糖原合成,从而减轻NAFLD以及相关代谢性疾病[6,10]。本研究采用高脂饮食诱导雄性C57BL/6J小鼠NAFLD模型,模型小鼠体质量和肝脏湿重明显增加,肝脏呈现明显脂肪变性和炎症损伤,血清ALT、AST病理性升高,提示肝细胞受损,并出现糖、脂代谢失调。予黄连素灌胃治疗12周的模型小鼠,体质量、肝脏湿重、血清ALT、TC、TG和空腹血糖均明显降低,与既往研究[10]结果相一致。黄连素降低血清AST的作用不明显,可能与药物剂量低、给药时间短,不足以完全修复线粒体损伤,使反映肝细胞线粒体损伤的AST恢复正常。
NAFLD的发病机制十分复杂,目前主流观点为“二次打击”学说,第一次打击为肝内脂质聚集,引起胰岛素抵抗;第二次打击为体内炎症因子释放,引发线粒体功能障碍和氧化应激,导致肝脏损伤[11]。本研究中小鼠高脂饮食12周后,HE染色和油红染色观察到肝细胞内有大量脂滴沉积和炎症坏死灶,而经黄连素治疗的小鼠肝内脂质聚集明显减少,炎性细胞浸润改善。在细胞实验中,以透射电子显微镜观察小鼠原代肝巨噬细胞超微结构,同样发现PA可诱导巨噬细胞脂质沉积,而黄连素可明显减少细胞内脂滴数量。黄连素改善肝脏脂质沉积和炎症反应的作用,可能归因于其对肝细胞内多种信号通路的调节作用。与他汀类降脂药不同,黄连素系通过稳定低密度脂蛋白受体(LDL-R)表达降低胆固醇。血液中低密度脂蛋白胆固醇(LDL-C)的清除主要依赖LDL-R,而9型前蛋白转化酶枯草杆菌蛋白酶/kexin(PCSK9)可与肝细胞表面的LDLR结合,使之分解而不再能清除LDL-C。因此抑制PCSK9可使肝细胞表面有更多LDL-R以清除血液中的LDL-C。研究[12]发现予高脂饮食大鼠黄连素灌胃治疗后,其肝组织PCSK9表达显著下调,因此PCSK9可能是黄连素抗高脂血症作用的靶点之一。目前深入研究该信号通路的课题正在开展中。
研究发现,脂肪肝和代谢综合征小鼠体内存在肠道菌群改变,肠道菌群紊乱可诱导机体发生炎症反应,促进胰岛素抵抗,参与 NAFLD的发生、发展[13]。具体而言,肠-肝轴对机体健康起重要双向调节作用,肠道菌群参与宿主肥胖、肝脏脂肪性炎症和纤维化的发生,增加肝细胞癌易感性;而宿主的膳食结构、肥胖、进食频率、睡眠-觉醒周期等亦可影响肠道菌群的丰度和组分[14]。NAFLD患者肠道菌群紊乱,表现为艰难梭菌增加,拟杆菌大量死亡,数量减少[15]。拟杆菌为革兰阴性菌,其死亡过程中溶解产生大量LPS,后者通过门静脉进入肝脏,被肝巨噬细胞上的Toll样受体4(TLR4)识别,LPS/TLR4信号通路活化引发炎症和胰岛素抵抗,参与NAFLD发病[16]。此外,NAFLD患者的肠道细菌能将胆碱代谢为三甲胺氧化物(TMAO),导致肝脏损伤,诱发炎症反应[17]。本研究以16S rRNA基因测序技术分析小鼠回盲部肠道菌群,α和β生物多样性在各组间均存在差异,正常小鼠回盲部微生物主要为拟杆菌门、厚壁菌门和变形菌门,高脂饮食可致拟杆菌、双歧杆菌、脱硫弧菌减少,帕拉普氏菌增加;而黄连素灌胃治疗可恢复肠道菌群丰度和组分,小鼠回盲部拟杆菌、脱硫弧菌增加,帕拉普氏菌减少。
本研究发现高脂饮食组小鼠血清LPS和肝组织IL-6水平显著增高,而黄连素灌胃能明显降低LPS和IL-6水平。肝巨噬细胞能吞噬凋亡、坏死的肝细胞,参与肝纤维化形成,并释放促炎细胞因子导致慢性炎症反应[18]。为进一步研究黄连素减轻炎症反应的作用机制,本研究分离、培养小鼠肝巨噬细胞,并予LPS刺激促炎细胞因子表达,发现黄连素处理能显著降低巨噬细胞的TNF-α、IL-6表达水平。根据上述研究结果,推测黄连素可能通过调节肠道菌群、减少LPS生成而抑制肝巨噬细胞炎症因子释放,进而减轻肝脏炎症反应。
综上所述,NAFLD是由遗传、环境等多因素共同作用导致的代谢性肝病,其发病机制尚未完全阐明,炎症反应和肠-肝轴在其发生、发展中扮演至关重要的角色。本研究结果显示,黄连素在NAFLD中发挥调节肠道菌群、减轻肝脏脂质沉积和炎症损伤的作用,为黄连素在临床实践中的推广应用提供了新的科学依据。
1 Younossi ZM,Koenig AB,Abdelatif D,et al.Global epidemiology of nonalcoholic fatty liver disease-Metaanalytic assessment of prevalence, incidence, and outcomes[J].Hepatology,2016,64(1):73-84.
2 Banini BA,Sanyal AJ.Current and future pharmacologic treatment of nonalcoholic steatohepatitis[J].Curr Opin Gastroenterol,2017,33(3):134-141.
3 Vuddanda PR,Chakraborty S,Singh S.Berberine:a potentialphytochemicalwith multispectrum therapeutic activities[J].Expert Opin Investig Drugs,2010,19(10):1297-1307.
4 Kulkarni SK,Dhir A.Berberine:a plant alkaloid with therapeutic potential for central nervous system disorders[J].Phytother Res,2010,24(3):317-324.
5 Boulangé CL,Neves AL,Chilloux J,et al.Impact of the gut microbiota on inflammation,obesity,and metabolic disease[J].Genome Med,2016,8(1):42.
6 Zhu X,Bian H,Gao X.The Potential Mechanisms of Berberine in the Treatment of Nonalcoholic Fatty Liver Disease[J].Molecules,2016,21(10).pii:E1336.
7 Cohen JC,Horton JD,Hobbs HH.Human fatty liver disease:old questions and new insights[J].Science,2011,332(6037):1519-1523.
8 Chalasani N,Younossi Z,Lavine JE,et al.The diagnosis and managementofnon-alcoholicfattyliverdisease:practice Guideline by the American Association for the Study of Liver Diseases,American College of Gastroenterology,and the American Gastroenterological Association[J].Hepatology,2012,55(6):2005-2023.
9 Chang X, Yan H,Fei J,et al.Berberine reduces methylation of the MTTP promoter and alleviates fatty liver induced by a high-fat diet in rats[J].J Lipid Res,2010,51(9):2504-2515.
10 Yan HM,Xia MF,Wang Y,et al.Efficacy of Berberine in Patients with Non-Alcoholic Fatty Liver Disease[J].PLoS One,2015,10(8):e0134172.
11 Sun C,Fan JG,Qiao L.Potential epigenetic mechanism in non-alcoholic Fatty liver disease[J].Int J Mol Sci,2015,16(3):5161-5179.
12 Liu DL,Xu LJ,Dong H,et al.Inhibition of proprotein convertase subtilisin/kexin type 9:a novel mechanism of berberine and 8-hydroxy dihydroberberine against hyperlipidemia[J].Chin J Integr Med,2015,21(2):132-138.
13 Bibbò S,Ianiro G,Dore MP,et al.Gut Microbiota as a Driver of Inflammation in Nonalcoholic Fatty Liver Disease[J].Mediators Inflamm,2018,2018:9321643.
14 Federico A,Dallio M,Godos J,et al.Targeting gut-liver axis for the treatment of nonalcoholic steatohepatitis:translational and clinical evidence[J].Transl Res,2016,167(1):116-124.
15 Xue L,He J,Gao N,et al.Probiotics may delay the progression of nonalcoholic fatty liver disease by restoring the gutmicrobiota structure and improving intestinal endotoxemia[J].Sci Rep,2017,7:45176.
16 Dumitru CD,Ceci JD,Tsatsanis C,et al.TNF-alpha induction by LPS is regulated posttranscriptionally via a Tpl2/ERK-dependent pathway[J].Cell,2000,103(7):1071-1083.
17 Chen YM,Liu Y,Zhou RF,et al.Associations of gutflora-dependent metabolite trimethylamine-N-oxide,betaine and choline with non-alcoholic fatty liver disease in adults[J].Sci Rep,2016,6:19076.
18 Reid DT,Reyes JL,McDonald BA,et al.Kupffer Cells Undergo Fundamental Changes during the Development of Experimental NASH and Are Critical in Initiating Liver Damage and Inflammation[J].PLoS One,2016,11(7):e0159524.
