IL-22BP在活动期炎症性肠病患者肠黏膜中的表达及其意义*
2018-05-10陈达凡宛新建
马 静 陈达凡 宛新建
上海交通大学附属第一人民医院消化科(200080)
炎症性肠病(IBD)主要包括克罗恩病(CD)和溃疡性结肠炎(UC),是一种慢性非特异性消化道炎症性疾病。目前其病因和发病机制尚未完全明确,一般认为是宿主基因、肠道微生态、环境等因素相互作用,引发消化道异常免疫反应所致。多种细胞因子表达和调节失衡与机体异常免疫反应密切相关。
白细胞介素-22结合蛋白(interleukin-22 binding protein,IL-22BP)是IL-22的内源性抑制剂,可特异性、高亲和性地与IL-22结合,从而抑制其作用[1-2]。IL-22可通过促进肠上皮细胞(intestinal epithelial cells,IECs)分泌多种抗菌肽以及黏蛋白,促进IECs增殖,抑制IECs凋亡,从而在维持肠黏膜屏障功能稳态中扮演重要角色[3-6]。近年国外有研究发现IL-22BP在IBD患者肠黏膜中高表达,利用多种动物模型证实其通过抑制IL-22的肠道保护作用,促进肠道炎症的发生[7-8]。然而目前IL-22BP与IBD的关系尚未完全阐明,我国IBD患者肠黏膜中IL-22BP表达水平及其意义鲜有报道。本研究通过检测活动期IBD患者肠黏膜中IL-22BP的表达情况,旨在探讨其在IBD发病中的临床意义。
材料与方法
一、资料来源
纳入2017年1月—2018年1月上海交通大学附属第一人民医院收治的活动期IBD患者61例,其中CD患者25例,UC患者36例,非上海籍患者达到1/3,能在一定程度上代表国内情况。IBD的诊断符合《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[9]。采用蒙特利尔分型对CD确诊年龄(age,A)、病变部位(location,L)以及疾病行为(behavior,B)进行分型,对 UC病变范围进行分类[10]。利用简化 CD 活动指数(CDAI)[11]、CD 简化内镜评分(SES-CD)[12-13]以及 Mayo 评分系统[14]分别对CD和UC的疾病活动度进行评估。
留取IBD患者病变最明显处的肠黏膜组织,其中CD回肠组织12份、结肠组织13份,UC结肠组织36份。另选择同期结肠息肉患者30例设为对照,其结肠镜下表现为具有单个且直径<0.6 cm的息肉,患者既往无结核、自身免疫性疾病史,留取距息肉5 cm以上的正常回肠和(或)结肠组织,其中14例患者留取回肠和结肠组织,16例仅留取结肠组织。将14份回肠组织以及16份结肠组织设为CD对照组,30份结肠组织设为UC对照组。入选者均选取2块组织,1块立即置于液氮,-80℃冰箱冻存备用,另1块置于甲醛溶液固定,石蜡包埋。本研究方案经上海交通大学附属第一人民医院医学伦理委员会审批通过,所有入选者均签署知情同意书。
二、研究方法
1.实时荧光定量PCR法检测肠黏膜中IL-22BP mRNA表达:将入选者肠黏膜组织充分研磨,以总RNA提取试剂TRIeasy(上海翊圣生物科技有限公司)提取总RNA,逆转录试剂盒(上海翊圣生物科技有限公司)逆转录合成cDNA。引物由生工生物工程(上海)有限公司合成,IL-22BP引物序列:F:5’-GGC ACT TAC TGG CAA CAG CA-3’,R:5’-GCA TCC ACT TGG CTT CTG GT-3’。以 β-actin作为内参,引物序列:F:5’-AAG GTG ACA GCA GTC GGT-3’,R:5’-TGT GTG GAC TTG GGA GAG G-3’。反应体系含cDNA模板2 μL、上下游引物(4 μmol/L)各 1 μL、SYBR Green Master Mix 10 μL,以 DEPC水补足至20 μL。反应条件:95℃预变性10 min;95℃ 变性10 s,55 ℃退火20 s,72 ℃延伸20 s,共40个循环。上ABI Q6 real-time PCR仪实时监测。每一样本均设3个复孔。采用2-△△Ct法计算 IL-22BP mRNA相对表达量。
2.免疫组化法检测肠黏膜中IL-22BP蛋白表达:肠组织标本常规石蜡包埋,4 μm厚连续切片。柠檬酸盐缓冲液进行抗原修复,3%H2O2溶液阻断内源性过氧化物酶,3%BSA室温封闭30 min,加入IL-22BP抗体(Abcam公司,工作浓度为1∶500),4℃孵育过夜,加入辣根过氧化物酶标记的二抗,DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明后封片。
结果判定:光学显微镜下,细胞质中观察到淡黄色至黄褐色颗粒定义为阳性细胞。采用Formwitz半定量积分法。于200倍视野下随机观察5个视野,计数阳性细胞并观察染色强度。阳性细胞率:≤5%,0分;6% ~25%,1分;26% ~50%,2分;51% ~75%,3分;>75%,4分。染色强度:无色,0分;淡黄色,1分;黄色,2分;黄褐色,3分。两项评分之积为染色总分:0分为阴性(-),1~4分为弱阳性(+),5~8分为中等阳性(++),9~12分为强阳性(+++)。采用盲法由两名医师独立评分,不一致时取均值。
3.肠黏膜中IL-22BP蛋白表达与IBD疾病活动度的相关性:分别采用简化CDAI以及Mayo评分评估CD和UC患者的疾病活动度,并分析其与IL-22BP蛋白表达的相关性。
三、统计学分析
结 果
一、一般情况
25例CD患者中,男15例,女10例;年龄16~60岁,平均(37.76±12.43)岁;蒙特利尔A1型(≤16岁)3例,A2型(17~40岁)15例,A3型(>40岁)7例;L1型(累及回肠)9例,L2型(累及结肠)6例,L3型(累及回结肠)10例;B1型(非狭窄非穿透型)15例,B2型(狭窄型)6例,B3型(穿透型)4例,P(肛周病变)7例;根据简化CDAI评分,疾病活动度为中度(5~8分)18例,重度(>8分)7例;内镜下表现为回肠和(或)结肠黏膜糜烂、节段性纵行溃疡或阿弗他溃疡。36例UC患者中,男19例,女17例;年龄22~68岁,平均(41.36±12.52)岁;蒙特利尔E1型(直肠)8例,E2型(左半结肠)10例,E3型(广泛结肠)18例;根据Mayo评分,疾病活动度为轻度(3~5分)18例,中度(6~10分)14例,重度(11~12分)4例;结肠镜下表现为结肠黏膜红斑、易脆、糜烂或溃疡形成。30例对照组患者中男17例,女13例,年龄20~67岁,平均(41.06±11.47)岁。各组间性别构成和年龄差异均无统计学意义(P >0.05)。
二、肠黏膜中IL-22BP mRNA表达
与相应对照组相比,CD组患者肠黏膜中IL-22BP mRNA表达显著升高(t=13.553,P<0.001),UC组患者肠黏膜中IL-22BP mRNA表达亦显著升高(t=10.720,P <0.001)(表1、图1)。
三、肠黏膜中IL-22BP蛋白表达
免疫组化结果显示,CD组和UC组患者肠黏膜均出现IL-22BP阳性细胞,呈黄色或黄褐色胞质染色,肠黏膜中IL-22BP以中等阳性表达为主。CD组阳性细胞在肠黏膜全层可见,UC组则主要位于上皮和固有层。对照组患者肠黏膜中IL-22BP以弱阳性表达为主。CD组和UC组患者肠黏膜中IL-22BP蛋白表达均显著高于相应对照组(t=7.652,P<0.001;t=6.572,P <0.001)(表1、图 2)。
四、肠黏膜中IL-22BP蛋白表达与IBD疾病活动度的相关性
相关性分析显示,肠黏膜中IL-22BP蛋白表达与CD疾病活动度呈显著正相关(r=0.649,P<0.001),与UC疾病活动度亦呈显著正相关(r=0.732,P <0.001)。
表1 各组IL-22BP mRNA和蛋白表达±s)

表1 各组IL-22BP mRNA和蛋白表达±s)
*与相应对照组比较,P<0.001
组别 例数 mRNA 表达 蛋白表达CD组 25 3.59±0.83* 6.12±2.30*30 1.05±0.34 2.23±1.77 CD对照组 30 1.08±0.45 1.83±1.86 UC组 36 2.19±0.52* 5.58±2.27*UC对照组
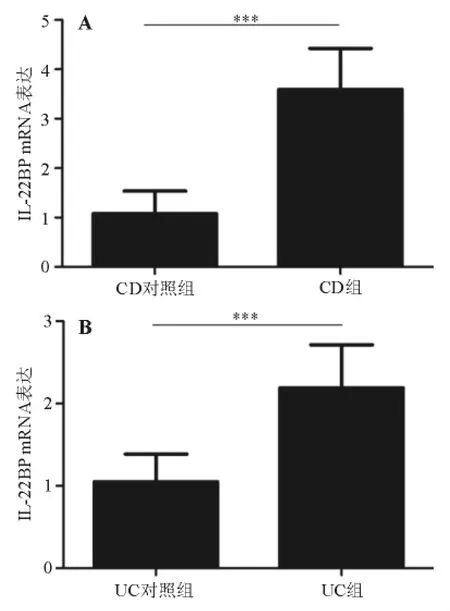
图1 各组肠黏膜中IL-22BP mRNA表达(实时荧光定量PCR法)
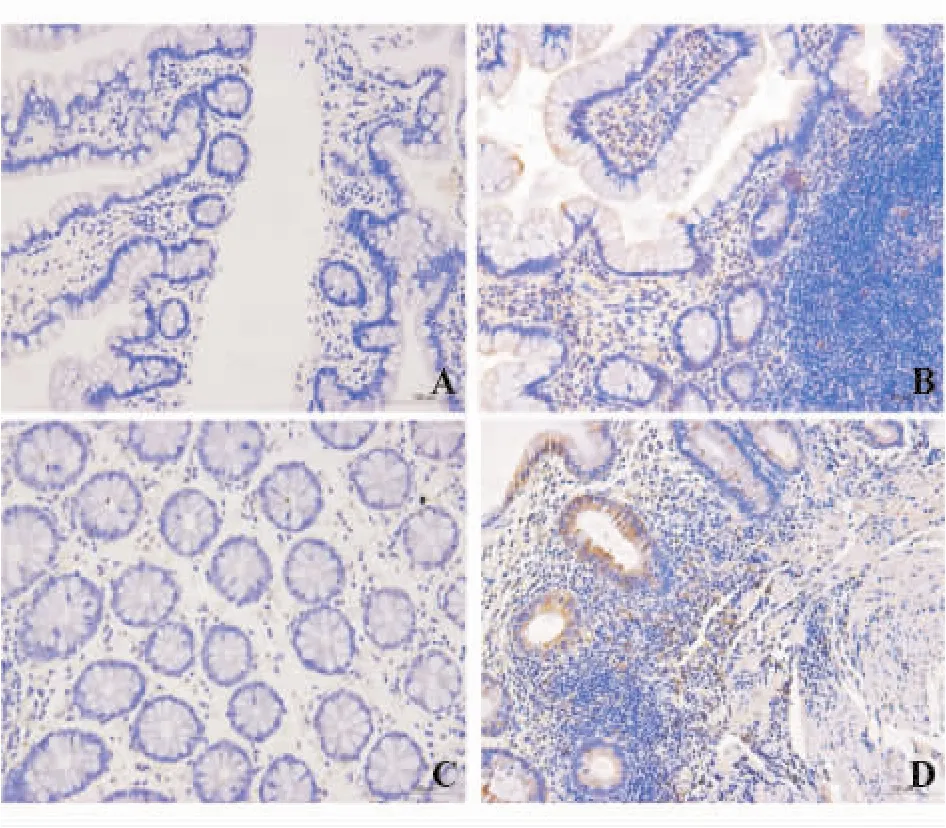
图2 各组肠黏膜中IL-22BP蛋白表达(免疫组化染色,×200)
讨 论
IL-22BP为可溶性的单链IL-22受体,与IL-22亲和力极高,其特异性结合于IL-22,可阻断后者与靶细胞跨膜受体复合物的结合,进而抑制下游信号转导,是调控 IL-22功能的主要因子[1]。IL-22为IL-10家族成员之一,由T细胞等免疫细胞分泌,特异性作用于固有细胞表面由IL-22R1和IL-10R2构成的异二聚体,通过激活JAK/STAT等通路在多种自身免疫性疾病中发挥重要作用[15-16]。
IL-22可促进肠道IECs分泌黏蛋白和抗菌肽,调节IECs紧密连接蛋白表达及其功能,促进IECs增殖和抑制IECs凋亡[3-6,17]。多种结肠炎动物模型发现,外源性给予IL-22或促进其内源性表达,小鼠结肠炎症明显缓解[4,18];而在 IL-22 基因敲除小鼠中,葡聚糖硫酸钠(DSS)和T细胞移植诱导的结肠炎症和黏膜损伤明显加重[6,19]。以上研究结果均提示,IL-22作为连接黏膜固有免疫与适应性免疫应答的桥梁,在维持肠黏膜上皮完整性和屏障功能稳态中发挥重要作用,其功能阻断后,结肠炎加重。作为IL-22的内源性特异性阻断剂,IL-22BP在IBD患者肠黏膜中的表达及其对IL-22功能的精细调控在IBD发病中具有重要作用。
Pelczar等[7]的研究首次发现IBD患者病变肠黏膜处IL-22BP的表达上调,对肠道多种细胞进行分选发现,CD4+T细胞为IL-22BP的主要细胞来源;利用多种动物模型证实,T细胞来源的IL-22BP通过抑制IL-22的肠道保护作用,促进小鼠肠道炎症的发生,具有致病作用;分选抗TNF-α治疗有效的IBD患者肠道CD4+T细胞,发现其仍分泌IL-22,但IL-22BP分泌下降,提示IL-22BP对IL-22肠道保护作用的抑制减弱,促进了IBD病情缓解。Martin等[8]的研究则首次提出嗜酸性粒细胞为IL-22BP的主要分泌细胞,IBD患者病变肠黏膜处嗜酸性粒细胞浸润增多,IL-22BP表达上调;与野生型大鼠相比,IL-22BP基因敲除大鼠以DSS诱导结肠炎后,IL-22调节的肠上皮屏障功能明显改善,DSS结肠炎症状轻微且迅速恢复,再次印证了IL-22BP在IBD中的致病作用。
目前IL-22BP在IBD患者,特别是我国IBD患者肠黏膜中的表达及其与疾病活动度的关系尚未明确。本研究通过检测活动期IBD患者肠黏膜中IL-22BP mRNA和蛋白表达情况及其与疾病活动度的关系,旨在探讨其在IBD发病中的作用。结果显示活动期IBD患者肠黏膜中IL-22BP mRNA和蛋白表达均显著高于对照组。IL-22BP与IL-22的亲和力极高,为膜受体IL-22R1与IL-22亲和力的20~1 000倍[15],因此IL-22BP表达升高可显著抑制IL-22的肠道保护功能,可能在IBD发生、发展过程中发挥作用。进一步行相关性分析发现,CD组、UC组患者肠黏膜中IL-22BP蛋白表达与CD、UC疾病活动度均呈显著正相关,进一步说明IL-22BP在IBD疾病发展中可能发挥作用。但IL-22BP能否用于IBD患者病情的评估尚有待多中心、大样本量研究的进一步探讨。
IL-22可上调抗菌肽LCN2、HBD2、黏蛋白等的表达,促进IECs增殖[8],鉴于其在肠道免疫以及黏膜修复中的重要作用,IL-22分泌及其功能的调控已成为目前研究的热点。Kawai等[20]的研究显示青黛通过作用于芳香烃受体,激活IL-22通路,可显著缓解DSS和三硝基苯磺酸(TNBS)诱导的小鼠结肠炎。在未来的研究中,应探讨IL-22BP对IL-22的精细化调节作用,有望为IBD的治疗研究提供一个新的方向。
综上所述,本研究发现IL-22BP在我国活动期IBD患者肠黏膜中高表达,且与疾病活动度呈正相关,提示其可能参与IBD的发病过程,并且在评估疾病活动度和治疗研究方面具有潜在价值。然而,本研究为单中心观察性研究,样本量相对较小,未来需多中心以及更深入的基础研究进一步阐明IL-22BP表达情况以及相关的作用机制。
1 Dudakov JA,Hanash AM,van den Brink MR.Interleukin-22: immunobiology and pathology[J]. Annu Rev Immunol,2015,33:747-785.
2 Jones BC,Logsdon NJ,Walter MR.Structure of IL-22 bound to its high-affinity IL-22R1 chain[J].Structure,2008,16(9):1333-1344.
3 Sonnenberg GF,Monticelli LA,Alenghat T,et al.Innate lymphoid cells promote anatomical containment of lymphoid-resident commensal bacteria[J].Science,2012,336(6086):1321-1325.
4 Sugimoto K, Ogawa A, Mizoguchi E, et al.IL-22 ameliorates intestinal inflammation in a mouse model of ulcerative colitis[J].J Clin Invest,2008,118(2):534-544.
5 NagalakshmiML, Rascle A, ZurawskiS, etal.Interleukin-22 activates STAT3 and induces IL-10 by colon epithelial cells[J].Int Immunopharmacol,2004,4(5):679-691.
6 Pickert G,Neufert C,Leppkes M,et al.STAT3 links IL-22 signaling in intestinal epithelial cells to mucosal wound healing[J].J Exp Med,2009,206(7):1465-1472.
7 Pelczar P,Witkowski M,Perez LG,et al.A pathogenic role for T cell-derived IL-22BP in inflammatory bowel disease[J].Science,2016,354(6310):358-362.
8 Martin JC,Bériou G,Heslan M,et al.IL-22BP is produced by eosinophils in human gut and blocks IL-22 protective actions during colitis[J].Mucosal Immunol,2016,9(2):539-549.
9 中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年·广州)[J].胃肠病学,2012,17(12):763-781.
10 Satsangi J, Silverberg MS, Vermeire S, et al. The Montreal classification ofinflammatoryboweldisease:controversies,consensus, and implications[J].Gut,2006,55(6):749-753.
11 Harvey RF,Bradshaw JM.A simple index of Crohn’sdisease activity[J].Lancet,1980,1(8167):514.
12 Daperno M,D’HaensG,VanAsscheG,etal.Development and validation of a new,simplified endoscopic activity score for Crohn’s disease:the SES-CD[J].Gastrointest Endosc,2004,60(4):505-512.
13 Schoepfer AM,Beglinger C,Straumann A,et al.Fecal calprotectin correlates more closely with the Simple Endoscopic Score for Crohn’s disease(SES-CD)than CRP,blood leukocytes, and the CDAI[J].Am J Gastroenterol,2010,105(1):162-169.
14 D’Haens G,Sandborn WJ,Feagan BG,et al.A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis[J].Gastroenterology,2007,132(2):763-786.
15 Sabat R,Ouyang W,Wolk K.Therapeutic opportunities of the IL-22-IL-22R1 system[J].Nat Rev Drug Discov,2014,13(1):21-3g/mL8.
16 Perusina Lanfranca M,Lin Y,Fang J,et al.Biological and pathological activities of interleukin-22[J].J Mol Med(Berl),2016,94(5):523-534.
17 Kim CJ,Nazli A,Rojas OL,et al.A role for mucosal IL-22 production and Th22 cells in HIV-associated mucosal immunopathogenesis[J].Mucosal Immunol,2012,5(6):670-680.
18 Monteleone I,Rizzo A,Sarra M,et al.Aryl hydrocarbon receptor-induced signals up-regulate IL-22 production and inhibit inflammation in the gastrointestinal tract[J].Gastroenterology,2011,141(1):237-248.e1.
19 Zenewicz LA,Yancopoulos GD,Valenzuela DM,et al.Innate and adaptive interleukin-22 protects mice from inflammatory bowel disease[J].Immunity,2008,29(6):947-957.
20 Kawai S,Iijima H,Shinzaki S,et al.Indigo Naturalis ameliorates murine dextran sodium sulfate-induced colitis via aryl hydrocarbon receptor activation[J].J Gastroenterol,2017,52(8):904-919.
