山羊先天免疫基因BCL10克隆、组织表达及真核载体构建分析
2018-05-10俄木曲者熊朝瑞范景胜陈朝康张锡文聂忠源刘世均杨合琴
俄木曲者,熊朝瑞*,范景胜,陈朝康,张锡文,聂忠源,孙 艳,刘世均,杨合琴
(1.四川省畜牧科学研究院,动物遗传育种重点实验室,四川成都 610066;2.四川富顺县农牧业局,四川富顺 643200;3.凉山州畜牧兽医科学研究所,四川西昌 615000;4.四川省六顺农业开发有限公司,四川富顺 643200;5.金川县畜牧兽医服务中心,四川金川 624100)
先天性免疫系统作为初生幼体防御和抵抗外界致病病原体侵染的首要防线,其功能的正常发挥有利于提高山羊羔羊抗病力,增加出生后羔羊存活率。BCL10(B Cell Lymophoma-10)即B细胞淋巴瘤因子10,是机体内一种重要的细胞免疫因子,在初生幼体先天性免疫系统中扮演重要角色[1-2]。最初,BCL10是Willis等[3-5]在研究3例带有t(1:14)(p22, q32)转位的低级MALT淋巴瘤患者时发现。BCL10基因位于染色体lp22,编码约230个氨基酸分子,属于胞内蛋白,其N端存在一个Caspase募集结构域(Caspase Reeruitment Domain,CARD),C端存在一个富含丝氨酸/苏氨酸结构域[1-2,6]。该CARD由6个紧密压缩的反平行的α-螺旋组成,类似于死亡结构域(Death Domain,DD),与H型马疙疹病毒E10基因的部分区域有高度的同源性,存在细胞凋亡调节作用[3,7-8]。正常免疫反应中,BCL10基因能通过编码蛋白活化Caspase-9或者参与LPS/TLR4途径激活NF-κB信号通路,促进免疫系统中细胞成熟、凋亡以及免疫因子的产生,提高机体先天免疫能力,增强抵抗细菌类病原体感染的能力[9-10]。近年来,BCL10先天免疫调控研究在人[5,11]、家牛[12]、猪[13]及鸡[14]中都有所报道,而在山羊上较少。本实验以NCBI中山羊BCL10基因预测序列为模板,通过同源比对、分子克隆等技术获取BCL10基因序列,采用生物信息学预测序列功能,qRT-PCR方法构建初生羔羊各免疫相关器官BCL10基因表达谱,最后构建BCL10基因真核重组载体,为进一步研究山羊BCL10基因功能及蛋白免疫机制提供理论基础,为提高羔羊存活率提供产业指导。
1 材料与方法
1.1 材料
1.1.1 组织来源 对川南黑山羊肥羔型新品系初生羊羔(n=5)颈静脉放血处死,采集肺脏、肝脏、颌下腺、脾脏、肾脏、胸腺和血液样品,保存于液氮中备用。
1.1.2 菌株、载体及细胞来源 大肠杆菌DH5α和pEGFP-N1载体由本实验室提供;pMD1-T Simple购自上海生工生物技术有限公司;HEK293T细胞系由四川省畜牧科学研究院保存和提供。
1.1.3 主要试剂及仪器 RNAsimple Total RNA Kit、FastQuant RT Kit(天根生物技术有限公司),5´RACE System for Rapid Amplification of cDNA Ends Version 2.0试剂盒(Invitrogen公司)、SMARTer™RACE cDNA Amplification Kit试 剂 盒(Clontech公司 ),Power SYBR®Green PCR Master Mix(Applied Biosystems® Cat: 4367659),T4连接酶、TaqDNA聚合酶、限制性内切酶EcoRI、Hind(TakaRa大连公司),质粒提取试剂盒(BioDev公司),LipofiterTM脂质体转染试剂(汉恒生物技术有限公司),胎牛血清、青链霉素双抗(G418)、DMEM高糖细胞培养基(Gibco公司),6孔和24孔细胞培养板(Costar公司)。
凝胶成像系统(美国 BIO-RAD公司)、DYY-8C型电泳仪(北京市六一仪器厂)、CFX Connect™ 荧光定量PCR检测系统(美国 BIO-RAD公司)、高速冷冻离心机(艾本德中国有限公司)、恒温培养箱(上海齐欣科学仪器有限公司)、摇床OLS200(Grant公司)、超净工作台(苏州净化设备有限公司)。
1.1.4 软件和网络资源的利用 本研究中所用到的引物设计、生物信息学分析及统计软件见表1。
1.2 方法
1.2.1 山羊BCL10基因克隆 RNAsimple Total RNA Kit提取初生羔羊脾脏组织RNA,1%琼脂糖凝胶电泳检测总RNA完整性,核酸测定仪测定总RNA纯度及浓度,260/280 nm处的OD比值在1.80~2.00为宜。FastQuant RT Kit反转录形成cDNA。以GenBank中山羊BCL10基因预测序列(登录号:XM_005678157.2)为模板,Primer 5.0软件设计扩增BCL10基因cDNA中间区域引物(BCL10-F,BCL10-R)见表2。扩增BCL10基因,1%琼脂糖凝胶电泳鉴定,胶回收PCR产物与pMD18T进行连接,转化后阳性克隆送上海生工生物工程有限公司测序。

表1 引物设计、生物信息学分析及统计软件
采用5'RACE System for Rapid Ampli fi cation of cDNA Ends Version 2.0试剂盒获得BCL10基因的5'端序列,以前测序cDNA序列为模板,设计5'-UTR引物(表2):A054-1(GSP1),A054-2(GSP2),A054-3(GSP3)。采用 SMARTer™ RACE cDNA Amplification Kit试剂盒获得该基因的3'端序列,设计3'-UTR引物(表2):3'649-1,3'649-2。按照试剂盒操作说明进行BCL10基因5'端序列和3'端序列的扩增,PCR产物经3%琼脂糖凝胶电泳纯化,胶回收PCR产物与pMD18T进行连接,转化后对阳性克隆送上海生工生物工程有限公司测序。
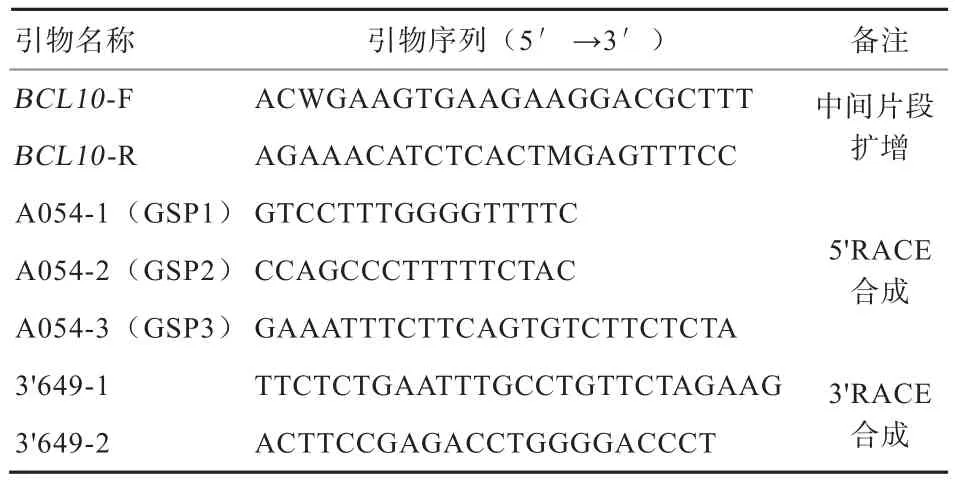
表2 山羊BCL10基因cDNA序列RACE扩增引物序列信息
1.2.2BCL10基因序列生物信息学分析 根据材料1.1.4中生物信息学软件及网络工具,对羔羊BCL10基因完整cDNA序列的氨基酸序列、蛋白质二结构、蛋白结构域、物种同源进化树分析,深入了解和预测BCL10基因的结构和功能。
1.2.3BCL10基因组织表达谱分析 分别取5只系谱无亲缘关系羔羊的肺脏、肝脏、颌下腺、脾脏、肾脏、胸腺及血液各30 mg左右,根据方法1.2.1提取总RNA,反转录形成cDNA。根据已克隆BCL10基因序列为模板,Primer 5.0设 计 引 物( 表 3):BCL10-f,BCL10-r,β-actin-f,β-actin-r。引物由上海生工生物工程技术服务有限公司合成。qRT-PCR反应体系:SsoAdvanced SYBR Green supermix 10 μL、Forward primer(10 μmol/L)0.5 μL、Reverse primer(10 μmol/L)0.5 μL、cDNA 1 μL、RNase-free water 8 μL;反应体系:95℃热变性3 min;95℃ 10 s;55℃ 20 s;72℃20 s,39 个 循 环,75℃延伸5 s。采用2-△△Ct法分析实验数据,并用SPSS18.0进行组织间单因素方差法分析,P<0.05表示组织间差异显著。
1.2.4BCL10基因真核表达载体的构建 以完整BCL10基因序列为模板,PCR扩增BCL10基因CDS全长,上游引物B1的5'端加上BamHⅠ酶切位点;下游引物B2的5'端加上HindⅢ 酶切位点。PEGFP-N1载体经BamHⅠ和PstⅠ双酶切后,加入上述PCR产物,T4连接酶的作用下16℃连接过夜,连接入PEGFP-N1载体构建重组质粒PEGFP-N1-BCL10。然后将构建好的PEGFP-N1-BCL10重组质粒琼脂糖凝胶检测回收并转化到大肠杆菌感受态细胞中筛选阳性克隆,PCR扩增,1%琼脂糖凝胶电泳检测目的条带,上海生工生物工程有限公司测序鉴定。
1.2.5 重组真核质粒转染HEK293T细胞 接种HEK293T细胞于24孔板中,每孔细胞浓度为2×105个/mL,加500 μL不含抗生素的10% FBS DMEM培养基培养过夜;加入1 mL Opti-MEM洗细胞,重复1次,为细胞转染做好准备。以转染PEGFP-N1-BCL10作为实验组、PEGFP-N1作为阴性对照组、未转染作为空白对照组,分别加入50 μL Opti-MEM培养基预混合,再加入1 mL Opti-MEM培养基稀释混匀;取2 μL Lipofectamine®ipofe 脂质体与 50 μL Opti-MEM 培养基稀释混匀,室温孵育5 min;将稀释好的3个实验组质粒与稀释好的脂质体混匀,室温孵育20 min;将混匀的100 μL混合物小心加入到24孔板的细胞孔中,轻轻摇晃细胞板混匀,置于37℃培养箱中培养;转染4~6 h后,将培养基更换为新鲜培养基,继续培养;转染72 h后,通过荧光显微镜观察转染效率。
2 结果与分析
2.1BCL10基因克隆 获得5只初生羔羊脾脏组织总RNA,质量均较好(图1)。选取浓度最高一份RNA反转录cDNA,PCR扩增BCL10基因中段cDNA约为600 bp片段(图2-A)。胶回收,构建质粒测序获得BCL10基因中段cDNA区域包括620 bp。5'RACE和3'RACE由中段向两端扩增分别约为300 bp,构建质粒测序获得BCL10基因5'、3'两端序列各328 bp和322 bp(图2-B和2-C)。3段序列组合拼接得到BCL10基因CDS区域全长693 pb,5'-UTR长度为161 pb,3'-UTR长度为169 bp,cDNA全长为1 023 bp。

图1 羔羊脾脏总RNA琼脂糖凝胶电泳图
2.2BCL10基因生物信息学分析
2.2.1BCL10基因一级结构特征分析 初生羔羊BCL10基因共编码230个氨基酸(图3)。用Expasy在线软件分析结果显示山羊BCL10蛋白的分子量为25 995.3 ku,等电点是5.54,负电荷残基(Asp+Glu)总数为38,正电荷残基(Arg+Lys)总数为32。BCL10蛋白的分子式为C1129H1830N322O366S7,共由3 654个原子组成,不稳定指数为64.15,表明BCL10蛋白是不稳定蛋白,脂溶性指数为79.30,总的平均亲水计算结果为-0.711。由于BCL10蛋白氨基酸末端N残基为甲硫氨酸(Met)满足“N端学说”,所以预测的BCL10蛋白半衰期,在体外哺乳动物网状细胞中为30 h,在酵母体内大于20 h,在大肠杆菌体内大于10 h。

表3 山羊BCL10基因CDS扩增及载体鉴定引物序列信息

图2 羊BCL10基因cDNA扩增产物

图3 初生羔羊BCL10基因cDNA 的完整序列及其编码蛋白的氨基酸序列
2.2.2BCL10基因二级结构预测 用NPS@在线预测BCL10蛋白的二级结构(图4),结果显示氨基酸序列含39.13%的α螺旋(Alpha Helix),5.22%的延伸带(Extended Strand),53.91%的随机卷曲区域(Random Coil),1.74%的模糊区域(Ambiguous States)。

图4 出生羔羊BCL10蛋白二级结构预测
2.2.3BCL10基因定位分析 用NCBI预测的BCL10蛋白序列保守区域(Conserved Domains)结果显示,在17~100 aa左右存在CARD,类似于DD。利用TMHMM Server v.2.0分析BCL10蛋白的跨膜区,结果表明aa属于跨膜区域机率为零,非跨膜蛋白或膜内蛋白(图5)。利用NetPhos软件预测初生羔羊BCL10蛋白磷酸化位点结果,磷酸化电势阈值为0~1,当磷酸化电势位于红线上方即阈值>0.5时,则该位点有可能被磷酸化(图6)。山羊BCL10蛋白的230个氨基酸中,可能被磷酸化的位点一共有29个,包括丝氨酸(Ser)位点20个以及苏氨酸(Thr)位点9,其中丝氨酸接近磷酸电势1的比例最大,这些丝氨酸位点被磷酸化的概率非常大,主要集中在50 aa和150 aa位置。蛋白糖基化位点预测结果发现,山羊BCL10蛋白序列可能含有9个潜在的糖基化位点,分别是4、7、59、136、161、182、186、189、190 aa,当阈值大于0.5时就可能被糖基化,其中161和189氨基酸糖基化的可能性最高,分别为0.628 9和0.627 6。WolFPSORT预测山羊BCL10蛋白细胞定位结果表明,在32个同源较近的蛋白中,细胞核定位值为8.5,细胞质定位值18.5,细胞质和核中都有的定位值为15,胞外定位值为3。说明BCL10蛋白极大可能在细胞质中发挥作用。初生羔羊BCL10蛋白信号肽的预测结果显示,剪切位置分值(C-score)、信号肽分值(S-score)和(Y-score)分值都小于基准阈值0.5,所以山羊BCL10蛋白没有信号肽(图7)。

图5 初生羔羊BCL10蛋白跨膜结构预测

图6 初生羔羊BCL10蛋白磷酸化位点分布

图7 初生羔羊BCL10蛋白信号肽预测
2.2.4BCL10基因进化树分析 用MEGA5.0对10种不同哺乳动物的BCL10蛋白做了进一步同源分析,结果发现山羊BCL10与水牛和绵羊的亲缘关系最近( 图8)。水 牛(GenBank:XP_006080537.1)、 绵 羊(GenBank:XP_004002198.1)、家牛(GenBank:NP_001071496.1)、马(GenBank:XP_001495228.2)、人(GenBank:NP_003912.1)、家兔(GenBank:XP_008263174.1)、野猪(GenBank:NP_001096683.1)、大鼠(GenBank:NP_112618.1)以及小鼠(GenBank:NP_033870.1)之间的同源性分别为53%、41%、100%、100%、39%、35%、99%。
2.3BCL10基因在山羊不同组织中的相对表达量 由图9可知,BCL10基因mRNA在肺脏、肝脏、颌下腺、脾脏、肾脏、胸腺和血液中均有表达,其中颌下腺中表达最高,胸腺次之,其次为肾脏、脾脏、肺脏、肝脏、血液。颌下腺中BCL10基因表达量显著高于肺脏、肝脏、脾脏、肾脏及血液(P<0.05);而与胸腺差异不显著(P>0.05)。胸腺中BCL10基因表达量显著高于血液(P<0.05);与肺脏、肝脏、脾脏及肾脏中表达量差异不显著(P>0.05)。

图8 不同物种BCL10基因进化树

图9 BCL10基因在山羊不同组织中的表达
2.4 真核表达质粒pEGFP-N1-BCL10的鉴定 将构建好的pEGFP-N1-BCL10转化大肠杆菌DH5α,筛选阳性克隆,提取质粒直接进行测序鉴定,测序片段与克隆序列大小完全一致(图10)。说明BCL10基因已经成功插入pEGFP-N1表达载体中,且位置和读码框均正确。
2.5 重组真核质粒转染HEK293T细胞 利用荧光显微镜对转染pEGFP-N1-BCL10质粒的HEK293T细胞从12 h开始进行隔天观察,发现在转染72 h后,转染pEGFP-N1-BCL10实验组和pEGFP-N1阴性对照组均出现绿色荧光,未转染空白对照组细胞无绿色荧光(图11)。证明重组质粒成功转入细胞中并能够正常表达。
3 讨 论

图10 真核重组质粒pEGFP-N1-BCL10中BCL10 CDS凝胶电泳鉴定

图11 pEGFP-N1-BCL10和pEGFP-N1转染HEK293T细胞72 h后显微镜白光和荧光检测(200×)
BCL10基因是哺乳动物及鸟类免疫反应中重要的细胞凋亡调节基因。该基因高表达于淋巴细胞及边缘区域的B细胞,参与黏膜相关淋巴组织(MALT)淋巴瘤的发生发展,能够促进细胞成熟、诱导细胞凋亡等过程[4-5,15]。而此,该基因在机体各个器官中均有表达,且在骨髓、胸腺、脾脏等免疫器官中高表达并发挥重要的免疫作用[16]。相关研究发现,BCL10基因参与免疫系统行使免疫功能首先要通过自身磷酸化实现[8-9],且只有全长转录条件下,才能活化Caspase-9或者介导LPS/TLR4途径激活NF-κB信号通路[17],促进B细胞增殖和成熟从而参与适应性免疫和先天免疫反应[18-19]。
3.1BCL10基因克隆与生物信息学分析 本研究通过初生羔羊脾脏组织中BCL10基因克隆,得到BCL10基因全长1 023 bp,其中CDS为693 bp,编码230个氨基酸。通过生物信息分析发现,BCL10蛋白等电点为正,稳定性较差,脂溶性较高,其预测结果对以后BCL10蛋白质等电点盐析及分离有重要作用。BCL10蛋白的半衰期预测对于后续的体外过表达、干扰等载体构建及检测时间实验提供了参考。二级结构预测结果显示BCL10蛋白没有双链β-螺旋,而存在α-螺旋和无规卷曲结构。膜结合蛋白的纯化结晶难度大,外源表达困难所以分析预测出BCL10属于非膜结合蛋白,此对后续的BCL10基因的蛋白纯化及过表达等研究具有重要的借鉴。糖基化预测和信号肽检测发现,不存在信号肽序列,说明山羊BCL10蛋白不是分泌蛋白,其作用在于细胞内,与已有的研究相似[1-2]。结合山羊BCL10生物信息学预测结果,推断山羊BCL10蛋白是一种在细胞质中合成并停留在胞质内作用的非分泌、非膜结合、N端存在CARD结构域的蛋白。这一结果初步揭开BCL10基因的主要功能结构域所编码的蛋白质的特点,为进一步阐明该基因在山羊免疫系统中扮演的重要角色提供了可靠的参考。同源进化树分析山羊BCL10蛋白与水牛和绵羊的亲缘关系最为接近,无疑为山羊借鉴免疫生理现象找到了可靠的参考家畜类型。
3.2BCL10基因羔羊组织表达比较 本研究结果发现,BCL10基因在羔羊颌下腺表达最高,在其他文献中尚未报道,羔羊出生后由于哺乳原因极大地刺激了唾液腺发育,其中可引起腺体细胞NF-κB信号通路激活,促进细胞成熟和凋亡,而调控此通路的上游基因则有可能是BCL10基因[7,20]。此外,由于颌下腺除了含有大量腺细胞以外,还有部分淋巴细胞,颌下腺快速发育也能促进淋巴细胞增殖,从而伴随有BCL10基因高表达情况[21]。颌下腺位置与淋巴结靠近,可能具有淋巴结相似的免疫功能[5,22-23],但需要进一步证明。此外,胸腺中BCL10基因表达量较高,这与何建锋等[13]在大白猪上发现BCL10基因组织表达谱研究结果基本一致,说明羔羊出生后,胸腺器官在先天免疫过程中起着重要的作用。脾脏、肾脏中的表达则与猪上表达情况有所出入,这可能是由于物种特异性造成的组织器官免疫功能强弱的差异,需要进一步研究。血液中BCL10基因的表达量最低,这可能是由于BCL10基因主要调节和参与B细胞成熟和增殖[7,15,24],从而起免疫应答作用,而游离在血液中的免疫细胞包括嗜酸性粒细胞、嗜碱性粒细胞、淋巴细胞等白细胞,而非免疫B细胞,除非存在血管组织损伤,否则表达极少。
3.3 BCL10重组载体真核表达鉴定 本研究成功地将BCL10基因构建到带有绿色荧光标记的真核表达载体pEGFP-N1中,实现了BCL10蛋白的瞬时表达。由于山羊的pEGFP-N1-BCL10重组表达载体未见报道,该质粒的重组为该蛋白的稳定表达和单克隆抗体的制备与筛选提供了宝贵原始材料,对于后续研究基因功能和指导培育优良抗病的山羊品系具有深远的意义。
4 结 论
本研究首次克隆了山羊BCL10基因序列,并对其生物信息学功能进行了分析,检测了其在免疫相关组织中的表达分布情况,构建了表达重组载体。研究表明了BCL10在山羊中的基本情况,为进一步探索山羊BCL10基因在免疫系统中的作用和功能提供参考价值,同时,对于今后培育优良抗病山羊品种给予指导意义。
参考文献:
[1] Zhang Q, Cui X, Siebert R. BCL10, a novel caspase recruitment domain (CARD)-containing gene, overexpressed in MALT lymphoma with t(1;14) (p22;q32)[J]. Blood, 1998, 92(10): 508.
[2] Yoshida H, Hara H, Nakaya M. Activation of the Syk-CARD9-Bcl10-mediated novel innate immune system is critically involved in defense against leishmania major infection[J].Cytokine, 2012, 59(3): 501.
[3] Willis T G, Jadayel D M, Du M Q. Bcl10 is involved in t(1;14)(p22;q32) of MALT B cell lymphoma and mutated in multiple tumor types[J]. Cell, 1999, 96(1): 35-45.
[4] Sagaert X, Laurent M, Baens M. MALT1 and BCL10 aberrations in MALT lymphomas and their effect on the expression of BCL10 in the tumour cells[J]. Modern Pathology, 2006, 19(2):225-232.
[5] Juilland M, Thome M. Role of the CARMA1/BCL10/MALT1 complex in lymphoid malignancies[J]. Current Opinion In Hematology, 2016, 23(4): 402-409.
[6] Turvey S E, Durandy A, Fischer A. The CARD11-BCL10-MALT1 (CBM) signalosome complex: Stepping into the limelight of human primary immunodeficiency[J]. J All Clin Immunol, 2014, 134(2): 276-284.
[7] Chiarini A, Liu D S, Armato U. Bcl10 crucially nucleates the pro-apoptotic complexes comprising PDK1, PKC zeta and caspase-3 at the nuclear envelope of etoposide-treated human cervical carcinoma C4-I cells[J]. Int J Mol Med, 2015, 36(3):845-856.
[8] Rueda D, Gaide O, Ho L Z. Bcl10 controls TCR- and Fc gamma R-induced actin polymerization[J]. J Immunol, 2007, 178(7):4373-4384.
[9] Ishiguro K, Ando T, Goto H. Bcl10 is phosphorylated on Ser138 by Ca2+/calmodulin-dependent protein kinase II[J]. Mol Immunol, 2007, 44(8): 2095-100.
[10] Wu W, Zhen Z H, Niu T T. κ-Carrageenan enhances lipopolysaccharide-induced interleukin-8 secretion by stimulating the Bcl10-NF-kappa B pathway in HT-29 Cells and Aggravates C. freundii-induced inflammation in mice[J]. Media Inflamm,2017, 2017: 8634865.
[11] Dyer M J S, Price H P, Jadayel D M. In response to Fakruddin et al. and Apostolou et al[J]. Cell, 1999, 97(6): 686-688.
[12] Lee M A, Keane O M, Glass B C. Establishment of a pipeline to analyse non-synonymous SNPs in Bos taurus[J]. BMC Genomics, 2006, 7:298.
[13] 何建锋, 张彦明, 段会娟. 人天然免疫基因BCL10的猪同源物的识别、克隆与初步表达分析[J]. 遗传, 2008(6): 747-754.
[14] 孙柏, 李燕丽, 张亚杰. 鸡BCL10基因的克隆与表达[J]. 中国兽医学报, 2011(4): 533-538.
[15] Tibiletti M G, Martin V, Bernasconi B. BCL2, BCL6, MYC,MALT 1, and BCL10 rearrangements in nodal diffuse large B-cell lymphomas: a multicenter evaluation of a new set of fluorescent in situ hybridization probes and correlation with clinical outcome[J]. Human Pathology, 2009, 40(5): 645-652.
[16] Vito P, Stilo R. 1999-2014: 15 years of BCL10[J]. Immunol Lett, 2014, 160(1): 102-103.
[17] Tian M T, Gonzalez G, Scheer B. Bcl10 can promote survival of antigen-stimulated B lymphocytes[J]. Blood, 2005, 106(6):2105-2112.
[18] Yoneda T, Imaizumi K, Maeda M. Regulatory mechanisms of TRAF2-mediated signal transduction by Bcl10, a MALT lymphoma-associated protein[J]. J Biol Chem, 2000, 275(15):11114-11120.
[19] Xue L Q, Morris S W, Orihuela C. Defective development and function of Bcl10-deficient follicular, marginal zone and B1B cells[J]. Nature Immunol, 2003, 4(9): 857-865.
[20] Moreno-Garcia M E, Sommer K, Rincon-Arano H. Kinaseindependent feedback of the TAK1/TAB1 complex on BCL10 turnover and NF-kappa B activation[J]. Mol Cell Biol, 2013,33(6): 1149-1163.
[21] Nguyen C Q, Gao J H, Kim H. IL-4-STAT6 signal transductiondependent induction of the clinical phase of Sjogren's Syndrome-like disease of the nonobese diabetic mouse[J]. J Immunol, 2007, 179(1): 382-390.
[22] Tibiletti M, Martin V, Bernasconi B. Bcl2, Bcl6, MYC,MALT 1 and Bcl10 rearrangements in nodal diffuse large B-cell lymphomas: A multicenter evaluation of a new set of fish probes and correlation with clinical outcome]J]. Annals Oncology, 2008, 19: 168-169.
[23] 朱建华, 李佳宜, 李维善. 枸杞多糖干预糖尿病大鼠颌下腺组织中核因子κB的表达[J]. 中国组织工程研究, 2012(42):7940-7944.
[24] Ma Y, Liao Z W, Xu Y. Characteristics of CARMA1-BCL10-MALT1-A20-NF-kappa B expression in T cell-acute lymphocytic leukemia[J]. Eur J Med Res, 2014, 19:62.
