原花青素对猪精液常温保存效果的影响
2018-05-10胡亚美孙敬春梁国栋褚瑰燕杨公社
胡亚美,刘 斌,孙敬春,梁国栋,褚瑰燕,杨公社*
(1.西北农林科技大学动物科技学院,陕西杨凌 712100;2.大荔县众康家畜良种繁育有限公司,陕西大荔 715103)
目前,国外主要集中于对猪精液冷冻保存的理论研究[1-2],而国内对生产实践中的常温保存为主要研究趋势。由于猪精子质膜上多不饱和脂肪酸含量丰富,当遇到活性氧族(ROS)攻击时,易发生脂质过氧化反应,造成精子氧化应激,使其失去受精能力[3]。正常情况下,精浆中含有抗氧化物质,足以维持ROS产生和清除之间的平衡,但在精液稀释保存的过程中,精浆中抗氧化物质浓度降低,平衡被打破,ROS无法及时有效地被清除,使精子产生氧化损伤。因此,在精液稀释保存过程中需要添加适量的抗氧化剂,增强精子的抗氧化能力,尽可能降低ROS对精子造成的伤害是很有必要的。
近年来,天然抗氧化剂作为一类无毒、安全的抗氧化剂逐渐引发关注,其具有重要的生物活性。谢东祺等[4]研究发现,茶多酚、维生素C都能有效提高猪精液保存效果。原花青素(OPC)是一种生物类黄酮,是目前发现的具有较强生物活性的天然抗氧化剂,其抗氧化能力虽亚于虾青素,但优于维生素C和维生素E,且其提取相对容易,生物利用安全性较高[5]。本实验在经典猪精液稀释液BTS中添加不同浓度的OPC,并在保存过程中检测猪精子抗氧化相关指标,分析OPC对猪精液常温保存效果的影响,筛选出适宜的OPC添加浓度,为促进猪精液稀释粉的产业化发展提供理论参考,为开发具有我国自主知识产权的稀释粉奠定基础。
1 材料与方法
1.1 精液来源 本实验所用精液采自杨凌西北农林科技大学畜牧教学实验基地3头健康的12月龄关中黑猪,使用手握法采精,收集射精中段富集精子部分,滤纸过滤后置于保温瓶中,30 min内带回实验室,所采原精活力镜检达0.8以上,气味和色泽正常者方可进行后续实验。
1.2 试剂 原花青素,纯度≥95%,为上海源叶生物科技有限公司产品;葡萄糖、二水合柠檬酸三钠、氯化钾、乙二胺四乙酸(EDTA)、碳酸氢钠为广东光华科技股份有限公司产品;总抗氧化能力(T-AOC)试剂盒(100 T/50样)、丙二醛(MDA)试剂盒(100 T/50样)为南京建成科技有限公司产品。
1.3 仪 器设备 17℃恒温箱(1005c,康佳电器有限公司);猪精液计算机辅助分析系统(CASA)(HVIE-SSW V8.0,福州鸿视野软件技术有限公司);精子密度分析仪(Modelo V11,葡萄牙艾普森(北京)有限公司)多功能酶标仪(Synergy H1,美国伯腾仪器有限公司)等。
1.4 BTS稀释液的配制 配方:葡萄糖37.15 g/L,柠檬酸钠6.00 g/L,EDTA 1.25 g/L,碳酸氢钠1.25 g/L,氯化钾0.75 g/L,用电子天平准确称量后配制成BTS基础稀释液。
1.5 精 液稀释与保存 将采集的公猪精液与稀释液在水浴锅内平衡10 min(温度差不超过1℃),再将稀释液沿瓶壁或者玻璃棒缓慢倒入精液中,精液与稀释液按1:4的比例稀释,稀释期间需轻轻晃动或用玻璃棒沿一个方向搅拌,使其混合均匀。稀释后的精子密度为1.85亿/mL,然后将稀释好的精液分装到已灭菌的10 mL离心管中,用毛巾包裹后放置在17℃恒温箱中避光保存,保存过程中除每次检测外不翻动离心管。
1.6 实验设计 实验分8组,以配制的BTS基础稀释液为对照组,设置7个实验组,即基础液中分别添加10、20、30、40、50、60、70 µg/mL OPC。17℃ 保存,每隔24 h检测1次精子活率、顶体和质膜完整率,每隔48 h检测1次T-AOC和MDA含量,实验重复3次。
1.7 精子常规指标检测 精子活率利用计算机辅助精液分析系统(CASA)检测;质膜完整性利用精子尾部低渗肿胀实验,各组精子每隔24 h测定1次;检测精子顶体完整率使用异硫氰酸荧光素-花生凝集素(FITCPNA)荧光染料对精子进行染色镜检,每隔24 h检测实验各组顶体完整率。实验全程避光操作。
1.8 精子生化指标检测 T-AOC活性和MDA含量严格按照说明书步骤进行测定和计算。
1.9 统计分析 利用SPSS 23.0软件对实验所得数据进行单因素方差分析(One-way ANOVA),处理结果均以平均值±标准差表示。P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 BTS基础稀释液中添加OPC对猪精子活率的影响由表1可知,将OPC添加到BTS基础稀释液中,第0天和第1天的精子活率与对照组无显著差异(P>0.05);第2天对照组的精子活率与10 µg/mL OPC组差异不显著(P>0.05),而显著低于其余实验组(P<0.05);第3~5天对照组精子活率均显著低于7个实验组(P<0.05);第 5天添加 30、40、50、60 µg/mL OPC组精子活率显著高于其他实验组(P<0.05)。
2.2 BTS基础稀释液中添加OPC对猪精子质膜完整性的影响 由表2可知,第0天,实验组与对照组的精子质膜完整率无显著差异(P>0.05),随着保存时间的延长,各组间的精子质膜完整性开始出现差异。第3天,40 µg/mL OPC组的精子质膜完整率最高且显著高于对照组和 10 µg/mL OPC 组(P<0.05)。第 4~5 天,50 µg/mL OPC组精子质膜完整率最高且显著高于对照组(P<0.05)。当OPC添加量从10 µg/mL增加至50 µg/mL时,精子质膜完整率呈上升趋势,大于50 µg/mL后开始下降,当添加量增至70 µg/mL时,与对照组基本无显著差异(P>0.05)。由此可见,添加一定量OPC可保护精子质膜,但当浓度过高时,保护作用减弱。
2.3 BTS基础稀释液中添加OPC对猪精子顶体完整性的影响 由表3可知,第0天,20 µg/mL OPC组顶体完整率最高,且显著高于对照组和10 µg/mL OPC组(P<0.05)。第1天,添加50 µg/mL OPC组顶体完整率最高。从第3天开始,对照组和10 µg/mL OPC组的精子顶体完整性与其余组差异显著(P<0.05)。第5天,对照组顶体完整率已趋近70%,且显著低于7个实验组(P<0.05)。整体而言,OPC添加量为50 µg/mL时顶体完整率最高,相对于40 µg/mL OPC组可更稳定地保护精子顶体完整性。
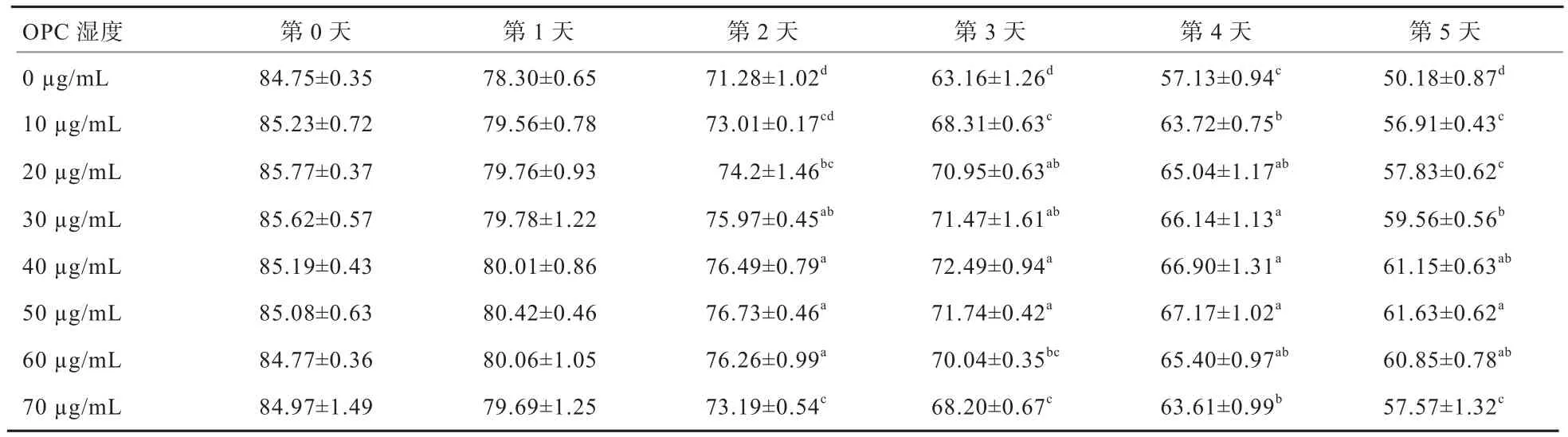
表1 BTS基础稀释液中添加OPC对精子活率的影响 %
2.4 BTS基础稀释液中添加OPC对猪精子T-AOC和MDA浓度的影响 由表4可知,随着BTS基础稀释液中OPC添加浓度增大,精子T-AOC活性越强。但第5天,对照组和10、20 µg/mL OPC组的T-AOC活性显著低于其他实验组(P<0.05),且添加量为70 µg/mL时活性最高,为1.44 U/mL。稀释精液中MDA含量随OPC添加量的增加而减少,第5天,70 µg/mL OPC组的MDA含量最低,且显著低于对照组和10、20、30、40 µg/mL OPC 组(P<0.05)。
3 讨 论
3.1 OPC对猪精子活率、质膜和顶体完整性的影响 猪精液稀释和保存过程中无法完全隔绝空气,在17℃保存条件下,精子活动频率减慢,但仍会耗能和代谢。此过程中,精子尾部中段大量的线粒体负责供能的同时,会产生ROS,少量ROS是精子生存所必需的,但积累过量会引发其产生脂质过氧化物(LPO)。精子中除线粒体外,质膜也是内源性ROS主要来源之一[6]。
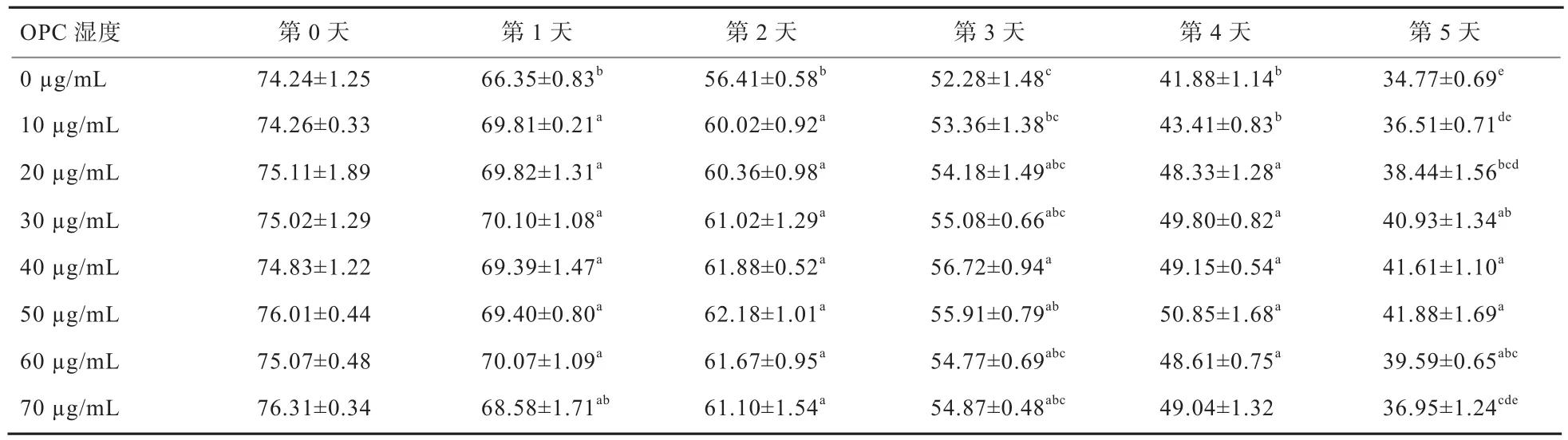
表2 BTS基础稀释液中添加OPC对精子质膜完整性的影响 %
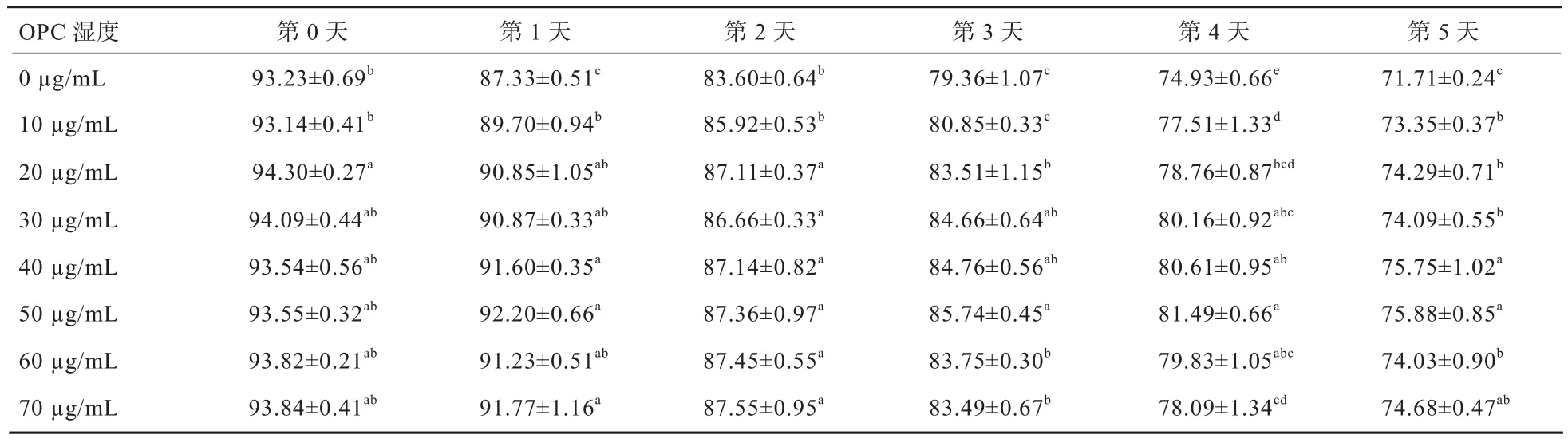
表3 BTS基础稀释液中添加OPC对精子顶体完整性的影响 %
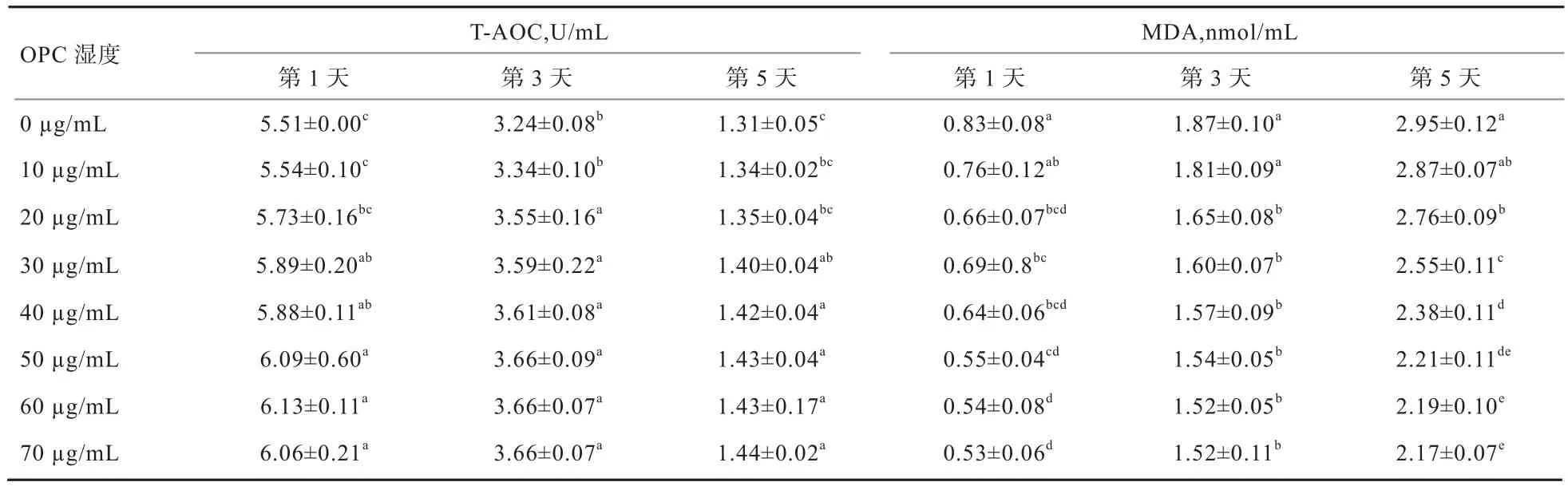
表4 BTS基础稀释液中添加OPC对精子T-AOC和MDA的影响
本实验发现,猪精液常温保存过程中添加OPC可显著提高精子活率、质膜完整性和顶体完整性,且添加量为50 µg/mL时效果最佳,这一结果与孙艳青等[7]在猪冷冻精液中添加OPC所得结果类似,但在常温保存精液中所需添加浓度略高。产生此差异的原因可能是猪精液冷冻保存过程较复杂,需经过离心、降温、升温等一系列长时间的操作,且在冷冻前会添加冷冻保护剂以减少降温造成的精子机械损伤[8]。冷冻保护剂的添加使得添加40 µg/mL OPC即可清除多余的ROS[7]。但在常温保存环境中,精子代谢持续进行,会产生更多的ROS,且无其余保护剂的协助效应,所以需要添加较多的OPC来清除过量的ROS。因此,在常温保存过程中添加50 µg/mL OPC才有较佳的效果。本实验中,质膜完整率变化随着OPC添加浓度的增加呈先上升后下降的趋势,可能是由于精液在常温保存前期,稀释液中有害物质积累较少,随保存时间的延长,死精子数增加,少量抗氧化剂已不能及时清除产生的ROS,需增大OPC添加量以应对氧化应激;当添加的OPC浓度超过50 µg/mL之后,可能会引发精子凋亡,反而会降低精子质膜的完整性。
本实验中顶体完整率同质膜完整率变化趋势相似,精子顶体是特化细胞器,包裹在精子头部,内含用于穿破透明带的水解酶[9]。当顶体受损后,由于顶体酶、透明质酸酶等提前释放,精子失去穿卵能力,无法与卵细胞结合完成受精,同时很快失去运动能力。精子质膜发生损伤,短时间内不会对精子造成严重影响,主要是由于质膜破损对精子尾部中段运动供能相关蛋白影响有限,不会给精子造成毁灭性打击[10]。本实验结果显示,顶体完整率>精子活率>质膜完整率,可印证上述观点。因此,添加适量OPC有助于猪精液常温保存,但过量添加会引发精子凋亡,导致精子活率、质膜和顶体完整性降低等。
3.2 OPC对猪精液中T-AOC活性及MDA含量的影响公猪的生殖系统包括由酶[超氧化物歧化酶(SOD)、磷脂过氧化氢谷胱甘肽过氧化物酶(PHGPx)、硫氧还蛋白酶(TRX)、硫氧还蛋白过氧化物酶(PRDX)、对氧磷酶1型(PON-1)和2型(PON-2)]和低分子量的抗氧化剂(L-谷胱甘肽或L-麦角硫因)组成的特殊抗氧化系统[11]。在正常情况下足以维持精液环境中的氧化-抗氧化平衡,但外界环境变化会打破原有的活动秩序,引发脂质过氧化反应,造成精子损伤。ROS的产生会诱导浆细胞构象和完整性发生不可逆损伤,造成DNA损伤并加速细胞凋亡[12]。
本实验结果显示,精子T-AOC随OPC添加浓度升高而增加,MDA含量随添加量升高而降低,与Zhang等[13]在猪精液常温保存中所得结果类似。LPO代谢产生MDA类有害物质越多,精子抗氧化能力越低,受损越严重。综合分析其原因有可能是添加天然抗氧化剂OPC到稀释液中,其结构中的酚性羟基能在液体环境中产生H+,H+作为无电子不稳定的离子,会抢夺自由基上的电子以达到稳定结构,并使自由基失活,降低精子线粒体膜和脂质膜的脂质过氧化反应,保证了精子发挥功能的完整性;另一方面,在本实验中,添加OPC会使精子T-AOC活性增强,且添加量为70 µg/mL时活性最高,在保存第5天时可达1.44 U/mL。可能是由于OPC的添加激活了精液中的SOD、PHGPx、TRX等的活性,从而增强了精子T-AOC活性来保护精子免受氧化应激的损伤。但在此过程中涉及更深层次的机制,还有待进一步研究。
4 结 论
在常温保存稀释液中添加OPC可显著提高猪精液常温保存时间和常温保存质量。当添加量为50 µg/mL时,保存效果最佳,在第5天精子活率、质膜和顶体完整率分别达61.63%、41.88%和75.88%时,T-AOC浓度为1.43 U/mL、MDA含量为2.37 nmol/mL。
参考文献:
[1] Estrada E, Rodriguez-Gil J E, Rocha L G,et al.Supplementing cryopreservation media with reduced glutathione increases fertility and proli fi cacy of sows inseminated with frozen-thawed boar semen [J]. Andrology, 2014, 2(1): 88-99.
[2] Wysocki P, Orzolek A, Strzezek J,et al.The activity of N-acetylbeta-hexosaminidase in boar seminal plasma is linked with semen quality and its suitability for cryopreservation[J].Theriogenology , 2015, 83(7): 1194-1202.
[3] 杜立银, 刘铁铮, 鲁金波. 抗氧化剂在猪精液冷冻保存技术中的应用[J]. 中国畜牧杂志, 2008, 44(1): 47-50.
[4] 谢东淇, 杨公社, 胡建宏, 等. 茶多酚对猪精液常温保存效果的影响[J]. 西北农林科技大学学报(自然科学版), 2017,45(6): 24-29.
[5] 张慧文, 张玉, 马超美. 原花青素的研究进展[J]. 食品科学,2015, 36(5): 296-304.
[6] Sabeti P, Pourmasumi S, Rahiminia T,et al.Etiologies of sperm oxidative stress[J]. Iran J Reprod Med, 2016, 14(4): 231-240.
[7] 孙艳青, 李青旺, 耿果霞, 等. 葡萄籽原花青素对猪精液冷冻保存效果的研究[J]. 家畜生态学报, 2016, 37(5): 46-51.
[8] 刘彪, 逯心玉, 刘忠华, 等. 精浆对猪精子冷冻效果影响的研究[J]. 中国畜牧兽医, 2012, 39(11): 161-164.
[9] 崔晶晶, 李蒙蒙, 董海涛, 等. 猪精子获能、顶体反应及冷休克对顶体酶抑制剂的影响[J]. 畜牧与兽医, 2014(7): 40-43.
[10] 李涛, 熊前, 吴衍, 等. 精液质量评定方法[J]. 黑龙江动物繁殖, 2013, 21(3): 13-15,43.
[11] Orzolek A, Mietelska K, Wysocki P. Function of the antioxidant system in boar semen[J]. Med Weter, 2016 , 72(5): 291-297.
[12] Valcarce D G, Robles V. Effect of captivity and cryopreservation on ROS production in Soleasenegalensis spermatozoa[J].Reproduction, 2016, 152(5): 439-446.
[13] Zhang X, Liu Q, Hu J,et al.Effects of glutathione on sperm quality during liquid storage in boars[J]. Anim Sci J , 2016,87(10): 1195-1201.
