5个繁殖候选基因在香猪卵巢和子宫中的差异表达
2018-05-10易凡利王嘉福张福平阮亦麒唐靓婷冉雪琴
易凡利,王嘉福,2*,张福平,阮亦麒,唐靓婷,毛 宁,冉雪琴*
(1.贵州大学动物科学学院,农业生物工程研究院,贵州贵阳 550025;2. 铜仁学院,贵州铜仁 554300)
繁殖性状尤其是多产性状是生猪养殖业中重要的经济性状,近年来国内外众多学者在繁殖性状的基础研究和应用方面开展了卓有成效的工作,为提高猪种的产仔数发挥了重要的作用。繁殖力是评估生猪养殖业生产效益的重要指标,对猪产仔数性状的选育和改良是猪育种工作的主要目标之一[1-2]。根据遗传育种学家Chris Haley的计算,如果母猪的产仔数每胎能提高1头,英国就可以从生猪养殖业中每年增加7亿英镑的额外收入,而整个欧盟国家则可多获利至少20亿欧元[3]。
香猪是在一个独特的自然生态条件和地理环境中,通过低水平的饲养管理方式以及长期的人工和自然近交选育形成的优良地方猪品种[4]。然而,香猪较低的繁殖率限制了这种小型猪产业的发展,而且香猪繁殖力的调控机理尚未明确。
贵州香猪主产于贵州省从江县的宰便、加鸠、加勉、加榜、光辉、刚边、秀塘、东朗等8个乡镇,近年来对贵州从江香猪的研究主要集中在生长性能、屠宰性能、繁殖性能等经济性状,以及个别基因的多态性分析[5-6]。迄今为止,国内外运用大白猪、长白猪、五指山猪、陆川猪、藏猪、太湖猪、荣昌猪等猪种进行的关联研究发现,猪繁殖性能的主效基因有ESR基因[7]、LHP基因[8]、MP7基因[9]等,而对于β-微精浆蛋白(MSMB)、前列腺素F2α受体(PTGFR)、分泌性白细胞蛋白酶抑制因子(SLPI)、抑制素A(INHA)、人纤溶酶原激活物抑制剂1(SERPINE1)基因与繁殖性状的相关性研究尚少。前期研究中,本课题组从香猪卵巢转录组测序结果中筛选出5个候选基因,即MSMB、PTGFR、SLPI、INHA、SERPINE1,具有差异表达现象(待发表)。在此基础上,本研究通过检测5个基因在发情与未发情时期香猪卵巢和子宫组织中的表达变化,探讨这些基因对香猪卵巢和子宫是否具有调节作用。
1 材料与方法
1.1 实验动物及组织样品采集 实验所用的香猪卵巢和子宫组织采自贵州大山地生态养殖有限责任公司。随机选择发情期与未发情期的6月龄母香猪各3头,屠宰后,无菌采取卵巢和子宫,装入冷冻管,投入液氮中保存备用。
1.2 组织样品总RNA的提取及cDNA的合成 取-80℃冻结的50~100 mg组织样品迅速转移至用液氮预冷的研钵中,用研杵研磨组织直至成粉末,参照天根生化科技(北京)有限公司的RNAsimple总RNA提取试剂盒(DP419)提取总RNA。用NanoDrop2000(Thermo)对提取的RNA进行质检,RNA纯度通过计算OD260/280(介于1.90~2.10)进行评估,RNA的完整性通过1%琼脂糖凝胶电泳进行检测。反转录采用Promega生产的 -GoscriptTMReverse Transcription Mix,Oligo(dT)试剂盒,按照操作说明书完成cDNA的合成。
1.3 荧光定量PCR 利用在线Primer3.0设计引物,用Unafold(http://www.dtdna.com/UNAFOld)检验发夹结构,用Primer-BLAST(http://www.ncbi.n/m.nih.gov/tools/primer-blast)分析引物的特异性。由英潍捷基(上海)贸易有限公司合成引物(表1)。荧光定量PCR检测用天根SYBR®Green试剂盒,反应在CFX96 Connect TM(Bio-Rad)荧光定量PCR仪上进行,根据试剂盒操作说明进行扩增。每个样品做3个重复。表1中qPCR扩增效率是用倍比稀释的重组质粒为模板,荧光定量PCR仪的分析软件(Bio-Rad)绘制的曲线计算而来。
1.4 统计分析 目标基因在各组织中的表达水平采用2-△△Ct法进行相对定量。以管家基因GAPDH为内参。用SPSS软件进行t检验分析基因的差异表达。P<0.01表示差异极显著,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 香猪卵巢组织中基因的差异表达 由图1可见,SLPI、INHA、SERPINE1、MSMB、PTGFR基因在香猪卵巢组织中发情与未发情时期均有表达。INHA基因发情时期的表达水平是未发情时期的12倍(P<0.01);SLPI基因发情时期的表达水平是未发情时期的5倍(P<0.05);MSMB在卵巢组织中发情时期的表达量显著低于未发情期(P<0.05);SERPINE1基因、PTGFR基因在发情时期与未发情时期的表达水平差异不显著(P>0.05)。
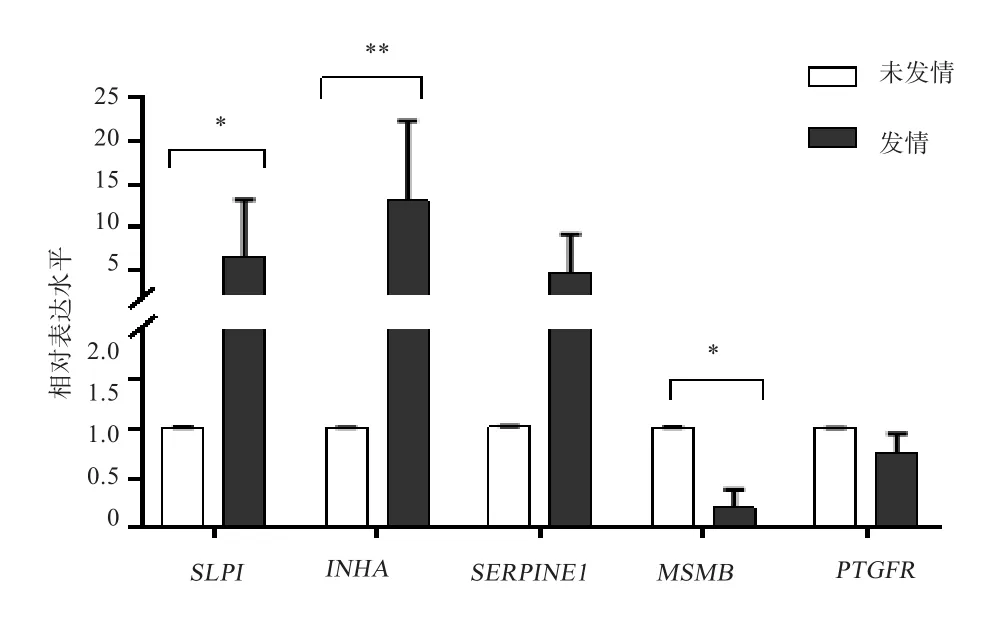
图1 5个基因在发情、未发情时期香猪卵巢组织中的差异表达
2.2 香猪子宫组织中基因的差异表达 相对于未发情时期(图2),SLPI基因在发情期子宫组织中的表达量极显著升高(P<0.01);INHA、MSMB、PTGFR基因在发情期子宫的表达量显著下降(P<0.05);SERPINE1基因的表达水平变化不明显(P>0.05)。

表1 荧光定量PCR引物序列及相关信息

图2 5个基因在发情和未发情期香猪子宫组织中的差异表达
3 讨 论
在母畜中,INHA的主要来源是卵巢,由卵巢的颗粒细胞和睾丸间质细胞分泌,在子宫中也有表达[10]。抑制素与性腺、子宫等组织的功能紊乱及妊娠的维持有密切关系[11]。猪卵泡中INHA在排卵前的表达量升高,中卵泡的表达水平低于大卵泡[12]。抑制素还有控制卵泡的发生、卵母细胞的成熟以及调节胚胎发育的作用[13]。本文检测到INHA基因在发情期香猪卵巢中的表达水平极显著高于未发情期;而在发情期子宫组织中的表达水平下降,说明该基因在香猪发情期的生理过程中,可能促进卵巢的生理功能、抑制子宫的功能。
SERPINE1和SERPINE2同属于丝氨酸蛋白酶抑制剂(SERPIN)超家族。研究表明[14],SERPINE2是胎盘和子宫中主要的纤溶酶原激活剂(PA)的抑制剂。应用HPRL和HPRL+Kp作用于小鼠卵泡[15],SERPINE1的表达水平变化不大。高催乳素血症可明显促进小鼠的排卵数,却抑制女性卵泡的发育[16]。肾上腺素通过AngⅡ刺激SERPINE1基因的表达,从而影响子宫内膜基质细胞的蜕膜化[17]。可见,SERPINE1基因与PRLr、PA、AngⅡ之间可能存在着一定的联系。本研究结果显示,发情期SERPINE1基因的表达量在卵巢中升高、子宫中下降,但均未达显著水平,说明该基因对卵巢、子宫生理功能的影响可能不大。
PTGFR是PGF2α的一个特异性受体,PGF2α通过PTGFR发挥生物学作用,其受体广泛存在于肝脏、卵巢、子宫等的细胞膜上[18],参与卵巢排卵和子宫分娩活动。在母猪怀孕期间以及子宫内膜植入期间,PGF2α的旁分泌和自分泌作用受PTGFR的调控[19-20],PTGFR在优势卵泡和从属卵泡中的表达量无显著差异[21]。猪胚胎植入期子宫内膜中PTGFR的表达量高于植入前,且仅在子宫内膜上皮细胞中高表达[20]。本文的研究证实,发情与未发情时期香猪卵巢中PTGFR基因的表达水平无显著差异,发情时期子宫中该基因的表达水平上调。提示PTGFR基因可能主要调控香猪子宫的功能。
MSMB是一种富含二硫键的低分子量蛋白质,是精液的主要成分,在生殖系统和黏膜中强烈表达,抑制精子的活力[22]。在高产、低产约克夏母猪中鉴定出SCARB1、MSMB等基因与繁殖力和产仔数相关[23],MSMB可能是滤泡闭锁的标记[24]。本研究结果显示,无论在香猪卵巢组织中还是在子宫组织中,MSMB在发情时期的表达水平均低于未发情时期。推测MSMB基因可能对香猪卵巢和子宫的功能有调节作用。
SLPI是一种由黏膜被覆上皮细胞、巨噬细胞、中性粒细胞等分泌的上皮特异性丝氨酸蛋白酶抑制剂,存在于各种黏膜分泌液中,通过自分泌和旁分泌系统在细胞增殖和分化过程中起作用,且控制胚胎发育因子的表达[25],SLPI在人子宫肌层中表达并在分娩后增加[26]。特别是在胚胎着床的动态重塑期间,SLPI与P4存在相互作用[27]。从本研究结果来看,发情时期香猪卵巢、子宫组织中的表达水平均显著高于未发情时期,推测该基因可能影响香猪卵巢和子宫的生理功能。
本研究结果提示,INHA、SLPI、MSMB基因在香猪卵巢、子宫中均起到调节作用,而PTGFR仅在子宫中起调控作用,相关机理有待深入研究。
参考文献:
[1] 赵志超, 黄涛, 李大全. 猪繁殖相关性状遗传标记研究进展[J]. 猪业科学, 2011, 28(8):46-48.
[2] 罗仍卓么. 北京黑猪10个基因的多态性与产仔性状的关联分析[D]. 杨凌: 西北农林科技大学, 2008.
[3] 王高峰, 贾青. 与猪产仔数有关基因的研究进展[J]. 上海畜牧兽医通讯, 2008(1):15-16.
[4] 欧阳维民, 刘艳. 香猪成了香饽饽[N]. 中国质量报, 2013-03-07(007).
[5] 申学林, 杨秀江, 韦胜权. 从江香猪生长发育繁殖性能测定[J]. 中国畜禽种业, 2007(11):39-41.
[6] 吴敏, 杨正德, 许万里, 等. 贵州从江香猪体成分沉积规律与肉质营养特性[J]. 贵州农业科学, 2010, 38(3): 121-123.
[7] 王林云. 中国地方猪种的现状、保护和对它们的研究策略[J].猪业科学, 2009, 26(11):28-31.
[8] 陈克飞, 黄路生, 李宁, 等. 猪雌激素受体(ESR)基因对产仔数性状的影响[J]. 遗传学报, 2000(10):853-857.
[9] 秦楠. 猪BMP7基因启动子多态性及其与繁殖性状关联性分析[D]. 郑州: 河南农业大学, 2011.
[10] Mylonas I, Makovitzky J, Richter D U,et al. Expression of the inhibin-alpha subunit in normol, hyperplastic and malignant endometrial tissue: An immunohistochemical analysis[J].Gynecol Oncol, 2004, 93(1):92-97.
[11] Luisi S, Florio P, Reis F M,et al. Inhibins in female and male reproductive physiology: role in gametogenesis, conception,implantation and early pregnancy[J]. Hum Reprod Update,2005, 11(2): 123-135.
[12] Guthrie H D, Rohan R M, Rexroad C E Jr,et al. Changes in concentrations of follicular inhibin alpha and beta A subunit messenger ribonucleic acids and inhibinimmunoactivity during preovulatory maturation in the pig[J]. Biol Reprod, 1992,47(6):1018-1025.
[13] Sirotkin A V. Cytokines:Signalling molecules controlling ovarian functions[J]. Int J Biochem Cell Biol, 2011, 43(6):857-861.
[14] Chern S R, Li S H, Lu C H,et al. Spatiotemporal expression of the serine protease inhibitor, SERPINE2, in the mouse placenta and uterus during the estrous cycle, pregnancy, and lactation[J].Reprod Biol Endocrinol, 2010, 8:127.
[15] 郭美君. 高泌乳素血症通过Kiss1/GPR54系统影响小鼠卵泡发育及排卵[D]. 南昌: 南昌大学, 2016.
[16] Mostafapour S, Zare S, Sadrkhanlou R A,et al. Sulpirideinduced hyperprolactinemia in mature female rats: evidence for alterations in the reproductive system, pituitary and ovarian hormones[J]. Int J Fertil Steril, 2014, 8:193-206.
[17] Lumbers E R, Wang Y, Delforce S J,et al. Decidualisation of human endometrialstromal cells is associated with increased expression and secretion of prorenin[J]. Reprod Biol Endocrinol, 2015, 13:129.
[18] Tsuboi K, Sugimoto Y, Ichikawa A. Prostanoid receptor subtypes[J].Prostaglandins Other Lipid Mediat, 2002, 68-69:535-556.
[19] Liang Z, Sooranna S R, Engineer N,et al. Prostaglandin F2-alpha receptor regulation in human uterine myocytes[J]. Mol Hum Reprod, 2008, 14(4): 215-223.
[20] Kaczynski P, Waclawik A. Effect of conceptus on expression of prostaglandin F2[alpha] receptor in the porcine endometrium[J]. Theriogenology, 2013, 79(5):784-790.
[21] 孟金柱. 牛卵泡发育相关基因表达的研究[D]. 太谷: 山西农业大学, 2014.
[22] Jenq H, Liu K M, Chang W C. Puri fi cation and characterization of reversible sperm motility inhibitors from porcine seminal plasma[J]. Biochem Biophys Res Commun, 1993, 191(2):435-440.
[23] 黄龙. 基于卵巢RNA组学鉴定影响猪产仔数性状的候选基因及microRNA[D]. 合肥: 安徽农业大学, 2016.
[24] Terenina E, Fabre S, Bonnet A,et al. Differentially expressed genes and gene networks involved in pig ovarian follicular atresia[J]. Physiol Genomics, 2017, 49(2):67-80.
[25] Kim H S, Ha K S, Kwon H C,et al. Enhancing the developmental competence of the early embryo using secretory leukocyte peptidase inhibitor[J]. Differentiation, 2016, 92(1-2):24-34.
[26] Li A, Lee R H, Felix J C,et al. Alteration of secretory leukocyte protease inhibitor in human myometrium during labor[J].Am J Obstet Gynecol, 2009, 200(3):311.e1-311.e10.
[27] Davoodi S, Cooke R F, Fernandes A C,et al. Expression of estrus modifies the gene expression profile in reproductive tissues on day 19 of gestation in beef cows[J]. Theriogenology,2016, 85(4):645-655.
