青海黑果枸杞原花青素对小鼠光老化皮肤的保护作用
2018-05-09陶丛敏马文宇罗文娟
陶丛敏,冶 娟,马文宇,罗文娟
人的皮肤老化主要表现为自然衰老和光老化两种形式[1]。由内源性因素引起的皮肤老化,多表现为正常的皮纹加深,皮肤干燥变薄、失去弹性、松弛和粗糙[2]。光老化主要是由于皮肤在急性或长期反复由紫外线(UV)照射引起,主要变化包括皱纹深乱粗深、色素沉着、癌前病变等[3,4]。本研究主要通过观察青海黑果枸杞原花青素对D-半乳糖皮下注射联合UV照射引起的小鼠光老化模型皮肤组织中氧化应激水平和凋亡蛋白的变化,以及血清中炎性因子的改变,了解黑果枸杞原花青素对光老化皮肤的保护作用。
1 材料与方法
1.1 材料
1.1.1 动物 健康SPF级昆明种雌性小鼠50只,45 d龄,体质量18~22 g,购自西安交通大学实验动物中心[0001209]。
1.1.2 主要实验试剂和设备 青海黑果枸杞原花青素粉末(西安万方生物);维生素E粉末(北京索莱宝);D-半乳糖(北京索莱宝);UV[长波紫外线(UVA)+中波紫外线(UVB)]光疗仪(南京卡知电子科技有限公司);UVB 和UVA 型UV 辐照度监视器(台湾路昌);活性氧(ROS)、过氧化氢酶(CAT)试剂盒(南京建成生物工程研究所);Bax、Bcl-2酶联免疫吸附试验(ELISA)试剂盒(武汉伊莱瑞特生物公司);白细胞介素(IL)-1、IL-6、肿瘤坏死因子(TNF)-α ELISA试剂盒 (武汉基因美生物科技有限公司);X-Mark型BIO-RAD酶标仪(BIO-RAD公司),TGrinder电动组织研磨器(北京天根生化科技有限公司),SIGMA 3K15离心机(Sigma公司),恒温鼓风干燥箱(上海琅玕实验设备有限公司)。
1.2 方法
1.2.1 动物分组 将50只小鼠随机分为5组,正常组、模型组、维生素E组、黑果枸杞原花青素低剂量组50 mg/(kg·d)、黑果枸杞原花青素高剂量组(100 mg/(kg·d),每组 10只,并做好标记。
1.2.2 动物饲养 小鼠每10只放入一笼饲养,在相同的自然环境下(昼夜交替12 h)饲养1 周,常规饲食和饮水,无不良因素影响,使其适应实验室环境后开始进行实验。
1.2.3 脱毛 所有小鼠适应性喂养1周后,用6%的硫化钠脱毛剂除去表面毛发,暴露约5×5 cm大小的皮肤,视毛发生长情况进行脱毛。
1.2.4 照光 第2周开始,除正常组外,每组颈背部皮下注射5%D-半乳糖10 ml/(kg·d),同时进行UV照射。将小鼠放入自制照射盒中,并置于距离光源( UVA + UVB) 40 cm 处的水平面上,隔日照射1 次,每次40 min。每次照射前灯管预热15 min,且照射前均测光强度,初次正式照射前,先测定最小红斑量及光照射强度,累计照射40 d(UVA 照射剂量累计为98.4 J,UVB 辐照剂量累计为 78.4 J)。
1.2.5 给药与处理 造模第11天开始,黑果枸杞原花青素低剂量组和黑果枸杞原花青素高剂量组按剂量[50 mg/(kg·d)和100 mg/(kg·d)]灌胃黑果枸杞原花青素,正常组和模型组则每日灌胃等体积的生理盐水,维生素E组每只给予维生素E滴剂0.5 ml,连续用药30 d。
1.2.6 取材 实验第42天,所有小鼠行眼球取血,置于1.5 ml EP管中室温静置1 h,2 500 r/min,离心15 min后取上清,于-80℃保存,进行IL-1、IL-6、TNF-α检测。取照光处皮肤(刮除皮下脂肪),在冰冻的生理盐水中漂洗,冷冻于-80℃冰箱制备成10%皮肤组织匀浆,放入离心机以3 500 r /min离心15 min。取组织上清进行保存于-80℃冰箱,进行ROS、CAT 活力及 Bax 、Bcl-2 含量检测[7]。
1.2.7 指标检测 酶生化法测定皮肤组织ROS及CAT 活力,按上述方法处理皮肤组织后严格按照说明书检测ROS及CAT 活力。采用ELISA检测各组小鼠皮肤组织中Bax 、Bcl-2及血清中IL-1、IL-6、TNF-α的含量。按试剂盒说明书步骤操作,以450 nm 测A值,以A值为纵坐标,以标准品浓度为横坐标,绘制标准曲线,采用Curve Expert 1.4软件对标准曲线进行拟合。根据样品A值在标准曲线上计算样本的浓度 。
1.3 统计学方法
采用 Excel 2003录入实验数据,采用 SPSS 20.0软件包对数据进行统计分析,计量资料以均数 ±标准差(±s)表示,组间比较采用方差分析,两两比较采用LSD-t检验,P< 0.05 为有统计学意义。
2 结果
2.1 肉眼观察小鼠皮肤变化
正常组小鼠皮肤光滑、细嫩、无皱纹,而随着UV的照射,模型组小鼠皮肤粗糙增厚,并有皱纹及脱屑、瘀点和瘀斑,经黑果枸杞原花青素治疗后的小鼠皮肤出现一定改善,其皮肤脱屑较模型组减少,皮肤接近正常,而经过维生素E治疗的小鼠,虽然皮肤有所改善,但没有使用黑果枸杞原花青素明显(图1)。
2.2 肉眼观察皮下血管变化
正常组小鼠皮下血管正常,淡红色,无充血及瘀点;模型组小鼠皮下血管扩张,呈暗红色,出现结节和瘀点;原花青素组的小鼠皮下血管有轻度充血,少量结节,但随着剂量的增大,皮下血管的变化接近正常;维生素E组小鼠皮下血管充血较模型组减轻,但没有原花青素组改变的明显(图2)。
2.3 小鼠皮肤组织抗氧化指标活力和凋亡蛋白含量测定及小鼠血清炎性因子含量测定
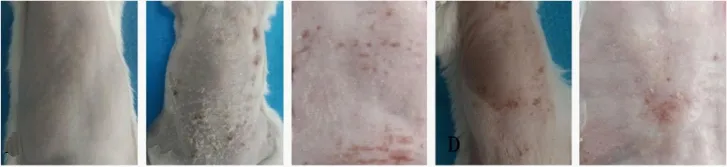
图1 5组小鼠皮肤外观
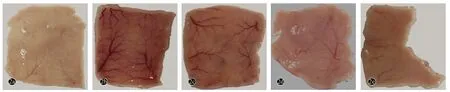
图2 5组小鼠皮肤血管镜下所见
2.3.1 小鼠皮肤组织抗氧化指标活力测定 与正常组相比,模型组ROS活力显著升高,CAT 活力显著下降,差异具有统计学意义(P<0.05);与模型组比较,原花青素低、高剂量组ROS下降,CAT 活力升高,差异具有统计学意义(P<0.05);与维生素E组比较,原花青素低、高剂量组ROS活力下降及CAT活力升高更加明显,差异具有统计学意义(P<0.05)(表 1)。
表1 各组小鼠皮肤组织ROS、CAT活力比较 ( ±s)
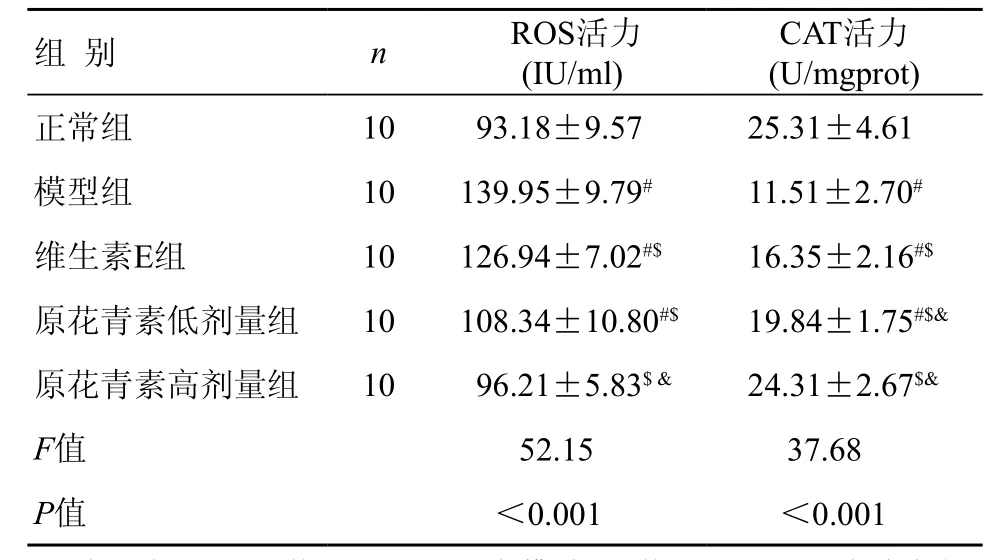
表1 各组小鼠皮肤组织ROS、CAT活力比较 ( ±s)
注:与正常对照组比较,#P<0.05;与模型组比较,$P<0.05;与维生素E组比较,&P<0.05
组 别 n ROS活力(IU/ml)CAT活力(U/mgprot)正常组 10 93.18±9.57 25.31±4.61模型组 10 139.95±9.79# 11.51±2.70#维生素E组 10 126.94±7.02#$ 16.35±2.16#$原花青素低剂量组 10 108.34±10.80#$ 19.84±1.75#$&原花青素高剂量组 10 96.21±5.83$ & 24.31±2.67$&F值 52.15 37.68 P值 <0.001 <0.001
2.3.2 皮肤组织凋亡因子含量表达情况 空白对照组Bax表达水平较低,Bcl-2表达升高;与正常组比较,模型组Bax的表达水平显著上调,Bcl-2表达降低,差异具有统计学意义(P< 0.05);与模型组比较,原花青素低、高剂量组Bax表达水平较低,Bcl-2表达水平显著升高,差异具有统计学意义(P<0.05);与维生素E组比较,原花青素低、高剂量组的Bax表达水平降低,Bcl-2表达水平上调更加明显,差异具有统计学意义(P< 0.05)(表2)。
表2 各组小鼠皮肤组织Bax、Bcl-2含量比较 ( ±s)
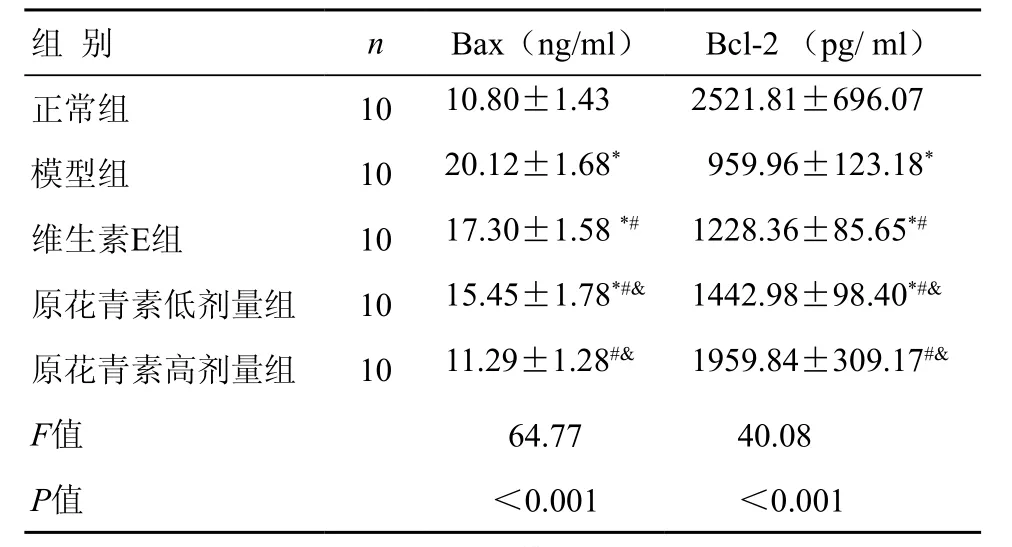
表2 各组小鼠皮肤组织Bax、Bcl-2含量比较 ( ±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与维生素E组比较,&P<0.05
组 别 n Bax(ng/ml) Bcl-2 (pg/ ml)正常组 10 10.80±1.43 2521.81±696.07模型组 10 20.12±1.68* 959.96±123.18*维生素E组 10 17.30±1.58 *# 1228.36±85.65*#原花青素低剂量组 10 15.45±1.78*#& 1442.98±98.40*#&原花青素高剂量组 10 11.29±1.28#& 1959.84±309.17#&F值 64.77 40.08 P值 <0.001 <0.001
2.3.3 小鼠血清炎性因子含量检测结果 与正常组比较,模型组IL-1、IL-6、TNF-α的含量显著上调,差异具有统计学意义(P<0.05);与模型组比较,原花青素低、高剂量组IL-1、IL-6、TNF-α含量降低,差异具有统计学意义(P<0.05);与维生素E组比较,原花青素低、高剂量组IL-1、IL-6、TNF-α含量明显降低,差异具有统计学意义(P<0.05)(表3)。
3 讨论
黑果枸杞为茄科枸杞属,在我国主要分布于宁夏、青海、新疆、内蒙古、陕西、甘肃和西藏等地,而青海地区特殊的地理及气候条件使黑果枸杞种植较多,并且其原花青素的含量要高于其他地区[5]。楼舒婷等[6]对黑果枸杞活性成分和挥发性组分进行了研究,详细阐述了黑果枸杞在饮食、保健方面的应用价值,而对于其抗氧化成分的研究主要集中在黄酮、多糖、多芬类,对原花青素抗氧化、延缓衰老方面的研究尚少[7]。本文通过对黑果枸杞原花青素对光老化皮肤的抗氧化作用,进一步探讨了黑果枸杞在延缓衰老方面的机制。
表3 各组小鼠血清IL-1、IL-6、TNF-α含量比较( ±s)(pg/ml)
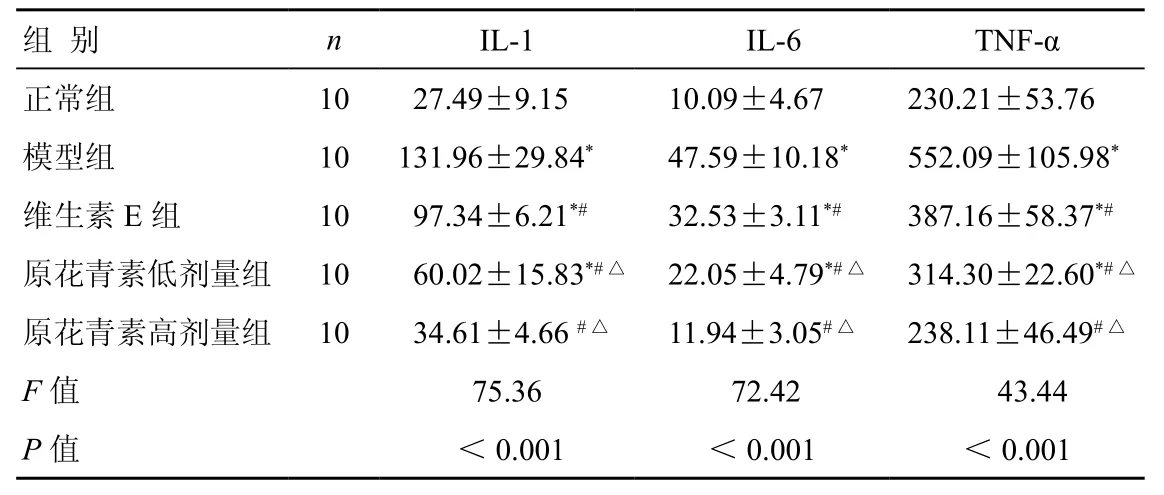
表3 各组小鼠血清IL-1、IL-6、TNF-α含量比较( ±s)(pg/ml)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与维生素E组比较,△P<0.05
组 别 n IL-1 IL-6 TNF-α正常组 10 27.49±9.15 10.09±4.67 230.21±53.76模型组 10 131.96±29.84* 47.59±10.18* 552.09±105.98*维生素E组 10 97.34±6.21*# 32.53±3.11*# 387.16±58.37*#原花青素低剂量组 10 60.02±15.83*#△ 22.05±4.79*#△ 314.30±22.60*#△原花青素高剂量组 10 34.61±4.66 #△ 11.94±3.05#△ 238.11±46.49#△F值 75.36 72.42 43.44 P值 <0.001 <0.001 <0.001
由于人体的皮肤老化受多种因素的影响,外源性因素是UV长期照射皮肤造成光老化,日光中UV主要由UVB(波长290~320 nm)和UVA(波长320~400 nm)组成,其中UVB是造成皮肤损伤的主要原因[8]。然而,日光中UVA与UVB是不可能分隔的,许多研究还表明UVA有加强UVB的作用,诱导多种细胞发生凋亡与皮肤衰老密切相关。D-半乳糖可引起氧化应激,使细胞清除自由基的能力下降,细胞发生一系列退行性变化,呈现衰老状态[9]。
以往的研究大多集中在细胞水平,本实验采用复合光源(UVB+UVA)模拟日光,联合D-半乳糖皮下注射建立光老化动物模型,更符合人体皮肤老化的生理过程。UV照射后,皮肤组织中会产生大量ROS,正常情况下皮肤角质形成细胞内产生超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和CAT等,均可对活性氧簇的释放起到一定的抵御作用。大量UV照射后,体内各种抗氧化酶的活性降低,从而致使细胞内线粒体损伤以及核内DNA链断裂等,促使一些炎性因子的释放[10]。再次,UV照射后,线粒体产生ROS水平升高,也可通过自噬途径增加ROS水平, 进一步致细胞凋亡甚至变性坏死。Bax、Bcl-2是细胞凋亡的主要凋亡蛋白,UV照射后,线粒体通透性改变,细胞色素C释放,凋亡蛋白增加[11-13];另一方面,二者比例也对细胞凋亡起着调节作用。UV照射后,NF-K B信号通路被激活,真皮(基质金属蛋白酶)MMPs表达增加,炎性因子IL-1、IL-6、TNF-α表达水平增高,最终增强光老化作用[14-17]。
本实验中,与正常组的结果比较显示,经紫外线照射后,小鼠皮肤表面干燥、粗糙、脱屑,出现皱纹,皮下血管扩张、充血,并伴有结节和瘀点。模型组皮肤组织中ROS活力显著升高,CAT 活力显著下降;Bax的表达水平显著上调,Bcl-2水平降低;血清炎性因子IL-1、IL-6、TNF-α表达水平增高;说明光老化模型造模成功;经黑果枸杞原花青素灌胃后,与维生素E组相比,原花青素低、高剂量组小鼠皮肤组织中ROS活力显著下降,CAT 活力显著升高;Bax的表达水平显著下调,Bcl-2水平上调;血清IL-1、IL-6、TNF-α表达水平降低,说明黑果枸杞原花青素对其表达有抑制作用,且随着给药浓度的增加,作用逐渐加强,表明其抗光老化可能存在浓度依赖。
本实验结果显示,黑果枸杞原花青素对皮肤光老化有一定的改善作用,其机制可能与黑果枸杞原花青素抑制细胞内活性氧产生,降低线粒体通透性,抑制细胞色素C释放,抑制细胞凋亡,减轻炎症反应相关。通过此实验,为黑果枸杞抗衰老、美容养颜功效产品的研制提供理论依据。
【参 考 文 献】
[1]Fisher GJ, ang S, arani J, et al. Mechanisms of photoaging and chronological skin aging [J]. Arch Dermatol, 2002, 138 (11):1462- 1470.
[2]Imayama S, Ueda S, lsoda M. Histologic changes in the skin of hairless mice following peeling with saiicvlic acid [J]. Arch Dermatol,2000, 136(11):1390-1395.
[3]Agbai ON, Buster K, Sanchez M, et al. Skin cancer and photo-protection in people of color: a review and recommendation for physicians and the public [J]. J Am Acad Dermatol, 2014, 70(4):748-762.
[4]吴淑莲, 喻碧鸾, 李晖, 等. IPL作用下鼠皮形态改变的显微观察与初步分析 [J]. 激光生物学报, 2006, 15 (3):249-252.
[5]汪洋, 丁龙, 王四清. 不同产地黑果枸杞中原花青素和花青素含量研究 [J]. 食品工业科技, 2016, 37(13):122-124.
[6]楼舒婷. 黑果枸杞的活性成分和挥发性组分研究 [D]. 浙江大学, 2015.
[7]陈晨, 文怀秀, 赵晓辉, 等. 黑果枸杞色素中原花青素含量测定 [J].光谱实验室, 2011, 28(4):1767-1769.
[8]Song KC, Chang TS, Lee H, et al. Processed panax ginseng, sun ginseng increases type I collagen by regulating MMP-1 and TIMP-1 expression in human dermal fibroblasts [J]. J Ginseng Res, 2012, 36(1):61-71.
[9]Terra VA, Souza-neto FP, Pereira RC, et al. Time-dependent reactive species formation and oxidative stress damage in the skin after UVB irradiation [J]. J Photochem Photobiol B, 2012,109 (2): 34-41.
[10]吕燕红. 枸杞叶总黄酮对UVB照射致无毛小鼠皮肤光损伤的防护作用研究 [D]. 兰州大学, 2016.
[11]Czarny P, Pawlowska E, Bialkowskawarzecha J, et al. Autophagy in DNA damage response [J]. Int J Mol Sci, 2015, 16(2):2641.
[12]Yao R, Tanaka M, Misawa E, et al. Daily Ingestion of aloe vera gel powder containing aloe sterols prevents skin photoaging in OVX hairless mice [J]. J Food Sci , 2016, 81(11):H2849-H2857.
[13]Pandel R, Poljak B, Godic A. Skin photoaging and the roleof antioxidants in its prevention [J]. ISRN Dermatol, 2013:930164.
[14]王莹. Caspase-3、Bax、Bcl-2和Beclin-1在慢性紫外线损伤小鼠模型表皮角质形成细胞中的表达及意义 [D]. 天津医科大学, 2012.
[15]Kyung-AH, Yi BR, Kyung-Chul C. Molecular mechanisms and in vivo mouse models of skin aging associated with dermal matrix alterations [J]. Lab Anim Res, 2011, 27(1):1-8.
[16]Youn HJ, Kim KB, Han HS, et al. 23-Hydroxytormentic acid protects human dermal fibroblasts by attenuating UVA-induced oxidative stress[J]. Photodermatol Photoimmunol Photomed, 2017, 33(2):92-100.
[17]Park JE, Pyun HB, Woo SW, et al. The protective effect of Kaempferia parviflora extract on UVB-induced skin photoaging in hairless mice [J]. Photodermatol Photoimmunol Photomed, 2014,30(5):237-245.
