替米沙坦对血透合并继发性甲亢患者钙磷代谢的影响
2018-05-09唐君平黄洁平张魁正曾晓琳
唐君平,黄洁平,张魁正,何 敏,曾晓琳
(汕头大学附属粤北人民医院肾内科,广东 韶关 512026)
继发性甲状旁腺功能亢进(SHPT)已成为慢性肾脏病(CKD)患者常见的并发症之一。循环中持续高水平的全段甲状旁腺激素(iPTH)可引起钙磷代谢紊乱,主要表现为骨痛、骨骼畸形、皮肤瘙痒、转移性钙化,严重影响患者的生活质量,增加慢性肾脏病患者的心血管病死率和全因病死率。SHPT的治疗有药物、手术和介入三种方式[1]。肾素-血管紧张素系统(RAS)在各种慢性肾脏病进展中起重要作用,因此阻断RAS可延缓慢性肾脏病的进展[2]。目前在一些动物模型中已证实Ang Ⅱ能够通过Ang Ⅱ-HuR-COX-2途径抑制COX-2的表达,降低iPTH的水平[3]。本文选择于汕头大学附属粤北人民医院规律行血透患者,观察替米沙坦对人体iPTH分泌的影响。
1 资料与方法
1.1 资料来源
选取2015年6月至2016年12月在本院接受规律血透并继发甲亢的患者57例,男30例,女27例;年龄28~82(57.7±16.3)岁,透析龄≥半年。排除标准:严重感染;全身衰竭;重度营养不良;明确的恶性肿瘤,预期生存<3个月;其他脏器功能严重异常;消化道出血、明显的消化道症状;精神及意识障碍。
按治疗方法的不同将57例患者分为治疗1组、治疗2组和对照组。3组性别、年龄、BMI、透析龄比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院医学伦理委员会批准,患者均自愿参与并签署知情同意书。

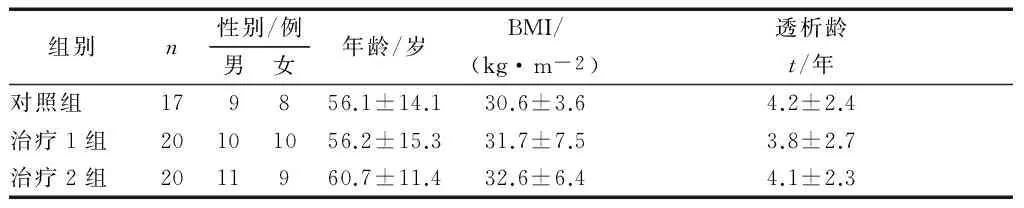
组别n性别/例男女年龄/岁BMI/(kg·m-2)透析龄t/年对照组179856.1±14.130.6±3.64.2±2.4治疗1组20101056.2±15.331.7±7.53.8±2.7治疗2组2011960.7±11.432.6±6.44.1±2.3
1.2 治疗方法
3组透析时间均为3次·周-1,4 h·次-1。对照组予口服骨化三醇0.25~0.75 μg,3 次·周-1,透析日晚间口服。在对照组的基础上:治疗1组加服替米沙坦40 mg·次-1,1次·d-1;治疗2组口服替米沙坦80 mg·次-1,1次·d-1。
1.3 观察指标
检测3组患者治疗前及治疗6个月后的血清iPTH、钙及磷水平,并观察不良反应发生情况及时处理并记录。血清钙、血清磷用全自动生化分析仪测定;血清iPTH用化学发光法测定。
1.4 统计学方法
2 结果
2.1 3组治疗前、治疗6个月后各生化指标比较
治疗前,3组患者血清iPTH、钙及磷水平的差异无统计学意义(P>0.05)。治疗6个月后,治疗1组、2组较对照组血清iPTH、磷水平明显降低,而血清钙含量较对照组升高(均P<0.05);治疗2组血清iPTH、磷水平较治疗1组降低,而血清钙治疗1组升高(均P<0.05),见表2。


组别n时间钙c/(mmol·L-1)磷c/(mmol·L-1)iPTHc/(pmol·L-1)对照组17治疗前2.36±0.341.85±0.3236.45±4.93治疗6个月后1.97±0.222.25±0.2977.94±10.75治疗1组20治疗前2.31±0.311.84±0.3231.65±6.80治疗6个月后2.16±0.25*2.04±0.21*62.58±13.84*治疗2组20治疗前2.33±0.281.77±0.2732.51±6.45治疗6个月后2.35±0.23*△1.85±0.21*△52.00±9.36*△
*P<0.05与对照组治疗6个月后比较;△P<0.05与治疗1组治疗6个月后比较。
2.2 3组不良反应发生情况
不良反应类型为咳嗽,患者症状轻微,未行特殊处理。对照组、治疗1组不良反应1例,不良反应发生率为5%,治疗2组不良反应2例,不良反应发生率为10%。3组不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨论
SHPT患者主要表现为钙、磷、甲状旁腺激素(PTH)代谢紊乱,其中低钙、高磷血症被认为是SHPT发生、发展的重要因素,因此SHPT的治疗应首先纠正低钙、高磷血症,进而控制PTH的分泌。SHPT治疗中应定期监测血钙、血磷水平以调整治疗方案[4]。
ACEI与ARB在各种肾脏疾病中有着广泛应用。目前大家对ACEI与ARB在肾脏疾病中的作用途径普遍认知是:通过对肾小球血流动力学的特殊调节作用——扩张入球小动脉和出球小动脉,但对出球小动脉的扩张强于入球小动脉,降低肾小球内高压、高灌注和高滤过。越来越多的证据表明ARB除降压作用外,还有降低患者蛋白尿水平及肾脏保护作用[5-6]。
环氧化酶是花生四烯酸合成各种内源性前列腺素(PGs)过程中的限速酶。而前列腺素对PTH的分泌有抑制作用[7]。COX-2在正常肾脏有少量表达,而高表达于甲状旁腺细胞(PG)。
RNA结合蛋白人类抗原R(HuR)是胚胎致死异常视觉(ELAV)基因家族成员,主要表达于细胞核中,与COX-2的3′UTR结合,使得细胞中COX-2的表达水平上调[8-9]。而COX-2在炎症进程中起着重要作用[10]。HuR可促进细胞中COX-2的表达水平上调[9],而COX-2选择性抑制剂可抑制PG组织内COX-2表达上调,并抑制PG增生[11]。血管紧张素可直接刺激肾脏系膜细胞、肾脏纤维母细胞增殖,影响TGF-β、HuR、促炎症基因环氧化酶-2(COX-2)等细胞因子的表达,导致肾脏纤维化[12-13]。所以,理论上Ang Ⅱ能够通过Ang Ⅱ-HuR-COX-2途径抑制COX-2的表达,降低iPTH的水平。已有研究[3,14]显示通过Ang Ⅱ抑制COX-2的表达,可以减轻肾脏纤维化和甲状旁腺增生。
本研究选取的3组患者均每周进行3次血液透析治疗。治疗1组、2组在骨化三醇常规治疗的基础上,分别加用替米沙坦40、80 mg。3组于治疗前及治疗6个月后采集血液,测定血清全段甲状旁腺激素(iPTH)、钙及磷水平。结果表明,治疗6个月后,治疗1组、2组较对照组血清iPTH、磷水平明显降低,而血清钙含量高于对照组(均P<0.05);治疗2组血清iPTH、磷水平较治疗1组降低,且血清钙高于治疗1组(均P<0.05)。提示替米沙坦可改善尿毒症患者继发性甲状旁腺功能亢进,并且其作用与剂量可能有一定的关系。
参考文献:
[1] 张凌.继发性甲状旁腺功能亢进的治疗策略[J/OL].中华肾病研究电子杂志,2015,4(3):1-5[2017-07-07].http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_zhsbyjdzzz201503003.
[2] 王艳军.血管紧张素Ⅱ转化酶抑制剂联合激素治疗儿童肾病综合征效果观察和TGF-β1检测价值分析[J/OL].中华临床医师杂志(电子版),2014,8(4):786-788[2017-07-13].http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_zhlcyszz201404044.
[3] 梁彩霞,张燕林.缬沙坦对尿毒症大鼠继发性甲旁亢及肾脏纤维化的影响[D].厦门:厦门大学,2014.
[4] Young E W,Albert J M,Satayathum S,et al.Predictors and consequences of altered mineral metabolism:the Dialysis Outcomes and Practice patterns Study[J].Kidney Int,2005,67(3):1179-1187.
[5] Liakos C I,Vyssoulis G P,Markou M I,et a1.Twenty-four-hour urine ctl-microglobulin as a marker of hypertension-induced renal impairment and its response on different blood pressure-lowering drugs[J].J Clin Hypertens(Greenwich),2016,18(10):1000-1006.
[6] Wang Y,Peng W,Zhang X,et al.The association of ACE gene polymorphism with diabetic kidney disease and renoprotective efficacy of valsartan[J].J Renin Angiotensin Aldosterone Syst,2016,17(3):1-6.
[7] Bell C D,Vidal S,Kovacs K,et al.Cox-2 expression in the oxyphilic cells of the normal,hyperplastic,and adenormatous parathyroid gland[J].Endocr Pathol,2004,15(1):29-38.
[8] Doller A,Gauer S,Sobkowiak E,et al.Angiotensin Ⅱ induces renal plasminogen activator inhibitor-1 and cyclooxygenase-2 expression post-transcriptionally via activation of the mRNA-stabilizing factor human-antigen R[J].Am J Pathol,2009,174(4):1252-1263.
[9] Olsen S R.Taxanes and COX-2 inhibitors:form molecular pathways to clinical practice[J].Biomed Pharmacother,2005,59S 2:S306-S310.
[10] Alhouayek M,Muccioli G G.COX-2-derived endocannabinoid metabolites as novel inflammatory mediators[J].Trends Pharmacol Sci,2014,35(6):284-292.
[11] Zhang Q,Qiu J,Li H,et al.Cyclooxygenase 2 promotes parathyroid hyperplasia in ESRD[J].J Am Soc Nephrol,2011,22(4):664-672.
[12] Clarke N E,Turner A J.Angiotensin-converting enzyme 2:the first decade[J].Int J Hypertens,2012,2012:307315.
[13] Doller A,Gauer S,Sobkowiak E,et al.Angiotensin Ⅱ induces renal plasminogen activator inhibitor-1 and cyclooxygenase-2 expression post-transcriptionally via activation of the mRNA-stabilizing factor human-antigen R[J].Am J Pathol,2009,174(4):1252-1263.
[14] Siver J,Naveh Many T.FGF-23 and the parathyroid[J].Springer US,2012,728:92-99.
