血尿酸水平与糖尿病周围神经病变相关性研究
2018-05-09蒋凤秀陆泽元张华清庄雄杰
蒋凤秀,陆泽元,曾 玲,余 颖,张华清,庄雄杰
(1.中山大学附属第八医院内分泌科;2.深圳市南山区西丽人民医院内分泌科,广东 深圳 518033)
近年来,随着饮食结构和生活方式的改变,高尿酸血症(HUA)和2型糖尿病(T2DM)的发病率呈现逐年升高趋势。糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是T2DM最常见微血管并发症之一,是导致糖尿病足的重要危险因素[1]。目前国内外糖尿病防治指南均未将HUA作为DPN的风险因素,但临床研究发现血尿酸(SUA)水平升高与糖尿病血管病变关系密切[2],故推测高SUA亦可能是DPN的风险因素之一。本研究旨在探讨SUA水平与DPN患病率的相关性。
1 资料与方法
1.1 研究对象
入选标准:1)1999年世界卫生组织标准确诊的T2DM患者;2)完成一般资料采集和各项生化检查,并由专业人员完成神经电生理检查的T2DM患者。
排除标准:1)2型糖尿病急性并发症、妊娠糖尿病、1型糖尿病、严重肝功能损害、严重感染、急性心脑血管事件患者;2)无其他可以引起神经病变的病因(包括感染、遗传疾病、自身免疫疾病、营养不良、理化损伤等);3)近期无使用可改变SUA水平的药物史(包括嘌呤醇、非布司他、苯溴马隆)。
回顾性分析2014年5月至2017年5月在中山大学附属第八医院内分泌科住院的T2DM患者临床资料,入选患者共448例(男289例,女159例)。根据SUA四分位法对患者进行分组,其中男性:Q1组(SUA<290 μmol·L-1)、Q2组(290 μmol·L-1≤SUA<345 μmol·L-1)、Q3组(345 μmol·L-1≤SUA<404 μmol·L-1)、Q4组(SUA≥404 μmol·L-1);女性:Q1组(SUA<262 μmol·L-1)、Q2组(262 μmol·L-1≤SUA<319 μmol·L-1)、Q3组(319 μmol·L-1≤SUA<374 μmol·L-1L)、Q4组(SUA≥374 μmol·L-1)。
1.2 诊断标准
DPN诊断标准:1)1999年世界卫生组织标准确诊的T2DM患者;2)使用keypoint型号肌电诱发电位仪检测:检测项目包括上肢的正中神经、尺神经的运动传导速度(MCV)和感觉传导速度(SCV);下肢的腓总神经MCV与腓浅神经SCV、胫神经H反射以及尺神经f波,以上神经肌电图检测结果中出现一项异常。
1.3 资料收集
收集患者一般资料,包括年龄、性别、饮酒史、吸烟史、疾病史(包括糖尿病、高血压、高脂血症、痛风、HUA的诊断以及治疗情况),测量收缩压(SBP)、舒张压(DBP)、身高、体质量、腰围,计算BMI。采用B-eckman AU5800全自动生化学分析仪测定空腹血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、SUA、血肌酐(Scr)。采用Tosoh HLC-723-G7全自动糖化血红蛋白分析仪测定糖化血红蛋白(HbA1c)。采用CKD-EPI公式[3]计算eGFR,即男:Scr≤80 μmol·L-1,eGFR=141×(Scr/80)-0.411×0.993年龄;Scr>80 μmol·L-1,eGFR=141×(Scr/80)-1.209×0.993年龄;女:Scr≤62 μmol·L-1,eGFR=144×(Scr/62)-0.329×0.993年龄;Scr>62 μmol·L-1,eGFR=144×(Scr/62)-1.209×0.993年龄。
1.4 统计学方法

2 结果
2.1 男女不同组别临床资料比较
448例患者中DPN患病率为38.6%(173/448)。男性DPN患病率为38.4%(111/289),Q1、Q2、Q3、Q4组DPN患病率分别为23.6%(17/72)、38.9%(28/72)、41.7%(30/72)、49.3%(36/73)。随着SUA水平的升高,男性BMI、TG、DPN发病率呈递增趋势,HbA1c、eGFR均呈递减趋势(P<0.01 或P<0.05)。女性DPN的患病率为39.0%(62/159),Q1、Q2、Q3、Q4组DPN患病率分别为23.1%(9/39)、27.5%(11/40)、47.5%(19/40)、57.5%(23/40),女性的腰围、BMI、TG、DPN发病率呈递增趋势,eGFR均呈递减趋势(P<0.01或P<0.05)。
2.2 Logistics二元回归分析DPN的影响因素
以DPN为因变量,以HbA1c、FPG、糖尿病病程、性别、年龄、吸烟史、饮酒史、BMI、腰围、TC、TG、HDL-C、LDL-C、SBP、DBP、SUA、eGFR、UACR、高血压患病率、口服降压药物百分比、口服他汀类降脂药百分比为自变量,行Logistics二元回归分析,结果显示,糖尿病病程、HbA1c、SUA是男性DPN的独立危险因素(表1),糖尿病病程、HbA1c、SUA、SBP是女性DPN的独立危险因素(表2)。
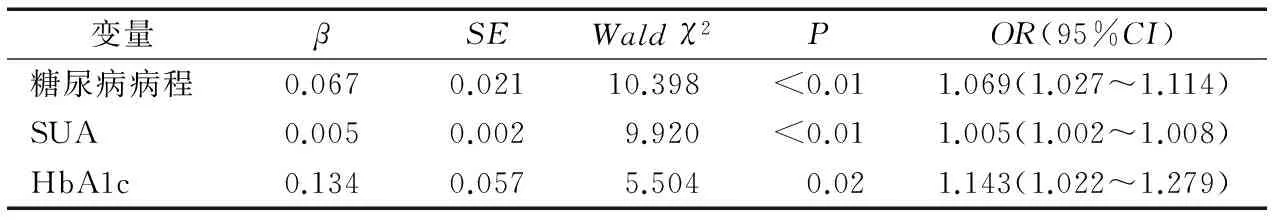
表1 Logistics二元回归分析男性DPN的影响因素
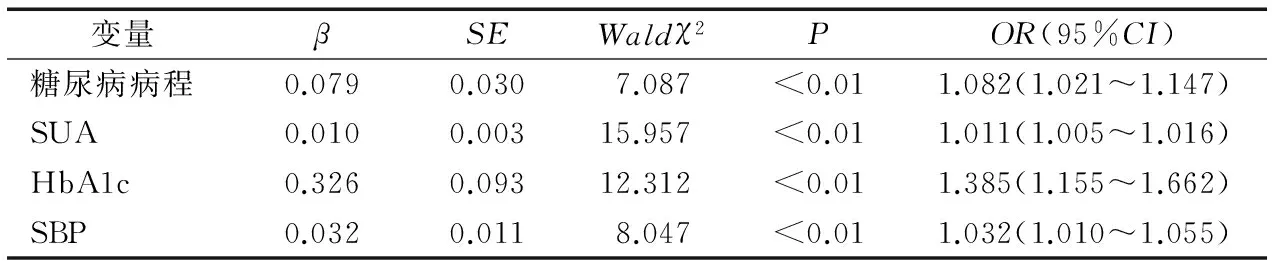
表2 Logistics二元回归分析女性DPN的影响因素
2.3 患病风险评估
以男性和女性Q1组作为参照组(OR:1.00)。在单因素Logistics模型中,男性随着SUA水平升高患DPN的风险依次增高(P<0.05)。校正糖尿病病程、FPG、HbA1c、年龄、吸烟史、饮酒史、BMI、腰围、TC、TG、HDL-C、LDL-C、SBP、DBP、eGFR、UACR、高血压患病率、口服他汀类降脂药、口服降压药物后进行Logistics回归分析,结果显示,男性SUA是DPN的独立危险因素;与Q1组相比,Q2、Q3及Q4组发生DPN的风险仍然依次增高(P<0.01),见表3。
在单因素Logistics模型中,女性随着SUA水平升高患DPN的风险依次增高(P<0.01)。校正糖尿病病程、FPG、HbA1c、年龄、吸烟史、饮酒史、BMI、腰围、TC、TG、HDL-C、LDL-C、SBP、DBP、eGFR、UACR、高血压患病率、口服他汀类降脂药、口服降压药物后进行Logistics回归分析,结果显示,女性SUA是DPN的独立危险因素;与Q1组相比,Q2、Q3及Q4组发生DPN的风险仍然依次增高(P<0.01),见表4。

表3 男性不同SUA水平与代谢综合征患病风险比

表4 女性不同SUA水平与代谢综合征患病风险比
3 讨论
DPN是糖尿病最常见的微血管并发症之一,其发病率也呈现出逐年上升的趋势,并可累及全身多处神经系统。DPN可引起感觉性共济失调、位置觉和感觉缺失或减退,可引发肢体远端部位遭受各种意外损伤,从而引起糖尿病足的发生,严重的甚至要截肢,是糖尿病致残的重要原因。神经传导速度(NCV)检查被认为是糖尿病周围神经病变诊断的“金标准”[4],因此本研究选择肌电图检查诊断DPN。本研究DPN的患病率为38.6%,低于Singh等[5-6]的结果,这可能与本研究在选择病例没有限制年龄及病程有关。本研究结果还显示,随着SUA水平的升高,男性和女性患者中DPN的患病率呈逐渐增高趋势,且随着SUA水平的增高,BMI、TG逐渐升高,GFR逐渐降低,男性患者随着SUA水平的增高,HbA1c水平逐渐降低,与文献[7]报道相似。提示糖尿病病程、HbA1c、SUA是男性和女性T2DM患者DPN的危险因素,与Papanas等[8]的研究结果相一致。
本研究以DPN的有无作为因变量,分别校正糖尿病病程、FPG、HbA1c、年龄、吸烟史、饮酒史、BMI、腰围、TC、TG、HDL-C、LDL-C、SBP、DBP、eGFR、UACR、高血压患病率、口服他汀类降脂药、口服降压药物后进行Logistics回归分析,结果提示SUA是男性、女性T2DM患者独立于年龄、糖尿病病程、HbA1c及传统心血管事件危险因素之外的DPN危险因素,与文献[8-10]报道相似。
目前DPN发病机制尚未明确,其可能与高血糖、遗传、缺血及缺氧性因素、蛋白糖基化异常等因素有关。尿酸是体内嘌呤最终代谢产物,尿酸生成过多和(或)排泄减少,使SUA升高。目前SUA在DPN中的具体发病机制尚不明确,可能与HUA存在有轻微慢性炎症,而慢性炎症可能与RI有关[11],而高胰岛素血症会导致内皮源性的NO生成减少,导致血小板聚集、增加细胞因子及炎性因子的释放,对血管内皮细胞产生破坏,并可激活补体及血小板,启动凝血机制,在血管局部形成血栓,影响细胞及组织的血供,导致周围神经功能受损。
综上所述,SUA水平与DPN之间存在密切的关系,是T2DM患者DPN的重要危险因素之一。SUA水平的升高可提示T2DM的DPN患病风险增高。本研究是一项单个中心的横断面研究,且样本量有限,还需要扩大样本量,以进一步证实这一结果。
参考文献:
[1] Ennis S L,Galea M P,O’Neal D N,et al.Peripheral neuropathy in the hands of people with diabetes mellitus[J].Res Clin Pract,2016,119:23-31.
[2] Pafili K,Katsiki N,Mikhailidis D P,et al.Serum uric acid as a predictor of vascular complications in diabetes: an additional case for neuropathy[J].Acta Diabetologica,2014,51(5):893-894.
[3] 王宏斌,夏先考,吴建华.CKD-EPI方程估算肾小球滤过率的评价[J].国际检验医学杂志,2011,32(9):936-941.
[4] Perkins B A,Olaleye D,Zinman B,et al.Simple screening tests forperipheral neuropathy in the diabetes clinic[J].Diabetes Care,2001,24(2):250-256.
[5] Singh R,Kishore L,Kaur N.Diabetic peripheral neuropathy:current perspective and future directions[J].Pharmacological Research,2014,80(1):21-35.
[6] 宣艳艳,余晶波.老年2型糖尿病患者血尿酸水平与周围神经病变的相关性[J].中华老年医学杂志,2017,36(6):655-659.
[7] 刘越素,周翔海,许林鑫,等.住院2型糖尿病患者HbA1c与血尿酸关系的研究[J].中华内分泌代谢杂志,2016,32(4):300-304.
[8] Papanas N,Demetriou M,Katsiki N,et al.Increased serum levels of uric acid are associated with sudomotor dysfunction in subjects with type 2 diabetesmellitus[J].Experimental Diabetes Research,2011,2011(1):346051.
[9] 王国凤,徐宁,杨涛.中老年2型糖尿病患者血尿酸水平与糖尿病周围神经病变的相关性研究[J].中国糖尿病杂志,2015,23(7):608-611.
[10] Shuai Y,Ying C,Xu H,et al.Serum uric acid levels and diabetic peripheral neuropathy in type 2 diabetes: a systematic review and Meta-analysis[J].Mol Neurobiol,2016,53(2):1045-1051.
[11] Pannacciulli N,Cantatore F P,Minenna A,et al.C-reactive protein is independentlyassociated with total body fat,central fat,and insulin resistance in adult women[J].Int J Obes Relat Metab Disord,2001,25(10):1416-1420.
