多次癫外科手术治疗的难治性癫临床病理学研究
2018-05-09李岩刘永玲邢炜付静
李岩 刘永玲 邢炜 付静
目前,我国有20%~30%癫患者因对抗癫药物(AEDs)耐药或其他原因,需接受癫外科手术治疗[1],仍有部分患者接受一次手术后,临床症状仍难以控制,药物治疗效果较差,需再次接受癫外科手术治疗。本研究回顾分析19例接受2次或以上癫外科手术的难治性癫患者的临床和病理学资料,探讨此类患者的临床病理学特征和分型,为癫外科手术术前评估和术后疗效评价提供理论依据。
资料与方法
一、临床资料
1.纳入标准 (1)明确诊断为癫后正规应用2~3种抗癫药物,治疗2年以上仍不能控制临床症状[2]。(2)年龄 ≤ 20 岁。(3)接受 2 次或以上癫外科手术治疗。(4)再次手术前均行头部CT和(或)MRI检查以及长程视频脑电图(LT⁃VEEG)监测准确定位致灶。(5)手术切除标本均行组织病理学检查。(6)随访资料完整。(7)本研究经北京市海淀医院道德伦理委员会审核批准,所有患者或其家属均知情同意并签署知情同意书。
2.排除标准 (1)未诊断为难治性癫。(2)年龄 > 20 岁。(3)无术前影像学资料。(4)无完整随访资料。
3.一般资料 选择2008年1月-2015年7月在北京市海淀医院神经外科连续接受癫外科手术治疗的683例患者,≤20岁者415例(60.76%),其中19例接受2次或以上癫外科手术。最终纳入这19例难治性癫患者,男性12例,女性7例;年龄为3~20岁,平均15.24岁;发病年龄10天至17岁,平均6.45岁;病程2~17年,平均8.76年;以高热惊厥发病9例(9/19),继发于颅脑创伤4例(4/19),既往有难产史3例(3/19),无明显诱因3例(3/19);发作形式以复杂部分性发作(CPS)为主16例(16/19),其次依次为单纯部分性发作(SPS)2例(2/19)、失神发作(AS)1例(1/19);发作频率 2次/月至 10余次/d。首次术前头部MRI检查,4例(4/19)可见病变脑组织萎缩、细小脑回和脑软化灶,7例(7/19)可见病变脑组织呈实性或囊性占位效应,4例(4/19)于不同脑区可见异常信号,余4例(4/19)未见明显异常;再次术前MRI均呈术后改变,3例(3/19)可见单侧大脑半球萎缩,6例(6/19)可见海马组织异常信号,6例(6/19)可见首次手术区域周围异常强化信号,4例(4/19)可见部分脑叶长T1、长T2信号。
二、研究方法
1.手术方法 (1)首次手术:术前经CT和(或)MRI以及LT⁃VEEG监测定位致灶。19例患者中10例(10/19)行病灶和致灶切除术,5例(5/19)行肿瘤切除术,1例(1/19)行颞叶及其内侧结构切除术,1例(1/19)行多脑叶切除术,2例(2/19)行胼胝体切开术。(2)再次手术:术前均经CT和(或)MRI以及LT⁃VEEG监测定位致灶,7例(7/19)放置颅内电极以准确定位致灶。19例患者中16例(16/19)接受2次癫外科手术,3例(3/19)接受3次癫外科手术;手术时间间隔为1~10年,平均为4.24年。19例患者中3例(3/19)行病灶和致灶切除术,5例(5/19)行多脑叶切除术,3例(3/19)行肿瘤和多脑叶切除术,6例(6/19)行颞叶及其内侧结构切除术,其中2例(2/19)同时行胼胝体切开术,2例(2/19)行改良式解剖性大脑半球切除术。两次手术切除标本均行组织病理学检查。
2.病理学检查 按照规范的癫外科手术标本处理程序制备脑组织切片[3⁃4]:垂直皮质每 3 mm 切开脑组织,间隔取材;大体标本异常者全部取材;海马组织冠状位取材。经体积分数为10%中性甲醛溶液固定、常规脱水、石蜡包埋,制备3~5 μm层厚脑组织切片,分别行HE染色和免疫组织化学染色。免疫组织化学染色采用EnVision二步法,检测用试剂盒购自北京中杉金桥生物技术有限公司;检测用抗体包括胶质纤维酸性蛋白(GFAP,1∶100)、神经元核抗原(NeuN,1∶100)、微管相关蛋白⁃2(MAP⁃2,1∶100)、神经微丝(NF,1∶100)、巢蛋白(Nes,1∶100)、波形蛋白(Vim,1∶150)、少突胶质细胞转录因子 2(Olig⁃2,1∶100)、β⁃人绒毛膜促性腺激素(β⁃hCG,即用型)、CD117(即用型)、CD34(1∶150)、CD3(1 ∶100)、CD20(1 ∶100)和 Ki⁃67 抗原,购自北京中杉金桥生物技术有限公司。参照2011年国际抗癫联盟(ILAE)中局灶性皮质发育不良(FCD)分型标准[5]和2007年世界卫生组织(WHO)中枢神经系统肿瘤分类[6]进行病理学诊断和分型。
3.预后评价 随访结束时采用Engel分级[7]评价预后,Ⅰ级,癫发作完全消失或仅有先兆;Ⅱ级,癫发作极少(≤3次/年);Ⅲ级,发作 >3次/年,但发作减少≥75%;Ⅳ级,癫发作减少<75%。EngelⅠ和Ⅱ级为预后良好,计算预后良好率,计算公式为:预后良好率(%)=(EngelⅠ级病例数+EngelⅡ级病例数)/总病例数×100%。
结 果
一、病理学特征和分型
1.首次手术 本组有4例患者大体标本观察,局部脑回细小、脑沟加深,部分区域囊性变;组织学形态观察,部分大脑皮质结构破坏,正常结构消失;免疫组织化学染色,NeuN阳性神经元减少或消失,神经胶质细胞增生,GFAP阳性反应性星形胶质细胞增生并形成条带样结构;最终病理诊断为瘢痕脑回。5例患者为肿瘤性病变,3例大体标本呈小块灰白、灰粉色不整形脑组织,解剖学结构消失;2例组织学形态可见密度较高的肿瘤性星形胶质细胞增生,小血管增生,核分裂象少见;免疫组织化学染色,肿瘤细胞胞质GFAP阳性。其中2例诊断为星形细胞瘤(WHOⅡ级);1例诊断为少突星形细胞瘤,局部区域可见胞质透亮的肿瘤细胞增生,分枝状毛细血管,胞核Olig⁃2阳性;1例诊断为下丘脑混合性生殖细胞肿瘤,主要由胞质透亮、有一定异型性的肿瘤细胞组成,胞膜CD117阳性,淋巴细胞浸润,局灶可见胞质β⁃hCG阳性的合体细胞成分;1例诊断为胚胎发育不良性神经上皮肿瘤(DNT),黏液样基质中可见部分区域成熟神经元如“浮蛙”样漂浮其中。1例患者为错构瘤,即软脑膜血管错构性病变及其深部局灶性皮质发育不良。1例患者为海绵状血管瘤,大体标本可见深褐色脉管组织和少许破碎脑组织,组织学形态观察,大小不一的薄壁窦状血管增生,周围脑组织皮质发育不良。6例患者为局灶性皮质发育不良,大体标本可见灰白质分界不清,局灶皮质变薄;组织学形态观察,切线状皮质结构异常,6层结构紊乱;免疫组织化学染色,NeuN阳性神经元减少或消失,可见小的未成熟神经元,胞质MAP⁃2强阳性,个别可见大的形态异常MAP⁃2强阳性神经元;病理诊断为FCDⅠb型2例、FCDⅡa型2例、FCDⅢa型1例、FCDⅢd型1例。1例患者白质内可见较大局灶性灰质异位。1例患者仅行胼胝体切开术。
2.再次手术 再次手术切除标本均可见前次手术后胶质瘢痕、小血管增生等改变。4例患者送检标本为一侧颞叶及其内侧结构,大体标本观察,破碎灰白色脑组织和小块海马组织,质地较韧;组织学形态可见局灶性皮质发育不良和海马齿状回不同区域锥体细胞缺失和星形胶质细胞增生;免疫组织化学染色,增生的胶质细胞胞质GFAP呈阳性;最终明确诊断为FCDⅢa型。5例首次肿瘤性病变患者再次手术切除标本3例可见肿瘤成分(星形细胞瘤1例、混合性生殖细胞肿瘤1例、胚胎发育不良性神经上皮肿瘤1例),2例可见周围脑组织皮质发育不良;4例最终病理诊断为FCDⅢb型,1例最终病理诊断为双重病理(dual pathology,FCDⅢa型伴少突星形细胞瘤)。4例首次瘢痕脑回患者中再次手术后2例送检标本为一侧大脑半球,2例为多个脑叶,组织学形态,胶质瘢痕和局灶性皮质发育不良;3例最终病理诊断FCDⅢd型,1例最终病理诊断双重病理[FCDⅢa型伴胶质瘢痕和(或)瘢痕脑回]。3例首次局灶性皮质发育不良患者再次手术可见胶质瘢痕,最终病理诊断FCDⅢd型。1例首次错构瘤患者再次手术后组织学形态可见胶质瘢痕和局灶性皮质发育不良,最终病理诊断FCDⅢd型。1例首次海绵状血管瘤患者再次手术后最终病理诊断为FCDⅢc型。1例首次灰质异位患者再次手术后最终病理诊断为FCDⅢd型。因此最终病理诊断为FCDⅢ型17例[17/19,即FCDⅢa型4例、FCDⅢb型4例、FCDⅢc型1例和FCDⅢd型8例]和双重病理[FCDⅢa型伴少突星形细胞瘤及伴胶质瘢痕和(或)瘢痕脑回]2例(2/19,表1)。
二、预后
本组19例患者末次手术后随访0.50~5.00年、平均2.34年,EngelⅠ级10例(10/19)、EngelⅡ级6例(6/19)、EngelⅢ 级 3例(3/19),预 后 良 好 率 达84.21%。
典型病例
例1女性,16岁,主因癫外科手术后3年,反复突发意识障碍2年余,于2012年3月12日入院。患儿2.50岁时曾发生高热惊厥,4岁时首次出现癫发作,复杂部分性发作继发全面性强直⁃阵挛发作(GTCS),发作频率5~6次/d,持续1~2 min,服用丙戊酸钠(德巴金)和左乙拉西坦(开浦兰)后症状控制欠佳。术前MRI显示,病变脑组织萎缩,脑回细小、脑沟加深加宽,患侧侧脑室扩大。遂于2009年5月8日于全身麻醉下行致灶切除术。手术切除标本行组织病理学检查,大体标本观察,脑回细小、脑沟加深,局部区域囊性变。组织学形态观察,局部区域皮质结构破坏、消失,反应性星形胶质细胞增生并形成条带样结构(图1a)。免疫组织化学染色,残存的少量神经元胞核NeuN阳性、胞质MAP⁃2阳性;星形胶质细胞胞质GFAP阳性。病理诊断为瘢痕脑回。首次术后随访3年,癫发作控制欠佳,以夜间发作为主,表现为睡眠中突然坐起,继而肢体抽搐,发作频率为2次/5~6 d,持续2 min,丙戊酸钠和左乙拉西坦效果较差。经过临床评估后再次行癫外科手术。术前MRI显示脑组织手术后改变。LT⁃VEEG监测准确定位致灶。遂于2012年3月14日于全身麻醉下行多脑叶切除术。再次手术切除标本行组织病理学检查,大体标本观察,手术切除标本呈灰白色,质地坚韧,可见细小脑回,脑组织解剖结构破坏。组织学形态观察,胶质瘢痕形成,少许残留瘢痕脑回(图1b)。免疫组织化学染色,残留少许NeuN和MAP⁃2阳性神经元,GFAP阳性星形胶质细胞增生显著形成瘢痕。最终病理诊断为FCDⅢd型。
表1 19例接受多次癫外科手术的难治性癫患者临床资料及病理分型Table 1. Clinical data and pathological types of 19 patients with refractory epilepsy treated by several epilepsy surgeries
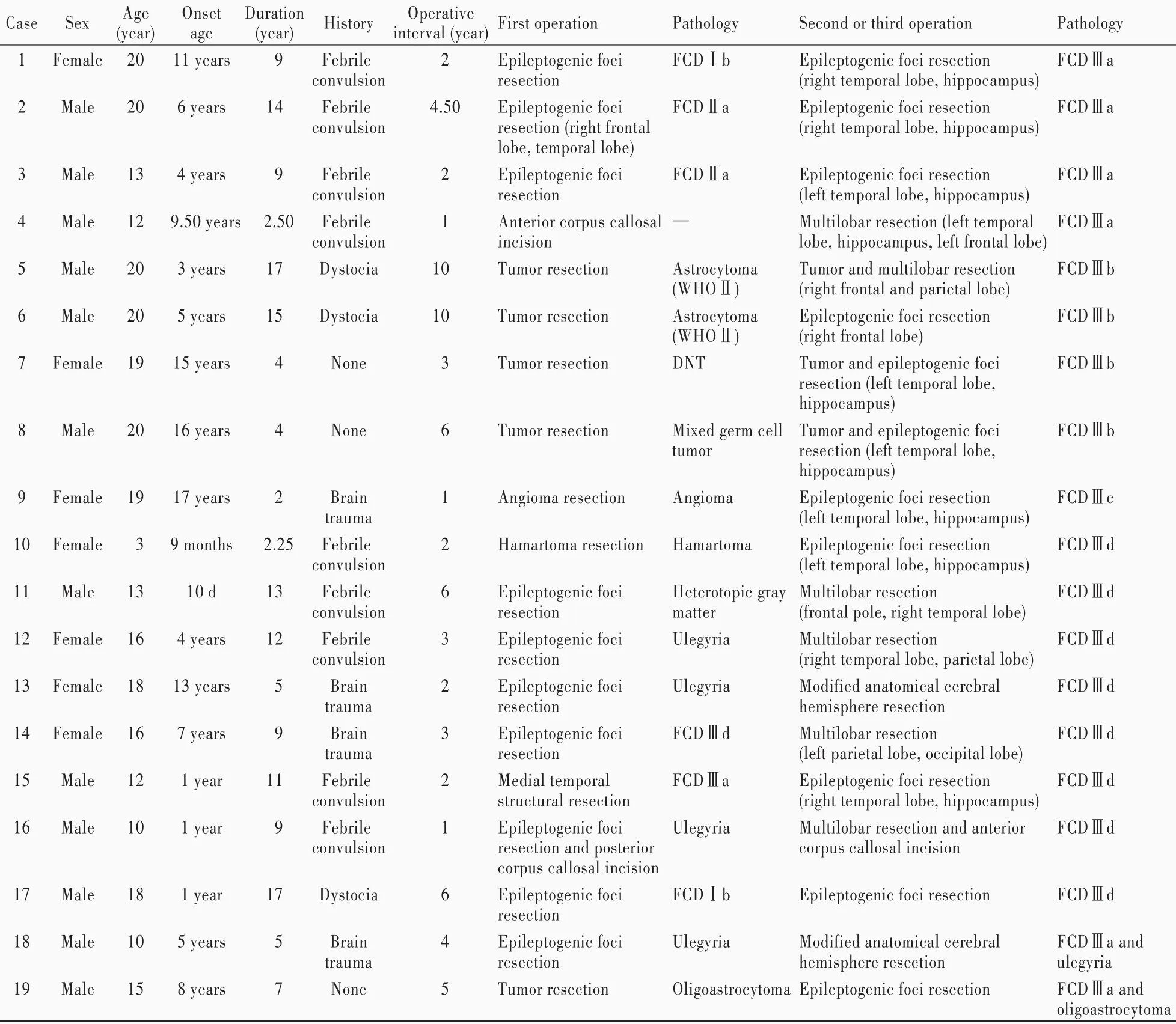
表1 19例接受多次癫外科手术的难治性癫患者临床资料及病理分型Table 1. Clinical data and pathological types of 19 patients with refractory epilepsy treated by several epilepsy surgeries
—,no pathology,未行病理学检查。FCD,focal cortical dysplasia,局灶性皮质发育不良;DNT,dysembryoplastic neuroepithelial tumor,胚胎发育不良性神经上皮肿瘤
CaseSexAgeOnsetDurationHistoryOperativeFirst operationPathologySecond or third operationPathology(year)age(year)interval(year)1 Female2011 years9Febrile2Epileptogenic fociFCDⅠbEpileptogenic foci resectionFCDⅢa convulsionresection(right temporal lobe,hippocampus)2 Male 206 years 14Febrile4.50Epileptogenic fociFCDⅡa Epileptogenic foci resectionFCDⅢa convulsionresection(right frontal(right temporal lobe,hippocampus)lobe,temporal lobe)3 Male134 years9Febrile2 Epileptogenic fociFCDⅡaEpileptogenic foci resectionFCDⅢa convulsionresection(left temporal lobe,hippocampus)4 Male129.50 years2.50Febrile1Anterior corpus callosal—Multilobar resection(left temporalFCDⅢa convulsionincisionlobe,hippocampus,left frontal lobe)5 Male203 years17Dystocia10Tumor resectionAstrocytomaTumor and multilobar resectionFCDⅢb(WHOⅡ)(right frontal and parietal lobe)6 Male205 years15Dystocia10Tumor resectionAstrocytomaEpileptogenic foci resectionFCDⅢb(WHOⅡ)(right frontal lobe)7 Female1915 years4 None3 Tumor resectionDNTTumor and epileptogenic fociFCDⅢb resection(left temporal lobe,hippocampus)8 Male 2016 years 4 None6 Tumor resectionMixed germ cellTumor and epileptogenic fociFCDⅢb tumorresection(left temporal lobe,hippocampus)9 Female1917 years2Brain1 Angioma resectionAngiomaEpileptogenic foci resectionFCDⅢc trauma(left temporal lobe,hippocampus)10Female39 months2.25Febrile2 Hamartoma resectionHamartomaEpileptogenic foci resectionFCDⅢd convulsion(left temporal lobe,hippocampus)11Male1310 d13Febrile6 Epileptogenic fociHeterotopic grayMultilobar resectionFCDⅢd convulsionresectionmatter(frontal pole,right temporal lobe)12Female164 years12Febrile3 Epileptogenic fociUlegyriaMultilobar resectionFCDⅢd convulsionresection(right temporal lobe,parietal lobe)13Female1813 years5 Brain2 Epileptogenic fociUlegyriaModified anatomical cerebralFCDⅢd traumaresectionhemisphere resection 14Female167 years9Brain3 Epileptogenic fociFCDⅢdMultilobar resectionFCDⅢd traumaresection(left parietal lobe,occipital lobe)15Male121 year11Febrile2 Medial temporalFCDⅢaEpileptogenic foci resectionFCDⅢd convulsionstructural resection(right temporal lobe,hippocampus)16Male101 year9Febrile1 Epileptogenic fociUlegyriaMultilobar resection and anteriorFCDⅢd convulsionresection and posteriorcorpus callosal incision corpus callosal incision 17Male 181 year 17Dystocia6 Epileptogenic fociFCDⅠb Epileptogenic foci resection FCDⅢd resection 18Male 105 years5 Brain4 Epileptogenic fociUlegyriaModified anatomical cerebralFCDⅢa and traumaresectionhemisphere resectionulegyria 19Male 158 years7None5Tumor resection OligoastrocytomaEpileptogenic foci resectionFCDⅢa and oligoastrocytoma
例2男性,18岁,因癫外科手术后6年,反复突发跌倒和右侧肢体强直5年余,于2013年12月1日入院。患儿出生时难产,1岁时首次出现癫发作,突发跌倒和右侧肢体强直,发作频率4~5次/d,最长持续5 min,服用拉莫三嗪、苯妥英钠、卡马西平和丙戊酸钠,效果欠佳。术前MRI显示,左侧额叶异常信号影。遂于2008年1月20日于全身麻醉下行致灶切除术。手术切除标本行组织病理学检查,大体标本观察,脑组织灰白质界限不清,灰质变薄,白质可见局灶性灰质异位。组织学形态可见切线状皮质结构异常,6层结构紊乱,神经元减少或缺失,可见小的未成熟神经元(图2a),第5层外可见肥大锥体细胞;白质可见异位神经元和局灶性灰质异位。免疫组织化学染色,白质内异位灰质区神经元胞核NeuN阳性、胞质MAP⁃2阳性,异位神经元、小的未成熟神经元胞质MAP⁃2呈强阳性。病理诊断为FCDⅠb型。首次术后随访6年,癫发作控制欠佳,术后4个月仅有肢体抖动和发作性身体晃动,逐渐加重至术前水平,经临床评估需再次行癫外科手术。术前LT⁃VEEG监测准确定位致灶。遂于2013年12月11日于全身麻醉下行致灶切除术。再次手术切除标本进行组织病理学检查,大体标本观察,手术切除标本不规则,呈灰白色,质地坚韧,灰白质分界不清。组织学形态观察,胶质瘢痕形成和皮质构筑异常(图2b)。免疫组织化学染色,GFAP阳性的星形胶质细胞增生。最终病理诊断为FCDⅢd型。
例3男性,20岁,主因胶质瘤术后10年,反复突发双上肢屈曲抽搐9年,于2009年10月6日入院。患儿3岁时无明显诱因出现癫发作,睡眠中突然睁眼,双上肢屈曲抽搐,发作频率3~4次/d,持续时间由1~2 s/次进展为1~2 min/次,服用拉莫三嗪、卡马西平、丙戊酸钠等多种抗癫药物,效果欠佳。术前MRI显示,颅内占位性病变。遂于1999年8月4日于全身麻醉下行肿瘤切除术。手术切除标本行组织病理学检查,大体标本观察,手术切除组织质地较脆,呈灰粉色。组织学形态观察,肿瘤性星形胶质细胞增生,细胞体积增大,胞核有一定异型性,可见微囊形成(图3a)。免疫组织化学染色,肿瘤细胞胞质GFAP呈强阳性。病理诊断为星形细胞瘤(WHOⅡ级)。术后6个月无癫发作,继而出现睡眠中突发睁眼和肢体抽搐,发作频率2次/d,持续3~5 min/次,服用丙戊酸钠和苯妥英钠临床效果较差,临床评估后需再次行癫外科手术。术前MRI显示,右侧额颞叶环状强化信号。LT⁃VEEG监测准确定位致灶。遂于2009年10月20日于全身麻醉下行占位性病变切除术和多脑叶切除术(右侧额顶叶)。再次手术切除标本行组织病理学检查,组织学形态观察,肿瘤性星形胶质细胞增生,胞核异型性明显,核分裂象为3~4/10个高倍视野(HPF,图3b)。免疫组织化学染色,肿瘤细胞胞质GFAP呈弥漫性强阳性,提示星形细胞瘤(WHOⅢ级),肿瘤周围可见局灶性皮质发育不良,最终病理诊断为FCDⅢb型。
讨 论
难治性癫病因多样,绝大多数患者与局灶性皮质发育不良有关。局灶性皮质发育不良最早由Taylor等[8]于1971年提出,根据是否出现气球样细胞,分为Taylor型(有气球样细胞)和非Taylor型(无气球样细胞)。2004年,Palmini等[9]重新分类,分为FCDⅠ型和FCDⅡ型,其中,FCDⅠa型呈现皮质排列紊乱、FCDⅠb型出现发育不良的神经元或巨大神经元,FCDⅡa型可见形态异常神经元、FCDⅡb型存在标志性气球样细胞。2011年,国际抗癫联盟对该分类标准进行调整,分为FCDⅠ型、FCDⅡ型和FCDⅢ型[5],其中,FCDⅠ型进一步分为FCDⅠa型、FCDⅠb型和FCDⅠc型,FCDⅠa型可见皮质神经元微柱状结构(即8个以上小神经元垂直皮质排列),FCDⅠb型可见皮质结构水平方向排列紊乱且6层结构消失,FCDⅠc型为FCDⅠa型与FCDⅠb型合并病变;FCDⅡ型进一步延续Palmini等[9]的分类标准;FCDⅢ型进一步分为FCDⅢa型、FCDⅢb型、FCDⅢc型和FCDⅢd型,FCDⅢa型可见颞叶皮质构筑异常伴海马硬化,FCDⅢb型表现为皮质发育异常伴邻近肿瘤性病变,FCDⅢc型呈现皮质发育异常伴邻近血管畸形,FCDⅢd型为皮质分层障碍伴其他获得性病变。双重病理指除FCDⅢa型外,还合并其他病变,如肿瘤、FCDⅡa型和(或)FCDⅡb型、血管畸形、瘢痕等[10]。
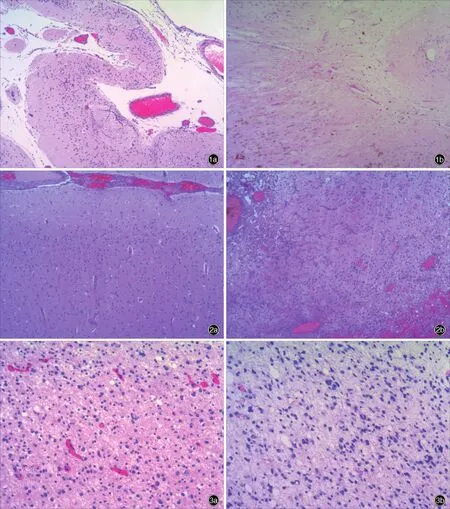
图1 光学显微镜观察所见 HE染色 1a 首次术后可见皮质萎缩呈带状,伴层状神经元缺失,皮质顶部残留神经元呈结节状分布,神经胶质细胞增生,提示瘢痕脑回 ×40 1b 再次术后可见脑组织正常结构消失,代之以胶质瘢痕,神经元和神经胶质细胞缺失,提示FCDⅢd型 ×100 图2 光学显微镜观察所见 HE染色 ×40 2a 首次术后可见6层结构紊乱,切线状皮质结构异常,神经元减少,提示FCDⅠb型 2b 再次术后可见胶质瘢痕形成,周围神经细胞排列紊乱,小血管增生,提示FCDⅢd型 图3 光学显微镜观察所见 HE染色 ×40 3a 首次术后可见肿瘤性星形胶质细胞增生,胞核有一定异型性,提示星形细胞瘤(WHOⅡ级) 3b 再次术后可见肿瘤复发,胞核异型性明显,染色质粗大,小血管增生,提示星形细胞瘤(WHOⅢ级)Figure 1 Optical microscopy findings HE staining After first operation,cortical atrophy became a band with loss of neurons,and residual neurons on the top of cortex showed a nodular distribution,with glial hyperplasia,indicating ulegyria(Panel 1a). ×40 After reoperation,the normal structure of brain tissue disappeared and was replaced by glial scar,with loss of neurons and glial cells,indicating FCDⅢd(Panel 1b). ×100 Figure 2 Optical microscopy findings HE staining ×40 After first operation,the six layers of cortex were disorganized,tangent cortex was abnormal,and the number of neurons decreased,indicating FCDⅠb(Panel 2a).After reoperation,glial scar formed,and nerve cells were arranged disorderly,with small vascular hyperplasia,indicating FCDⅢd(Panel 2b). Figure 3 Optical microscopy findings HE staining ×40 After first operation,neoplastic astrocyte hyperplasia and atypia of nuclei were seen,indicating astrocytoma(WHOⅡ,Panel 3a).After reoperation,recurrence of tumor,atypia of nuclei,thick chromatin and small blood vessel hyperplasia were seen,indicating astrocytoma(WHOⅢ,Panel 3b).
本组患者首次术后病理分型多样,主要包括FCDⅠb型、FCDⅡa型、FCDⅢa型、FCDⅢd型、星形细胞瘤、少突星形细胞瘤、混合性生殖细胞肿瘤、胚胎发育不良性神经上皮肿瘤、错构瘤、血管瘤、灰质异位、瘢痕脑回,其中肿瘤性病变5例、错构瘤1例、血管瘤1例、局灶性皮质发育不良者6例、灰质异位1例、瘢痕脑回4例、1例仅行胼胝体切开术,首次手术均效果欠佳,临床评估后行再次手术。再次术后病理分型包括FCDⅢa型、FCDⅢb型、FCDⅢc型和FCDⅢd型,以及FCDⅢa型伴少突星形细胞瘤及伴胶质瘢痕和(或)瘢痕脑回的双重病理。FCDⅢa型4例,均为颞叶癫(即颞叶皮质或颞叶内侧结构病理改变导致的癫),病变累及单侧颞叶和海马。组织学形态观察,软脑膜纤维组织增生,局灶小血管增生,星形胶质细胞增生,皮质神经元排列紊乱伴或不伴微柱状结构,海马硬化(海马CA1~CA4区选择性锥体神经元缺失和神经胶质细胞增生,伴齿状回颗粒细胞数量和分布异常)。根据不同分区神经元缺失,海马硬化可以分为Ⅰ型(CA1区和CA4区神经元缺失、神经胶质细胞增生,通常与5岁之前的脑组织损伤史有关,癫发生早,手术效果好)、Ⅱ型(以CA1区为主的神经元缺失,神经胶质细胞增生)和Ⅲ型(以CA4区为主的神经元缺失,神经胶质细胞增生)[11]。本组海马硬化患者MRI呈特征性改变。颞叶癫患者均行再次手术切除颞叶皮质或颞叶内侧结构,症状明显改善或治愈。颞叶癫行再次手术的患者随访0.50~5.00年,EngelⅠ级2例,EngelⅡ级1例,EngelⅢ级1例。海马结构异常导致难治性癫的持续,近年有文献报道,颞叶癫与海马神经再生有关[12]。本组4例颞叶癫患者中2例有中枢神经系统感染史、1例有颅脑创伤史、1例有无诱因长期癫发作史;2例双重病理患者中1例有高热惊厥史、1例有颅脑创伤史。因此,陈旧性脑损伤和长期缺氧均可以引起海马结构异常而致癫。切除海马和相关脑叶后,癫发作控制较好。因此,对于首次手术效果欠佳的难治性癫患者,海马及相关脑叶检查十分重要,很可能是临床症状难以控制的重要原因。
本组有4例FCDⅢb型患者,高峰发病年龄3~16岁,病程4~17年,其中星形细胞瘤2例,分别为WHOⅡ和Ⅲ级,距前次手术0.50和2年,术后6个月内临床症状明显改善,6个月后出现癫持续状态(SE),再次术后病理学证实为肿瘤复发,致灶区皮质可见皮质构筑异常;1例胚胎发育不良性神经上皮肿瘤距前次手术3年,再次术后病理学显示由分化程度不同的肿瘤性星形胶质细胞和神经元构成,周围可见局灶性皮质发育不良,术后随访5年,效果较好。神经元和混合性神经元⁃胶质肿瘤是与难治性癫最为相关的良性肿瘤,生物学行为和预后均良好[13]。2015年世界卫生组织中枢神经系统肿瘤分类将神经元和混合性神经元⁃胶质肿瘤分为节细胞胶质瘤、胚胎发育不良性神经上皮肿瘤、乳头状胶质神经元肿瘤、中枢神经细胞瘤和脑室外神经细胞瘤等。晚近报道一种儿童多形性低级别神经上皮性肿瘤(PLNTY)是具有少突胶质细胞瘤样形态的致性肿瘤[14]。本组有2例再次术后病理学检查可见肿瘤成分和局灶性皮质发育不良,术后随访效果较好,可能是肿瘤残留和局灶性皮质发育不良致前次术后癫发作,是否存在肿瘤复发的可能,尚待进一步研究。1例下丘脑混合性生殖细胞肿瘤,前次手术近全切除肿瘤,术后6年再发癫发作,再次术后病理学检查可见肿瘤成分、胶质瘢痕和致灶,术后随访效果较差,考虑此次癫复发可能与肿瘤相关。有文献报道,颅内生殖细胞肿瘤的手术方式与预后相关[15]。总之,本组病例中低级别肿瘤患者手术切除病灶和致灶后效果较好,而高级别肿瘤患者多次手术仍难以控制症状。
本组有8例FCDⅢd型患者,发病年龄10天至13岁,均于儿童期发病,5例有高热惊厥史、2例有颅脑创伤史、1例难产史,幼年时期的中枢神经系统疾病均可能成为癫的病因[16]。再次手术4例为多脑叶切除术、2例为单一脑叶切除术、1例为改良式解剖性大脑半球切除术、1例为致灶切除术,其中4例同时行胼胝体切开术。术后病理学检查显示胶质瘢痕或瘢痕脑回。提示存在幼年时期脑组织损伤史的难治性癫患者,脑损伤范围较广泛,神经外科手术切除病灶和致灶范围较大,效果较好。此类患者手术疗效与手术切除范围有关,亦与胼胝体离断有关。幼年时期的脑组织损伤(颅内出血、脑组织软化、神经胶质细胞增生)及其导致的皮质发育不良是癫的主要病因,前次手术未能全切除病灶和致灶可能是再次手术的主要原因。尽早手术治疗,有利于皮质功能重建,对患者智力发育及其功能的获得具有重要意义[17]。此8例患者再次术后随访效果较好,癫发作有效控制或消失。
双重病理系指除FCDⅢa型外还合并其他病变,如肿瘤、FCDⅡa型和(或)FCDⅡb型、血管畸形、瘢痕等[10]。影像学常可见海马缩小、颞叶皮质增厚等[18]。本组有1例FCDⅢa型伴少突星形细胞瘤和1例FCDⅢa型伴胶质瘢痕和(或)瘢痕脑回的双重病理患者,其中1例有颅脑创伤史,为幼年时期脑组织损伤,2例分别于5和7年前行癫外科手术,症状无明显改善,MRI显示海马异常信号影,再次行改良式解剖性大脑半球切除术,术后病理学检查可见瘢痕脑回,海马硬化。当脑损伤范围较大,累及一侧大脑半球并累及海马时,改良式解剖性大脑半球切除术可以取得较好疗效。该术式采用肌肉堵塞室间孔、硬脑膜覆盖丘脑和基底节等方法,将术腔营造为硬膜外腔隙,减少并发症的发生,同时取得显著疗效[19]。尽管切除大脑半球带来的不良反应显而易见,但影像学显示切除的腔隙逐渐被对侧大脑半球填充。术后患儿癫发作频率明显减少或消失,生活质量显著改善。
本组患者术后预后良好率为84.21%。再次手术均具有切除脑组织范围较大、海马切除比例较高、同时行胼胝体全段切开术等特点。难治性癫患者术后效果不理想时,结合具体病变,再次手术可能取得满意效果,尤其是癫患儿,给患者及其家庭带来益处[20]。
[1]Sun JD,Wang DD,Liang H,Gui QP,Han HY,Wang L,Hu JX,Chen GQ.A clinicopathological analysis of 172 cases with intractable epilepsy[J].Zhonghua Shen Jing Wai Ke Za Zhi,2010,26:494⁃496[.孙基栋,王丹丹,梁晖,桂秋萍,韩宏彦,王林,胡京霞,陈国强.难治性癫痫172例临床病理分析[J].中华神经外科杂志,2010,26:494⁃496.]
[2]Liu XY.Progressin diagnosis and treatment for pediatric intractable epilepsy[J].Di San Jun Yi Da Xue Xue Bao,2012,34:2240⁃2243[.刘晓燕.小儿难治性癫痫的研究进展[J].第三军医大学学报,2012,34:2240⁃2243.]
[3]Piao YS,Chen L,Fu YJ,Wang W,Li YJ,Lu DH.Focal corticaldysplasia with refractory epilepsy:clinicopathologic study of 38 cases[J].Zhonghua Bing Li Xue Za Zhi,2007,36:150⁃154[.朴月善,陈莉,付永娟,王玮,李勇杰,卢德宏.癫痫相关局灶性皮质发育不良的临床病理学研究[J].中华病理学杂志,2007,36:150⁃154.]
[4]Lu DH,Chen L,Piao YS.Focus on neuropathological study of intractable epilepsy[J].Zhonghua Bing Li Xue Za Zhi,2007,36:147⁃149[.卢德宏,陈莉,朴月善.重视难治性癫痫的神经病理学研究[J].中华病理学杂志,2007,36:147⁃149.]
[5]Blǔmcke I,Thom M,Aronica E,Armstrong DD,Vinters HV,Palmini A,Jacques TS,Avanzini G,Barkovich AJ,Battaglia G,Becker A,Cepeda C,Cendes F,Colombo N,Crino P,Cross JH,Delalande O,Dubeau F,Duncan J,Guerrini R,Kahane P,Mathern G,Najm I,Ozkara C,Raybaud C,Represa A,Roper SN,Salamon N,Schulze⁃Bonhage A,Tassi L,Vezzani A,Spreafico R.The clinicopathologic spectrum of focal cortical dysplasias:a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Methods Commission[J].Epilepsia,2011,52:158⁃174.
[6]Louis DN.WHO classification of tumours of the central nervous system[S].Lyon:IARC Press,2007:95⁃117.
[7]Engel JJr,Van Ness PC,Rasmussen TB,Ojemann LM.Outcome with respect to epileptic seizures[M]//Engel J Jr.Surgical treatment of the epilepsies.New York:Raven Press,1987:531⁃571.
[8]Taylor DC,Falconer MA,Ruton CJ,Corsellis JA.Focal dysplasia of the cerebral cortex in epilepsy[J].J Neurol Neurosurg Psychiatry,1971,34:369⁃387.
[9]Palmini A,Najm I,Avanzini G,Babb T,Guerrini R,Foldvary⁃Schaefer N,Jackson G,Lüders HO,Prayson R,Spreafico R,Vinters HV.Terminology and classification ofthe cortical dysplasias[J].Neurology,2004,62(6 Suppl 3):2⁃8.
[10]Blǔmcke I,Mǔhlebner A.Neuropathological work ⁃up of focal cortical dysplasias using the new ILAE consensus classification system:practical guideline article invited by the Euro⁃CNS Research Committee[J].Clin Neuropathol,2011,30:164⁃177.
[11]Blümcke I,Thom M,Aronica E,Armstrong DD,Bartolomei F,Bernasconi A,Bernasconi N,Bien CG,Cendes F,Coras R,Cross JH,Jacques TS,Kahane P,Mathern GW,Miyata H,Moshé SL,Oz B, Özkara Ç,Perucca E,Sisodiya S,Wiebe S,Spreafico R. International consensus classification of hippocampal sclerosis in temporal lobe epilepsy:a Task Force report from the ILAE Commission on Diagnostic Methods[J].Epilepsia,2013,54:1315⁃1329.
[12]Chen LY,Wang Y,Chen Z.Temporal lobe epilepsy and adult hippocampal neurogenesis[J].Zhejiang Da Xue Xue Bao(Yi Xue Ban),2017,46:22⁃29[.陈立颖,汪仪,陈忠.颞叶癫痫与海马成体神经再生[J].浙江大学学报(医学版),2017,46:22⁃29.]
[13]Chan CH,Bittar RG,Davis GA,Kalnins RM,Fabinyi GC.Long⁃term seizure outcome following surgery for dysembryoplastic neuroepithelial tumo[rJ].J Neurosurg,2006,104:62⁃69.
[14]Huse JT,Snuderl M,Jones DT,Brathwaite CD,Altman N,Lavi E,Saffery R,Sexton⁃Oates A,Blumcke I,Capper D,Karajannis MA,Benayed R,Chavez L,Thomas C,Serrano J,Borsu L,Ladanyi M, Rosenblum MK. Polymorphous low ⁃grade neuroepithelial tumor of the young(PLNTY):an epileptogenic neoplasm with oligodendroglioma⁃like components,aberrant CD34 expression,and genetic alterations involving the MAP kinase pathway[J].Acta Neuropathol,2017,133:417⁃429.
[15]Zhao YP,Zhang YQ,Duan HY,Ma Y,Liang H,Zhang QH,Xue CQ,Luo B,Pan X.Intracranial mixed germ cell tumor[J].Zhonghua Yi Xue Za Zhi,2017,97:661⁃665[.赵亚鹏,张玉琪,段虹宇,马羽,梁晖,张庆辉,薛超强,罗斌,潘鑫.颅内混合性生殖细胞肿瘤诊治效果分析[J].中华医学杂志,2017,97:661⁃665.]
[16]Huang L,Yu D,Luo R,Li M,Zhou H,Cai XT,Wang ZL.Risk factors and prognosis of secondary epilepsy in children with viral encephalitis[J].Sichuan Da Xue Xue Bao(Yi Xue Ban),2017,48:257⁃262[.黄亮,俞丹,罗蓉,李敏,周晖,蔡晓唐,汪志凌.儿童病毒性脑炎急性期临床病理特征对继发癫痫的影响[J].四川大学学报(医学版),2017,48:257⁃262.]
[17]Cai LX. Surgical indications and timing for medically intractable epilepsy in children[J].Zhongguo Shi Yong Er Ke Za Zhi,2016,31:31⁃36[.蔡立新.儿童难治性癫痫手术适应证及手术时机选择[J].中国实用儿科杂志,2016,31:31⁃36.]
[18]Cheng LN,Wang WS,Guo SW,Lai CR,Huang ZC,Shen J.MRI analysis of grey mattermorphology in temporallobe epilepsy caused by double pathology[J].Ying Xiang Zhen Duan Yu Jie Ru Fang She Xue,2017,26:47⁃52[.成丽娜,汪文胜,郭圣文,赖春任,黄泽春,沈君.MRI脑灰质形态学分析在双重病理所致颞叶癫痫的应用[J].影像诊断与介入放射学,2017,26:47⁃52.]
[19]O'Brien DF,BasuS,WilliamsDH,MayPL.Anatomical hemispherectomy for intractable seizures:excellent seizure control,low morbidity and no superficial cerebral haemosiderosis[J].Childs Nerv Syst,2006,22:489⁃498.
[20]Liu L,Yuan Z,Zhu G.Research advances of psychiatric comorbidity in pediatric epilepsy[J].Zhongguo Shi Yong Er Ke Za Zhi,2017,32:269⁃274[.刘璐,袁珍,朱刚.儿童癫痫共患精神障碍研究进展[J].中国实用儿科杂志,2017,32:269⁃274.]
