重型颅脑创伤急性期和慢性期外周血炎症反应标志物和氧化应激临床研究
2018-05-09李峰田冰锋魏小兵冯波张春满肖伟
李峰 田冰锋 魏小兵 冯波 张春满 肖伟
颅脑创伤(TBI)系外力引发的脑部创伤性损伤,可以导致短暂性或永久性神经损伤。颅脑创伤常可以引起身体、认知和心理的永久伤害[1⁃2],是影响人类健康的主要因素之一。随着时间的推移,颅脑创伤还可以引起继发性脑损伤,最终因为氧化应激反应、炎症反应和兴奋性毒性作用而导致病情恶化[3]。颅脑创伤早期数小时或数天内,外周血细胞因子呈过表达[4⁃5]。晚近研究显示,炎症反应与颅脑创伤具有相关性,中枢神经系统炎症反应可以发生于颅脑创伤后数分钟内[6]。相关文献报道,死亡后的脑组织中存在高水平的炎性因子,诸如白细胞介素(IL)⁃1β、IL⁃2、IL⁃4、IL⁃6、IL⁃8、IL⁃10、干扰素⁃γ(IFN⁃γ)和肿瘤坏死因子⁃α(TNF⁃α)等[7]。然而,数周和数月后(急性期和慢性期)是否仍呈过表达,目前尚不清楚。关于调节活性氧的酶类,诸如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶类等介导抗氧化作用的相关报道亦较少[8]。推测是炎症反应和氧化应激联合作用共同影响颅脑创伤患者的预后。本研究探讨重型颅脑创伤(sTBI)急性期和慢性期外周血炎症反应标志物表达变化和氧化应激反应与预后的相关性,以为临床治疗颅脑创伤提供依据。
资料与方法
一、临床资料
1.纳入标准 (1)根据临床症状和影像学表现明确诊断为颅脑创伤。(2)经临床症状和实验室检查证实存在神经损伤。(3)在神经康复科住院治疗,呈昏迷、植物状态生存(VS)和最低意识状态(MCS)。(4)募集反应时间 15~ 40 d,平均为 28 d。(5)Glasgow昏迷量表(GCS)评分 ≤8分,存在持续性意识障碍,认知功能评分<4分,在募集反应时间内运动障碍评价量表(DRS)评分>17分。(6)本研究经陕西省核工业二一五医院道德伦理委员会审核批准,所有患者或其家属均知情同意并签署知情同意书。
2.排除标准 (1)存在神经变性病、抑郁症、其他神经系统疾病、自身免疫性疾病和严重代谢障碍性疾病的患者。(2)存在亚临床症状的患者,如无症状性泌尿系统感染或其他组织轻度损伤。
3.一般资料 选择2013年3月-2015年2月在陕西省核工业二一五医院和陕西省汉中市中心医院住院治疗的26例重型颅脑创伤患者,死亡1例、拒绝参与研究1例,最终纳入24例,男性17例,女性7例,年龄19~65岁,平均(38.84±2.86)岁;受教育程度5~17年,平均(10.43±0.72)年;致伤原因包括车祸伤20例(83.33%)、高空坠落伤4例(16.67%);头部CT显示无局灶性脑损伤6例(25%)、基底神经节损伤2例(8.33%)、额部损伤9例(37.50%)、枕部损伤2例(8.33%)、小脑损伤2例(8.33%)、中脑损伤2例(8.33%)、下丘脑损伤1例(4.17%),合并蛛网膜下隙出血(SAH)8例(33.33%);10例(41.67%)行颅骨切除术,14例(58.33%)行颅骨修补术,术后均出现神经功能缺损。
二、研究方法
1.酶活性和炎症反应标志物测定 所有患者分别于颅脑创伤后1个月(后急性期)、4个月(慢性期早期)和7个月(慢性期),清晨空腹采集外周静脉血3~5 ml,测定酶活性和炎症反应标志物水平。(1)酶活性测定:还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH,2 mmol/ml)、二甲亚砜(DMSO,1∶50)和还原型谷胱甘肽(GSH,1∶20)均为高级分析纯,为美国Sigma⁃Aldrich公司产品。采用德国Eppendorf公司生产的BioSpectrometer分光光度计[9]测定酶活性,包括谷胱甘肽过氧化物酶(GSH⁃Px)、超氧化物歧化酶、过氧化氢酶、谷胱甘肽还原酶(GR)和总血浆抗氧化剂活性(TEAA)。(2)炎症反应标志物水平测定:采用伯乐生命医学产品(上海)有限公司生产的 Bio⁃Plex Pro Human Cytokine 4⁃Plex Assay试剂盒测定炎症反应标志物水平,包括IL⁃1β和IL⁃6、IFN⁃γ和TNF⁃α。
2.神经心理学测验 所有患者分别于随访开始时和结束时采用功能独立性评价(FIM)[10]和DRS量表[11]评价认知功能和运动功能。(1)FIM 量表:包括运动功能和认知功能两部分,用于评价生活自理能力、括约肌控制能力、转移行走能力、交流能力和社会认知能力。共包括18项内容,每项评分7分,总评分为126分(运动功能评分91分、认知功能评分35分),评分越高、独立性越佳。(2)DRS量表:包括关节灵活性和稳定性、肌力和肌张力、反射、运动模式、协调性、平衡能力和步态共6项内容,每项评分0~5分,总评分30分,评分越高、运动障碍越严重。根据Till等[12]的方法,将不同神经心理学测验评分转化为标准化Z值,Z值<0,表明总体认知功能(包括执行功能、记忆力和注意力)低于健康人群平均值;Z值≥0,表明总体认知功能(包括执行功能、记忆力和注意力)高于健康人群平均值。同时计算认知功能综合指数(SI)[13],即为相同认知域所有Z值的平均值;全部认知功能指数(CPI),即为所有认知域Z值的平均值,CPI≥⁃1分,表明总体认知功能正常,CPI<⁃1分,表明总体认知功能低于正常值下限。
三、统计分析方法
采用SPSS 22.0统计软件进行数据处理与分析。呈正态分布的计量资料以均数±标准差(x±s)表示,采用单因素方差分析,两两比较行LSD⁃t检验。外周血炎症反应标志物表达变化和氧化应激反应与预后的相关性采用Pearson相关分析。以P≤0.05为差异具有统计学意义。
结 果
一、外周血炎症反应标志物和氧化应激参数表达变化
颅脑创伤患者不同时期(后急性期、慢性期早期、慢性期)IL⁃6、IFN⁃γ、GSH⁃Px、SOD和CAT水平差异有统计学意义(均P<0.05,表1),其中,IL⁃6和GSH⁃Px水平慢性期早期和慢性期低于后急性期(均P<0.05),慢性期亦低于慢性期早期(均P<0.05);SOD水平慢性期早期和慢性期高于后急性期(均P<0.05),而慢性期与慢性期早期差异无统计学意义(P>0.05);CAT水平仅慢性早期高于后急性期(P<0.05),而慢性期与后急性期、慢性期与慢性期早期差异无统计学意义(均P>0.05,表2)。
二、认知功能和运动功能评价
本组患者随访过程中CPI逐渐升高,由(⁃1.81±0.21)分升高至(⁃0.82±0.23)分,至随访结束时,意识较低者2例、意识恢复者22例。与随访初期相比,随访结束时FIM评分升高(P=0.000)、DRS评分降低(P=0.000),且差异有统计学意义(表3)。
三、炎症反应标志物和氧化应激参数与认知功能的相关性分析
Pearson相关分析显示,IL⁃6和GSH⁃Px表达变化与CPI呈正相关(均P<0.05),IL⁃6与SI之注意力和执行功能呈正相关(均P<0.05),IFN⁃γ和TNF⁃α仅与SI之执行功能呈正相关(均P<0.05),GSH⁃Px与SI均呈正相关(P<0.05,表4)。
讨 论
重型颅脑创伤患者血清炎症反应标志物表达变化目前尚未完全阐明,相关研究报道较少,特别是关于创伤后3~12个月血清炎症反应标志物表达变化的研究甚少[14]。尽管业已明确重型颅脑创伤相关氧化应激反应酶类,但创伤后这些酶类的表达变化尚未见临床试验,已报道的研究主要基于动物实验[15]。由于目前患者家属和临床医师不仅关心颅脑创伤患者的生存率,而且更加关注预后和生活质量,因此,潜在的与临床结局相关的指标均具有重要意义。
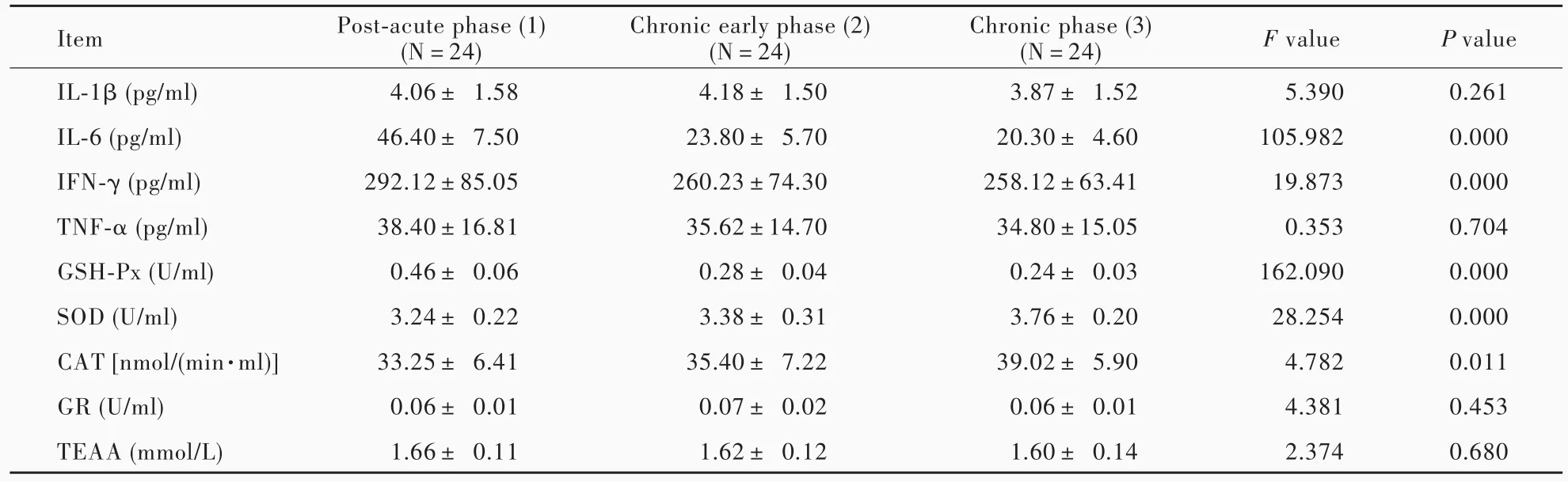
表1 重型颅脑创伤患者不同时期炎症反应标志物和氧化应激参数的比较(x±s)Table 1. Comparison of inflammatory markers and oxidative stress parameters in different phases of sTBI patients(x±s)
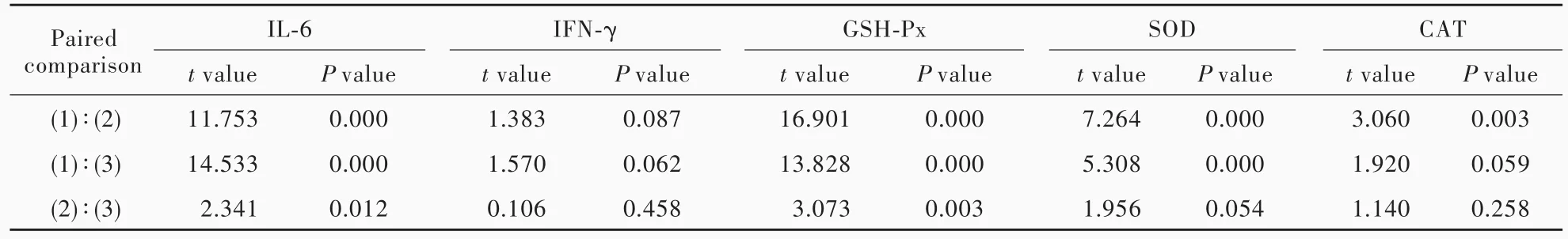
表2 重型颅脑创伤患者不同时期炎症反应标志物和氧化应激参数的两两比较Table 2. Paired comparison of inflammatory markers and oxidative stress parameters in different phases of sTBI patients
相关研究显示,重型颅脑创伤患者外周血IL⁃6、IL⁃8、IFN⁃γ和 TNF⁃α等炎症反应标志物在创伤早期即异常升高[16⁃17];至恢复期,经 NADPH 氧化酶作用快速生成超氧负离子和羟自由基,有利于创伤后氧化应激反应[18]。小胶质细胞富含NADPH氧化酶和活性氧,通过增强星形胶质细胞内线粒体活性[19]、促炎性因子生成和增强细胞毒性作用等,以诱发炎症反应。除NADPH氧化酶外,线粒体功能障碍和兴奋性毒性作用涉及的酶类还包括一氧化氮合酶(NOS)、细胞色素P450、环氧合酶(COX)、脂肪氧合酶和黄嘌呤氧化酶[20]。
本研究测定颅脑创伤患者不同时期(后急性期、慢性期早期、慢性期)血清炎症反应标志物和氧化应激参数表达变化,结果显示,随着时间的延长,IL⁃6和GSH⁃Px水平逐渐降低,SOD水平逐渐升高;并且持续高水平的细胞因子干扰认知功能的恢复,IL⁃6表达变化与注意力和执行功能呈正相关,但非颅脑创伤患者所特有,健康中老年人群的持续高水平IL⁃6亦与执行功能减退有关,而与记忆力减退无关联性。由此可见,颅脑创伤患者IL⁃6、IFN⁃γ和TNF⁃α持续高水平,反映出神经生理学损伤类型和认知功能恢复过程的轻微改变,使某些认知域的恢复缓慢或失衡。
动物实验显示,小鼠细胞外SOD过表达可以对慢性缺氧引起的脑组织损伤起保护作用[21⁃22]。本研究结果显示,SOD介导的氧化应激反应逐渐增强。超氧化物阴离子通过NADPH氧化酶生成,后者是小胶质细胞的代表酶类。由于SOD由其底物调节,其表达持续上调可以间接反映出过氧化物水平的升高。SOD表达上调可能作为一种补偿机制,对于颅脑创伤患者而言,血⁃脑屏障破坏和周围巨噬细胞激活,且创伤早期活性增强不同,从而引起过氧化物生成增加,这可能是后急性期与慢性期SOD水平差异有统计学意义的原因。
表3 重型颅脑创伤患者不同时期认知功能和运动功能的比较(±s,评分)Table 3. Comparison of cognitive function and motor function in different phases of sTBI patients±s,score)

表3 重型颅脑创伤患者不同时期认知功能和运动功能的比较(±s,评分)Table 3. Comparison of cognitive function and motor function in different phases of sTBI patients±s,score)
FIM,Functional Independence Measure,功能独立性评价;DRS,Dyskinesia Rating Scale,运动障碍评价量表
N 24 24 TimeBegin of follow⁃up End of follow⁃up t value P value FIM 18.53±2.44 89.33±9.25 36.260 0.000 DRS 23.21±0.41 7.64±1.55 49.010 0.000
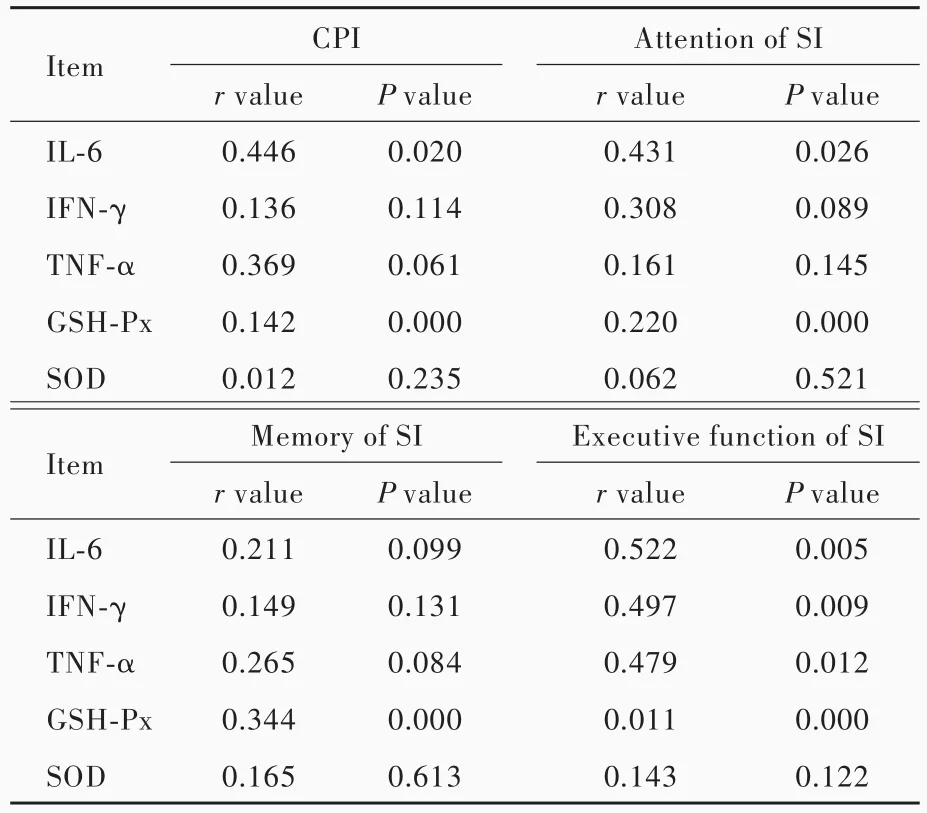
表4 重症颅脑创伤患者炎症反应标志物和氧化应激参数与认知功能的相关性Table 4. Pearson correlation analysis between inflammatory markers,oxidative stress parameters and cognitive function in sTBI patients
本研究尚存一定局限性,由于所纳入的患者处于持续昏迷状态,故研究结果不能代表全部重型颅脑创伤患者;所纳入的患者均存在神经功能缺损,故临床预后常无法预测。综上所述,重型颅脑创伤患者急性期氧化应激反应平衡的改变和炎症反应标志物的过表达,可以反映出功能恢复情况。因此,临床测定炎症反应标志物和氧化应激参数表达变化,可以为重型颅脑创伤患者功能评价和预后预测提供一定依据。
[1]Wiendl H,Kieseier B.Multiple sclerosis:reprogramming the immunerepertoire with alemtuzumabin MS[J].NatRev Neurol,2013,9:125⁃126.
[2]Tang YM.Experience of standardized treatment of 576 cases of craniocerebral injury[J].Zhongguo Yi Yao Zhi Nan,2012,10:505⁃506[.唐艳明.颅脑损伤规范化救治576例体会[J].中国医药指南,2012,10:505⁃506.]
[3]Ayton S,Zhang M,Roberts BR,Lam LQ,Lind M,McLean C,Bush AI,Frugier T,Crack PJ,Duce JA.Ceruloplasmin and beta⁃amyloid precursor protein confer neuroprotection in traumatic brain injury and lower neuronal iron[J].Free Radic Biol Med,2014,69:331⁃337.
[4]Chen GC.Relation analysis of inflammatory cytokines changes in early traumatic brain injury and prognosis[J].Zhejiang Chuang Shang Wai Ke,2014,(6):889⁃891[.陈光丑.颅脑损伤早期血清炎性细胞因子的变化与预后关系分析[J].浙江创伤外科,2014,(6):889⁃891.]
[5]Zhou P,Yuan ZC,Li QY,Zhan LP,Wang P.Changes and clinical significance of serum TNF⁃α and IL⁃10 contents in patients with acute brain trauma[J].Lin Chuang Shen Jing Wai Ke Za Zhi,2011,5:83⁃85[.周鹏,袁志诚,李巧玉,湛利平,王鹏.颅脑损伤后血清TNF⁃α和IL⁃10的含量变化及意义[J].临床神经外科杂志,2011,5:83⁃85.]
[6]Jha MK,Lee HW,Kim S,Suk K.Innate immune proteins as biomarkers for CNS injury:critical evaluation(WO2013119673 A1[)J].Expert Opin Ther Pat,2015,25:241⁃245.
[7]Frugier T,Morganti⁃Kossmann MC,O'Reilly D,McLean CA.In situ detection of inflammatory mediators in post mortem human brain tissue after traumatic injury[J].J Neurotrauma,2010,27:497⁃507.
[8]Bai LX,Song JN.Research progress of mechanism of oxidative stress injury after traumatic brain injury[J].Zhonghua Nao Ke Ji Bing Yu Kang Fu Za Zhi(Dian Zi Ban),2013,3:325⁃328[.白立曦,宋锦宁.创伤性脑损伤后氧化应激损伤机制研究进展[J].中华脑科疾病与康复杂志(电子版),2013,3:325⁃328.]
[9]Malaguti M,Baldini M,Angeloni C,Biagi P,Hrelia S.High⁃protein⁃PUFA supplementation,red blood cell membranes,and plasma antioxidant activity in volleyball athletes[J].Int J Sport Nutr Exerc Metab,2008,18:301⁃312.
[10]Granger CV,Reistetter TA,Graham JE,Deutsch A,Markello SJ,Niewczyk P,Ottenbacher KJ.The Uniform Data System for Medical Rehabilitation:report of patients with hip fracture discharged from comprehensive medical programs in 2000-2007[J].Am J Phys Med Rehabil,2011,90:177⁃189.
[11]Fork M,Bartels C,Ebert AD,Grubich C,Synowitz H,Wallesch CW.Neuropsychological sequelae of diffuse traumatic brain injury[J].Brain Inj,2005,19:101⁃108.
[12]Till C,Colella B,Verwegen J,Green RE.Postrecovery cognitive decline in adults with traumatic brain injury[J].Arch Phys Med Rehabil,2008,89(12 Suppl):25⁃34.
[13]Govind V,Gold S,Kaliannan K,Saigal G,Falcone S,Arheart KL,Harris L,Jagid J,Maudsley AA.Whole⁃brain proton MR spectroscopic imaging of mild⁃to⁃moderate traumatic brain injury and correlation with neuropsychological deficits[J].J Neurotrauma,2010,27:483⁃496.
[14]Kumar RG,Boles JA,Wagner AK.Chronic inflammation after severe traumatic brain injury:characterization and associations with outcome at 6 and 12 months postinjury[J].J Head Trauma Rehabil,2014,30:369⁃381.
[15]Shu LF,Liu JC,Wang JB,Yang YY,Ma T,Zhuo JW.Influence ofhypoxic preconditioning in anti⁃oxidative ability and neurological functions in traumatic brain injury rats[J].Zhonghua Shen Jing Yi Xue Za Zhi,2014,13:576⁃580.[疏 龙飞,刘家传,王金标,杨艳艳,马涛,卓健伟.缺氧预处理对颅脑损伤大鼠抗氧化应激和神经功能的影响[J].中华神经医学杂志,2014,13:576⁃580.]
[16]Zhang YW,Xie Y,Chen YQ,Han M,Huang K.Analyze the dynamic changes of serum TNF⁃α,IL⁃1β level in patients with traumatic brain injury acute phase[J].Xian Dai Yi Yuan,2014,14:18⁃20[.张摇威,谢扬,陈郁强,韩溟,黄铿.颅脑损伤患者急性期血清TNF⁃α和IL⁃1β水平的动态变化分析[J].现代医院,2014,14:18⁃20.]
[17]Huan XL,Chen HZ,Cui ZH.Dynamic changes and clinical significance ofserum inflammatory factorsin patientswith acute craniocerebral trauma[J].Shi Yong Lin Chuang Yi Yao Za Zhi,2015,19:50⁃52[.郇心乐,陈宏尊,崔振华.急性颅脑损伤患者血清炎症因子的动态变化及临床意义[J].实用临床医药杂志,2015,19:50⁃52.]
[18]Angeloni C,Prata C,Dalla Sega FV,Piperno R,Hrelia S.Traumatic brain injury and NADPH oxidase:a deep relationship[J].Oxid Med Cell Longev,2015:ID370312.
[19]Motori E,Puyal J,Toni N,Ghanem A,Angeloni C,Malaguti M,Cantelli⁃Forti G,Berninger B,Conzelmann KK,Götz M,Winklhofer KF,Hrelia S,Bergami M.Inflammation⁃induced alteration of astrocyte mitochondrial dynamics requires autophagy for mitochondrial network maintenance[J].Cell Metab,2013,18:844⁃859.
[20]Chen D,Liu Q,Chen SQ.Mitochondrial permeability transition pore and ischemic hypoxic injuries of brain[J].Zhongguo Jian Kang Xin Li Xue Za Zhi,2011,19:381⁃384[.陈冬,刘青,陈书起.线粒体膜通透性转运孔与缺血缺氧性脑损伤[J].中国健康心理学杂志,2011,19:381⁃384.]
[21]Li HN,Jiang YM,Zhao P,Zhou R,Yu JQ.Effect of oxymatrine on oxidative stress after hypoxic ischemic brain damage of neonatal rats[J].Ningxia Yi Ke Da Xue Xue Bao,2016,38:743⁃745[.李海宁,江玉敏,赵鹏,周茹,余建强.氧化苦参碱对缺氧缺血性脑损伤新生大鼠脑组织氧化应激指标的影响[J].宁夏医科大学学报,2016,38:743⁃745.]
[22]Zaghloul N,Patel H,Codipilly C,Marambaud P,Dewey S,Frattini S,Huerta PT,Nasim M,Miller EJ,Ahmed M.Over expression of extracellular superoxide dismutase protects against brain injury induced by chronic hypoxia[J].PLoS One,2014,9:E108168.
