磁共振表现为双侧小脑中脚对称性损害4例并文献复习
2018-05-09沈遥遥戴庭敏官燕琴聂红兵
沈遥遥, 戴庭敏, 鲍 兵, 官燕琴, 聂红兵
小脑中脚(middle cerebellar peduncle,MCP)主要由小脑前下动脉(anterior inferior cerebellar,AICA)供应,部分由小脑上动脉(superior cerebellar artery,SCA)供应[1]。传入纤维的皮质脑桥小脑束参与其主要构成并在传统磁共振成像技术上显示为均匀一致的白质信号。双侧MCP对称性异常信号主要见于脑桥-橄榄核-小脑萎缩(olivopontocerebellar atrophy,OPCA),而其他病因十分少见。本组报道了4例不同病因所致双侧MCP对称性损害,并通过文献复习加强对该种特异性影像学改变的认识,从而提高临床诊断水平。
1 临床资料
病例1,男,60岁。因行走不稳、精神障碍2 d入院。2 d前饮酒后出现双下肢行走不稳,步态蹒跚,需家属搀扶,四肢活动笨拙,言语含糊不清。伴胡言乱语、不认识家属、反应迟钝、记忆力减退。既往饮酒40 y(平均500 g/日,白酒),长期吸烟史。入院体检:血压 130/80 mmHg,言语笨拙,记忆力、计算力、定向力减退。四肢腱反射减弱。双侧指鼻试验、快速轮替试验及跟膝胫试验阳性。入院后头部MRI示:双侧MCP对称性等T1、长T2信号及T2Flair高信号,DWI未见弥散受限(见图1)。头部MRA未见血管狭窄或闭塞征象。脑电图示:双侧大脑半球见阵发性中波幅慢波。肌电图示:四肢感觉神经传导速度减慢。脑脊液压力120 mmH2O,常规、生化正常范围,脑脊液细菌、真菌、结核杆菌检测阴性。生化示:血钾3.3 mmol/L,门冬氨酸氨基转移酶56 IU/ L,丙氨酸氨基转移酶80 IU/ L。入院诊断:酒精中毒性脑病。予酒精戒断、营养神经及补充能量治疗3 w后好转出院。
病例2,男,42岁。因头晕、视物旋转14 d,加重伴言语不清、行步不稳3 d入院。14 d前突发头晕、视物旋转,伴呕吐数次,随后出现双耳听力下降,当地医院予抗血小板、降脂等治疗后头晕稍好转出院。3 d前再发上述症状,并出现言语不清、行走不稳。既往有高血压病、高脂血症及长期吸烟史。入院体检:血压160/100 mmHg,言语笨拙,双眼可见水平向眼震。四肢腱反射活跃。双侧指鼻试验、快速轮替试验及跟膝胫试验阳性。入院后头部MRI示:双侧MCP对称性长T1、长T2信号及DWI弥散受限;头部MRA示:右侧椎动脉颅内段闭塞,右侧大脑后动脉起始段高度狭窄(见图2)。生化示:高密度脂蛋白0.66 mmol/L,C反应蛋白8.36 mg/L。入院诊断:双侧小脑中脚梗死。按脑梗死常规治疗2 w后出院,患者头晕、眼震症状消失,听力、言语部分恢复,家属扶助下可行走。
病例3,男,73岁。因言语不清、肢体无力5 m,加重2 m入院。5 m前因突发言语不清、肢体无力于当地医院行头部MRI示双侧脑桥梗死,按脑梗死常规治疗后好转出院,遗留双侧肢体力弱、言语不清。2 m前逐渐出现四肢活动笨拙,起身站立困难。既往有高血压、糖尿病病史。入院体检:血压 140/82 mmHg,言语笨拙,右侧额纹、鼻唇沟浅,示齿口角稍向左侧偏斜,双侧软腭抬举力无力,伸舌右偏。右侧肢体肌力Ⅳ级,左侧肢体肌力Ⅲ级,肌张力增高,四肢腱反射活跃,双侧Rossolimo征、Babinski阳性。双侧指鼻试验、跟膝胫试验阳性。入院头部MRI示:双侧脑桥软化灶;双侧MCP对称性等T1、长T2信号,T2Flair高信号,DWI未见弥散受限(见图3)。生化示:低密度脂蛋白2.0 mmol/L。入院诊断:双侧小脑中脚华勒氏变性。继续按脑卒中二级预防治疗并转康复科行康复训练。
病例4,女,62岁。因运动迟缓2 y,言语不清、肢体抖动1 y入院。2 y前出现运动迟缓,进行性加重,开始表现为行走缓慢,逐渐出现翻身、行走困难,感四肢僵硬。1 y前出现言语不清,语速慢,右侧肢体抖动,呈持续性,伴便秘及尿失禁。2016年7月于我院诊断考虑多系统萎缩,予美多巴治疗未见改善。后于外院加用普拉克索仍未见改善。入院时体检:血压80/55 mmHg,语言含糊,记忆力、计算力减退,构音欠清。四肢肌张力增高,腱反射活跃,双侧Rossolimo征阳性。双侧指鼻试验、轮替试验阳性。入院头部MRI示:双侧小脑半球及脑干萎缩,双侧MCP对称性长T1、长T2信号及T2Flair高信号,DWI未见明显受限(见图4)。头部MRA未见颅内动脉狭窄或闭塞。膀胱残余尿量测定约90 ml。生化示:尿酸510 μmol/L。临床诊断为多系统萎缩。予调整用药剂量后仍无明显效果,1 w后出院随访观察。
2 讨 论
以往临床研究认为,双侧MCP T2WI高信号是OPCA的影像学特征之一。然而,愈多文献报道发现该种影像学表现亦可见于其他病因。此前,Okamoto K等于2003年回顾性分析了27例不同疾病所致双侧MCP异常信号,其中以神经系统变性病最为多见,包括OPCA、脊髓小脑性共济失调及Shy-Darger综合征;其次是代谢性疾病,包括肾上腺脑白质营养不良、肝豆状核变性、酒精性肝硬化、低血糖昏迷;脑血管病包括AICA梗死、高血压脑病、环孢素A脑病;脱髓鞘及免疫性疾病包括多发性硬化、急性播散性脑脊髓炎、白塞氏病、HIV脑病;肿瘤包括淋巴瘤、胶质瘤、脑膜癌[2]。因此,双侧MCP异常信号的病因复杂多样。而本组报道的4例患者的不同之处在于其影像学均表现为双侧MCP对称性异常信号,病因分别为酒精中毒性脑病、双侧小脑中脚梗死、脑桥梗死继发华勒氏变性和多系统萎缩。为探究是否此影像学改变同样见于其他疾病,我们对中英文数据库进行文献检索,现将文献复习后的病因归纳如下。
2.1 中枢神经系统变性病 (1)多系统萎缩(multiple system atrophy,MSA)是一种成人起病的散发性的神经系统变性病,临床以帕金森综合征、小脑性共济失调和自主神经功能障碍的任意组合为特征[3]。MSA影像学特征包括脑桥、小脑和壳核萎缩,其中最具意义的是脑桥十字征和壳核裂隙征。此外,双侧MCP对称性高信号是用于鉴别帕金森病或其他非典型帕金森综合征的有利影像学证据[4]。Ngai S等报道的122例MSA患者中,有17例出现双侧MCP Flair像高信号[5]。而国内一项研究发现该种影像征象的出现率约为38%[6],且多见于以小脑性共济失调为突出表现的MSA-c型。(2)脊髓小脑性共济失调(spinocerebellar ataxia,SCA) 是一组以进展性共济失调为特征的常染色体显性遗传性神经系统变性疾病。目前报道已有40种亚型,中国以SCA3型最多见。小脑、脑干、基底节及某些特定的大脑皮质区域萎缩是SCA的主要影像学表现[7]。在Okamoto的回顾性研究中,T2WI对称性高信号可见于SCA2和SCA6[2]。另外,该作者对4例SCA3患者行MRI检查均未见双侧MCP异常信号。其中1例行病理活检显示脑桥核、桥横纤维、SCP、MCP明显萎缩伴神经元却失,而导致组织亲水性增强的病理表现(脱髓鞘和胶质细胞增生)缺如,因而MRI未见T2WI和FLAIR像高信号[8]。因此,我们推测绝大多数SCA患者的MRI表现为MCP萎缩而无信号改变与其所处的病理阶段相关。(3)克雅氏病(Creutzfeldt-Jakob disease,CJD)是一种罕见的由朊蛋白感染所致的以迅速进展性痴呆及精神行为异常为主要临床表现的中枢神经系统变性疾病。其常见影像学改变是DWI出现皮质彩带征和双侧尾状核、豆状核对称性高信号。Nishida T报道了1例罕见的散发性CJD患者,其MRI除表现为小脑和大脑皮质萎缩、基底节区高信号外,还出现双侧MCP T2WI对称性高信号[9]。
2.2 中毒/代谢性疾病 (1)酒精中毒性脑病:慢性酒精摄入将直接或间接导致酒精相关性谱系疾病,包括韦尼克脑病、Marchiafava-Bignami disease (MBD)、渗透性脱髓鞘综合征、肝性脑病及酒精戒断综合征[10]。其中,脑桥外髓鞘溶解症的MRI表现为基底节、丘脑、外侧膝状体、小脑及大脑皮质对称性信号改变。而MCP受累的病例报道少见,陈学强等报道的18例慢性酒精中毒性脑病患者中有2例出现双侧MCP对称性异常信号[11]。(2)肾上腺脑白质营养不良(adrenoleukodystrophy,ALD)是一种以进行性脑功能障碍以及肾上腺皮质功能不全为主要表现的X-连锁隐性遗传的脂质代谢病。其特征性影像学表现为双侧侧脑室三角区周围白质对称性分布的蝶形病灶。此外亦有关幕下结构如脑桥的锥体束、小脑中脚及小脑白质受累的报道[2]。(3)肝豆状核变性(Wilson’s Disease)是一种常染色体隐性遗传的铜代谢障碍疾病。MRI显示其病变范围广泛,异常信号包括壳核、尾状核、丘脑、脑干、脑白质、皮质及小脑[12]。MCP受累并不多见,唐业斌等回顾性分析了72例异常影像改变的肝豆状核变性病患者,发现MCP受累仅占1.4%[13]。(4)海洛因中毒:海洛因中毒性脑病由Wolters等于1982年首次报道,其典型影像学表现是小脑、脑后部白质包括内囊后肢受累[14]。而Keogh CF报道的1例海洛因中毒患者除损害皮质下白质、小脑齿状核外,还累及双侧SCP/MCP、中脑的内侧丘系和脊髓丘系以及黑质和红核[15]。(5)低血糖脑病(hypoglycemic encephalopathy)是由于各种原因引起的严重低血糖而导致中枢神经系统功能障碍,出现意识障碍、精神行为异常、痫样发作及局灶性神经功能缺损体征等。由于不同部位脑组织对缺氧耐受性不同,病变易选择性的累及基底节区、大脑皮质、海马、胼胝体压部和皮质下白质[16],Okamoto K和Yamashita C分别报道了1例少见影像学表现的低血糖脑病患者,其病灶亦可累及丘脑、脑干、小脑及MCP[2,17]。
2.3 脑血管病 (1)双侧MCP梗死:以往病例报道认为该种特殊类型梗死的患者大多存在椎-基底动脉严重狭窄或闭塞。推测其发病机制是由于MCP是AICA和SCA供应的分水岭区,当椎动脉和(或)基底动脉突发严重狭窄或闭塞时,双侧MCP这一分水岭区低灌注,因此处侧支循环代偿不充分而易受到缺血损害,最终形成双侧MCP对称性梗死,而不累及脑干或小脑[18,19]。(2)华勒氏变性(Wallerian degeneration,WD)是一种继发于轴索离断或神经元损伤后出现进行性髓鞘脱失和远端轴索碎裂的病理过程。WD常见于皮质脊髓束,但亦见于其他少见的传导通路,如脑桥小脑束、齿状核-红核-橄榄通路、脊髓后索、胼胝体、边缘环路及视觉传导通路[20]。脑桥梗死后出现双侧MCP对称性信号是由于脑桥小脑纤维在脑桥基底部中线处交叉,即使是一侧脑桥的缺血性损害也可出现双侧MCP受累[21]。
3 总结
本文总结了不同病因所致双侧MCP对称性异常信号,包括中枢神经系统变性病、中毒及代谢性疾病和脑血管病。同时,对于不同病因所致的MCP异常信号的影像学研究进行文献复习,以加深临床医生对该种特异性影像学表现的认识,也为临床鉴别诊断起到一定的指导意义。
[参考文献]
[1]Amarenco P,Hauw JJ.Cerebellar infarction in the territory of the anterior and inferior cerebellar artery.A clinicopathological study of 20 cases[J].Brain,1990,113:139-155.
[2]Okamoto K,Tokiguchi S,Furusawa T,et al.MR features of diseases involving bilateral middle cerebellar peduncles[J].AJNR,2003,24(10):1946-1954.
[3]Stefanova N,Backe P,Duerr S,et al.Multiple system atrophy: an update[J].Lancet Neurol,2009,8(12):1172-1178.
[4]Lee EA,Cho HI,Kim SS,et al.Comparison of magnetic resonance imaging in subtypes of multiple system atrophy[J].Parkinsonism Relat Disord,2004,10:363-368.
[5]Ngai S,Tang YM,Du L,et al.Hyperintensity of the middle cerebellar peduncles on fluid-attenuated inversion recovery imaging:variation with age and implications for the diagnosis of multiple system atrophy[J].AJNR,2006,27(10):2146-2148.
[6]朱开端,雷惠新,郑 峥.21例多系统萎缩患者的临床特点与磁共振成像特征分析[J].中风与神经疾病杂志,2013,30(12):1109-1111.
[7]Baldarcara L,Currie S,Hadjivassiliou M,et al.Consensus paper:radiological biomarkers of cerebellar diseases[J].Cerebellum,2015,14:175-196.
[8]Imon Y,Katayama S,Kawakami H,et al.A necropsied case of Machado-Joseph disease with a hyperintense signal of transverse pontine fibers on long TR sequences of magnetic resonance images[J].J Neurol Neurosurg Psychiatry,1998,64(1):140-141.
[9]Nishida T,Tokumaru AM,Doh-Ura K,et al.Probable sporadic Creutzfeldt-Jakob disease with valine homozygosity at codon 129 and bilateral middle cerebellar peduncle lesions[J].Intern Med,2003,42(2):199-202.
[10]Zuccoli G,Siddiqui N,Cravo I,et al.Neuroimaging findings in alcohol-related encephalopathies[J].Am J Roentgenol,2010,195(6):1378-1384.
[11]陈学强,张云枢,罗庆华,等.慢性酒精中毒性脑病的MRI表现[J].中国医学影像技术,2007,23(9):1285-1287.
[12]Sinha S,Taly AB,Ravishankar S,et al.Wilson’s disease: cranial MRI observations and clinical correlation[J].Neuroradiology,2006,48(9):613-621.
[13]唐业斌,赵科伕,卢 琦,等.肝豆状核变性的临床特征与颅脑MRI表现的相关性分析[J].临床放射学杂志,2009,28(9):1220-1223.
[14]Lefaucheur R,Lebas A,Gerardin E,et al.Leucoencephalopathy following abuse of sniffed heroin[J].J Clin Neurosci,2017,35:70-72.
[15]Keogh CF,Andrews GT,Spacey SD,et al.Neuroimaging features of heroin inhalation toxicity:“chasing the dragon”[J].Am J Roentgenol,2003,180(3):847-850.
[16]连立飞,李杜娟,黄丽娜,等.低血糖脑病的临床和神经影像学特点[J].临床神经病学杂志,2010,23(1):21-23.
[17]Yamashita C,Shigeto H,Maeda N,et al.Transient interhemispheric disconnection in a case of insulinoma-induced hypoglycemic encephalopathy[J].J Neurol Sci,2013,335(1~2):233-237.
[18]沈遥遥,戴庭敏,陈 蕊,等.双侧对称性小脑中脚梗死1例[J].中华神经科杂志,2015,48(8):707-708.
[19]Kataoka H,Iznmi T,Kinoshita S,et al.Infarction limited to both middle cerebellar peduncles[J].J Neuroimaging,2011,21(2):e171-172.
[20]Chen YJ,Nabavizadeh SA,Vossough A,et al.Wallerian degeneration beyond the corticospinal tracts: conventional and advanced MRI findings[J].J Neuroimaging,2017,27(3):272-280.
[21]Nabavizadeh SA,Mowla A,Mamourian AC.Wallerian degeneration of the bilateral middle cerebellar peduncles[J].Journal of the Neurological Sciences,2015,349:256-257.
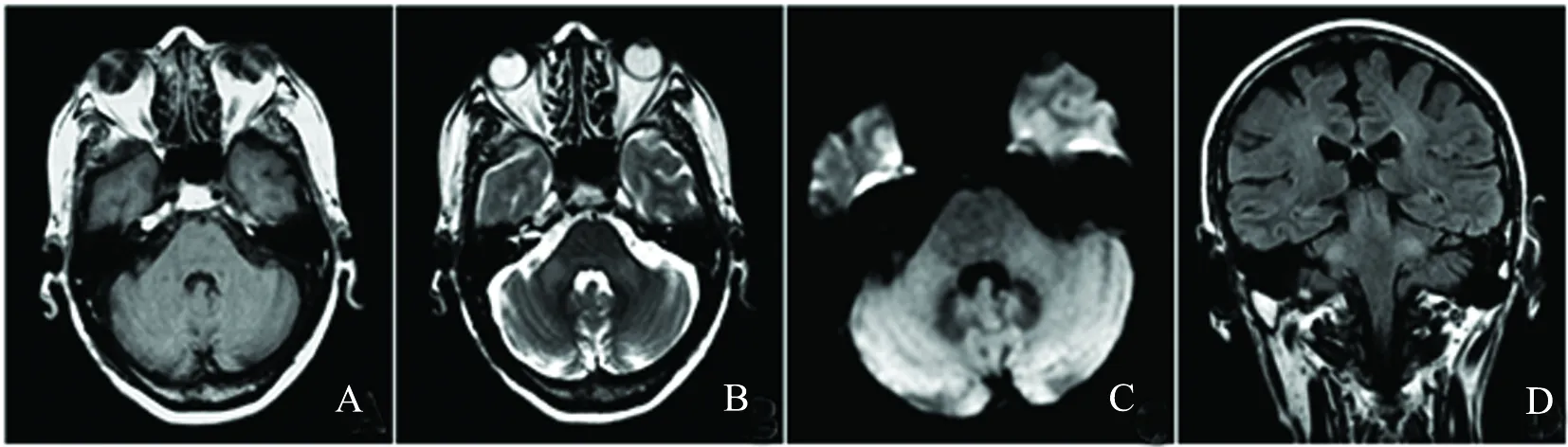
图1 双侧MCP示T1WI等信号(A),T2WI高信号(B),DWI未见弥散受限(C),T2FLARI高信号(D)

图2 双侧MCP示T1WI低信号(A),T2WI高信号(B),DWI(C)高信号。MRA示右侧椎动脉闭塞(D)

图3 双侧脑桥示片状长T1、长T2信号(A,B);双侧MCP示长T2信号(B),T2Flair高信号(D),DWI未见弥散受限(C)

图4 双侧MCP示长T1、长T2信号(A,B),T2Flair高信号(D),DWI未见弥散受限(C)
