双氯芬酸与塞来昔布联合阿片类药物对转移性骨癌痛的临床效果
2018-05-08吴必武韩宏德黄国定
吴必武 韩宏德 黄国定
转移性骨癌痛是恶性肿瘤骨转移后出现的严重骨痛,在临床中是比较常见的癌症疼痛之一[1-3]。转移性骨癌痛的临床表现为:其一,持续性基础疼痛;其二,突发性的剧烈暴发痛。癌症患者晚期出现骨转移情况普遍,转移癌细胞增殖会引起局部骨组织破坏,造成病理性骨折或者病理性骨痛等不良后果,对患者的生活质量造成一定影响[4-6]。80%左右的股转移癌痛患者已经失去了手术的机会,采用阿片类药物联合双氯芬酸与塞来昔布等治疗手段可以充分缓解 骨痛,降低不良反应发生率,显著提高转移性骨癌痛患者的生存质量。笔者将根据相关工作经验,综合分析双氯芬酸与塞来昔布联合阿片类药物控制转移性骨癌痛的临床效果,为治疗转移性骨癌痛患者提供科学的数据参考。现报告如下。
1 资料与方法
1.1 临床资料
所有入组患者均经影像学和病理学检查,符合恶性肿瘤骨转移标准者,所有入组患者均在知晓情况下参与本次实验研究且签署相关同意书;排除对双氯芬酸、塞来昔布、硫酸吗啡缓释片过敏者,中途退出本次实验研究者以及精神障碍者。 对照组中有25例男性患者、14例女性患者;该组患者的平均年龄为(53.24±10.32)岁,平均体重为(55.55±3.36)kg,平均病程时间为(1.15±0.53)年。实验组中有26例男性患者、13例女性患者;该组患者的平均年龄为(53.51±10.22)岁,平均体重为(56.03±3.44)kg,平均病程时间为(1.19±0.51)年。两组患者在一般资料比较无统计学意义,具有可比性(P>0.05)。
1.2 方法
1.2.1 对照组 对照组应用阿片类药物(环磷酰胺片)治疗。环磷酰胺片:通化茂祥制药有限公司,国药准字H22026738,12片×2板/盒;一次1片,一天3~4次。根据疼痛缓解情况来调节用药量,直到缓解患者的疼痛感,连续治疗28 天。
1.2.2 实验组 实验组应用双氯芬酸与塞来昔布联合阿片类药物(环磷酰胺片)治疗。双氯芬酸:国药集团致君(深圳)坪山制药有限公司(原深圳致君制药有限公司),国药准字H10970209;一日1次,一次1片(100 mg);塞来昔布:辉瑞制药有限公司,国药准字J20120063;每日一次口服或100 mg 每日两次口服;环磷酰胺片:通化茂祥制药有限公司,国药准字H22026738,12片×2板/盒;一次1片,一日3~4次。根据疼痛缓解情况来调节用药量,直到缓解患者的疼痛感,连续治疗28 天。
1.3 观察指标
分析两组患者的视觉疼痛模拟评分(总分为10分,0分为无痛,1~3分为轻度疼痛,4~6分为中度疼痛、 7~ 10分为重度疼痛)、阿片类药物使用剂量、不良反应发生率、疼痛缓解率以及癌痛发作次数等参数指标。
1.4 疗效评价标准
明显缓解:所有患者接受相关治疗后,无疼痛症状,临床症状消失或者患者生活质量显著恢复正常;中度缓解:所有患者接受相关治疗后,无疼痛症状,临床症状有一定程度的消失或者患者生活质量有一定的改善;轻度缓解:所有患者接受相关治疗后,治疗后疼痛程度相比起治疗前显著减轻,临床症状或者患者生活质量改善程度较小;无缓解:所有患者接受相关治疗后,临床症状未消失。
1.5 统计学方法
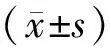
2 结果
2.1 两组患者治疗前后视觉疼痛模拟评分比较
治疗前,实验组患者视觉模拟疼痛评分为(8.36±0.74)分、对照组患者视觉模拟疼痛评分为(8.35±0.75)分,两组患者的视觉疼痛模拟评分比较无统计学意义(P>0.05);治疗后第14天、第21天、第28天实验组视觉疼痛模拟评分分别为(3.94±0.88)分、(3.27±0.84)分、(2.67±0.77)分,对照组视觉疼痛模拟评分分别为(4.61±0.89)分、(3.91±0.85)分、(3.42±0.81)分,治疗后第14天、第21天、第28天实验组视觉疼痛模拟评分显著低于对照组(P<0.05)。
2.2 两组患者治疗后不同时间段疼痛缓解率比较
治疗后第14天、第21天、第28天实验组疼痛缓解率分别为74.36%(29/39)、79.49%(31/39)、94.87%(37/39),对照组治疗后第14天、第21天、第28天实验组疼痛缓解率分别为51.28%(20/39)、58.97%(23/39)、76.92%(30/39),实验组疼痛缓解率远远高于对照组(P<0.05)。
2.3 两组患者治疗前后癌痛发作次数比较
治疗前一天,两组患者的癌痛发作次数比较无统计学意义(P>0.05);治疗后第14天、第21天、第28天实验组癌痛发作次数显著少于对照组(P<0.05),见表1。
2.4 两组患者治疗后不同时间段吗啡用量比较
治疗后第14天、第21天、第28天实验组吗啡用量分别为(53.1±17.3)mg、(66.7±18.0)mg、(84.1±22.1)mg,治疗后第14天、第21天、第28天对照组吗啡用量分别为(82.3±16.9)mg、(10.3.1±19.1)mg、(132.6±25.8)mg,治疗后第14天、第21天、第28天实验组吗啡用量显著少于对照组(P<0.05)。

表1 两组患者治疗前后癌痛发作次数比较次)
2.5 两组患者不良反应发生情况比较
实验组嗜睡、便秘不良反应发生率分别为7.69%(3/39)、5.13%(2/39),对照组嗜睡、便秘不良反应发生率分别为17.95%(7/39)、15.38%(6/39),实验组嗜睡、便秘不良反应发生率显著低于对照组(P<0.05),见表2。
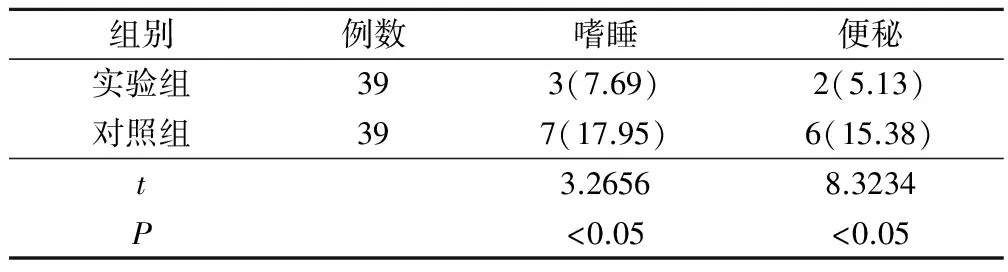
表2 两组患者不良反应发生情况比较(例,%)
3 讨论
现阶段来看,受到治疗措施的局限影响,75%左右的骨癌痛患者疼痛未得到有效的控制。吗啡是是世界卫生组织推荐的首选治疗药物之一,但是,单独使用吗啡药物治疗转移性骨癌痛的临床治疗效果受到限制[7-9]。临床研究者不断探索采用阿片类药物联合双氯芬酸与塞来昔布等治疗手段,不仅仅能够减少阿片类药物用量,在单纯镇痛的同时能够显著抑制癌细胞增殖,从而更好地缓解骨痛症状[10-13]。
阿片类药物是从罂粟中提取的生物碱以及各种人工合成衍生物,主要作用机制表现在以下几个方面:其一,抑制兴奋性递质释放从而减少痛觉传入;其二,发挥下行疼痛抑制作用,与我周神经的特异性阿片受体互为结合,能够起到不同程度止痛作用,与此同时能够获得良好的止痛效果。阿片类药物的个体差异比较大,临床中一般会根据患者的自身状况来制定用药方案和用药剂量[14-15]。本文研究结果显示治疗前,两组患者的视觉疼痛模拟评分比较无统计学意义(P>0.05);治疗后第14天、第21天、第28天实验组视觉疼痛模拟评分显著低于对照组(P<0.05)。
塞来昔布时特异性抑制剂,通过COX2的生理活性来降低前列腺素类物质的分泌,最终能够达到镇痛的作用。双氯芬酸是1种非甾体类化合物,一方面能够抑制炎症的发生,另外一方面能够促进软骨组织的形成,从而加速双氯芬酸的吸收速率。基于此,加快治疗转移骨癌痛患者的治疗速度。本文研究结果显示治疗后第14天、第21天、第28天实验组癌痛发作次数显著少于对照组(P<0.05),治疗后第14天、第21天、第28天实验组疼痛缓解率远远高于对照组(P<0.05)。双氯芬酸与塞来昔布联合阿片类药物能够显著抑制炎症反应,降低疼痛水平。双氯芬酸可以调节好神经元上的钾离子通道,降低电流密度从而抑制动作电位的发生。
综上所述,双氯芬酸与塞来昔布联合阿片类药物控制转移性骨癌痛的临床效果显著,具有重要的临床研究价值,值得广泛推广。
[1] 吴 昊.双氯芬酸与塞来昔布联合阿片类药物控制转移性骨癌痛的临床疗效〔J〕.实用癌症杂志,2015,12(2):181-184.
[2] 王楠娅,刘玉梅,赵恒军,等.影响慢性中重度癌痛患者疼痛治疗效果的相关因素分析〔J〕.中国肿瘤临床,2014,13(10):655-658.
[3] 周红英,吴国清,薛 骞,等.活血行气止痛方联合盐酸羟考酮控释片治疗骨转移性癌痛的效果观察〔J〕.中国中医药科技,2014,21(6):673-674.
[4] 孔天东,张彦华,张 洁,等.复方苦参注射液联合盐酸羟考酮控释片及唑来膦酸注射液对中重度骨转移疼痛的治疗作用〔J〕.中国中医药信息杂志,2014,14(8):105-106.
[5] 刘玉梅,邵宗鸿,李 薇,等.影响晚期癌症伴慢性中重度疼痛患者镇痛效果的因素分析〔J〕.临床肿瘤学杂志,2016,21(3):251-256.
[6] 童志前,李 艳,刘 佳,等.转移性骨癌痛的新机制:癌细胞产生的内源性甲醛激活外周神经纤维上的辣椒素受体〔J〕.中国疼痛医学杂志,2014,20(7):449-453.
[7] 郭 维,桂牧微.独活寄生汤辅助治疗阿片镇痛不全骨转移癌痛的疗效〔J〕.广东医学,2012,33(21):3332-3334.
[8] 杨忠明,谢 刚,廖大忠,等.癌痛散在恶性肿瘤骨转移疼痛治疗中的临床研究〔J〕.重庆医学,2016,45(28):3893-3895,3899.
[9] 施 烯,郑 敏,曾乌查,等.导水管周围灰质内注射黑皮质素受体4型拮抗剂HS014抑制乳腺癌骨转移模型大鼠骨癌痛〔J〕.中华实验外科杂志,2014,31(12):2817-2819.
[10] 刘伏嫦.羟考酮缓释片联合塞来昔布治疗骨转移性癌痛的疗效分析〔J〕.实用癌症杂志,2016,31(8):1391-1392.
[11] Koizumi Mitsuru,Yoshimoto Masataka,Kasumi Fujio.Post-operative breast cancer patients diagnosed with skeletal metastasis without bone pain had fewer skeletal-related events and deaths than those with bone pain〔J〕.BMC,2013,10(1):1255-1259.
[12] 汪 洋,王家林.趋化因子配体及其抗体对骨癌痛患者脊髓胶质细胞活化的影响及与骨癌痛的相关性〔J〕.中国老年学杂志,2013,33(2):421-422.
[13] Xu JY,Jiang Y,Liu W,et al.Calpain Inhibitor Reduces Cancer-induced Bone Pain Possibly Through Inhibition of Osteoclastogenesis in Rat Cancer-induced Bone Pain Model〔J〕.Chin Med J,2015,128(8):1102-1107.
[14] Babak Fallahi,Davood Beiki,Mohammad Bagher Khodapa-rast etc.Additive clinical value of bone scintigraphy in patients with malignant tumors with absence of localized bone pain: A report on most common sex-related cancers〔J〕.Iranian Journal of Nuclear Medicine,2012,19(1):1011-1013.
[15] LIU Hong,DONG Wen-yan,WANG Jian-bo etc.Association between salivary α-amylase activity and pain relief scale scores in cancer patients with bone metastases treated with radiotherapy〔J〕.中华医学杂志(英文版),2013,126(23):4444-4447.
