Let7a微小RNA和长链非编码RNAH19在甲状腺癌中的表达及预后预测
2018-05-08程传涛杨文彬
刘 娜,程传涛,杨文彬,周 琦*
(1西安交通大学第二附属医院医用超声研究室,西安 710004;2西安交通大学第二附属医院普通外科;*通讯作者,E-mail:zhouqi15@163.com)
甲状腺癌是最常见的内分泌恶性肿瘤,且近10年发病率增长迅速[1],甲状腺乳头状癌是主要的病理类型,占所有甲状腺恶性肿瘤的86%[2]。甲状腺癌影响人群广泛,从青少年到老年人,女性发病率是男性3倍,男性发病高峰要晚于女性10-20年[3]。甲状腺癌发病主要与基因变异有关,另外还有环境因素,目前被公认的环境因素为电离辐射[4]。甲状腺癌根治术是目前治疗甲状腺癌的主要方式,虽然绝大多数患者手术切除后有很好的总体生存率,但仍有一部分患者死于转移与复发。近年来研究发现,对甲状腺癌发生的分子机制的研究,有助于提供更加有效的治疗手段[5]。lncRNA H19在人胚胎组织、骨骼肌肉组织大量表达,其调节通路与许多肿瘤如胃肠道肿瘤、结肠肿瘤和膀胱肿瘤的基因凋亡有关[6]。但关于它在甲状腺癌发生发展过程中所扮演的角色鲜有报道。此外,报道称microRNA let7a在许多恶性肿瘤如结肠癌和喉癌中表达下调[7]。但尚无报道研究lnc RNA H19和miRNA let7a表达情况对于甲状腺癌预后的影响,因此,探索二者与甲状腺癌预后的相关性,期望为预测临床结局及靶向治疗和评价疗效提供分子学依据,是本研究的宗旨。
1 研究对象与方法
1.1 研究对象
收集从2009-01~2012-01在西安交通大学第二附属医院行甲状腺癌根治术的131例甲状腺癌组织和癌旁组织(距甲状腺癌组织3-5 cm)为病例组。同期收集122例行甲状腺部分切除术的甲状腺良性肿瘤的正常甲状腺组织作为对照组。所有标本用10%福尔马林固定并石蜡包埋,切片厚度4 μm备用。
纳入标准:①患者除了病理诊断为甲状腺癌,其他器官没有严重疾病;②患者尚未行甲状腺癌术后为期3周的放射治疗;③患者术前甲功正常;④患者无其他恶性肿瘤病史或放射线暴露史。
排除标准:①患者有远处转移或肺转移(包括合并其他肿瘤或原发性肺癌);②患者有精神疾患或情绪不稳定无法配合;③患者有慢性疾病如心肌梗死、脑卒中、心衰和心房纤颤;④患者有放射治疗病史。
1.2 实时定量聚合酶链反应检测
采用TRIzol法提取病例组与对照组样本组织标本RNA。按照TAKARA试剂盒说明反转录第一个单链DNA(TAKARA,宝生物工程大连有限公司),合成出的cDNA作为模板用于扩增H19和GAPDH(内参基因)。PCR引物序列见表1。
表1PCR引物序列
Table1PrimersequencesofPCR

基因 引物序列 GAPDH上游:5′-GGAGCGAGATCCCTCCAAAAT-3′下游:5′-GGCTGTTGTCTTACTTCTCATGG-3′ H19上游:5′-GAACACCTTAGGCTGGTGGG-3′下游:5′-ATGTTGTGGGTTCTGGGAGC-3′ let7a上游:5′-GCGCCTGAGGTAGTAGGTTG-3′下游:5′-CAGTGCAGGGTCCGAGGT-3′
PCR反应体系(20 μl)组成包括7.8 μl的双蒸馏水,1.0 μl DNA模板,各0.4 μl上游和下游引物,0.4 μl ROX参考染料(50x),10.0 μlSYBR.反应流程:95 ℃条件下,预变性2 min,接着40个循环,95 ℃,5 s;冷却到60 ℃,34 s,延伸到68 ℃,30 s;取各个样本的cDNA及其相对应的引物按照以上方法混合,然后进行PCR扩增,收集荧光信号,进行熔解曲线分析,反应结束后由系统自动计算相对定量的结果,每个样本重复3次。
1.3 随访
对患者的随访主要通过门诊复查、电话及邮件的方式,一般在术后1月进行一次,第一年每3个月随访一次,第二年每6个月随访一次,以后每一年随访一次,一直随访至2017年1月31号结束。随访率达到100%,所有患者相关的临床数据都被随访记录了5年。
1.4 统计分析
采用SPSS21.0统计软件进行数据分析。lncRNA H19和miRNA let7a表达情况的比较采用卡方检验和Fisher’s精确概率检验。ROC曲线评价lncRNA H19和miRNA let7a对甲状腺癌的诊断价值。Kaplan-Meier法分析甲状腺癌5年生存率,单因素和多因素分析影响甲状腺癌预后因素。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床病理特征
病例组包括男性43例,女性88例,年龄15-78岁,平均年龄(45.3±8.2)岁。对照组包括男性38例,女性84例,年龄20-74岁,平均年龄(47.1±8.7)岁。年龄和性别两组对比差异无明显统计学意义(P>0.05)。病例组中,87例肿瘤直径≥1.0 cm,44例肿瘤直径<1.0 cm。甲状腺癌术后病理分型中,78例为甲状腺乳头状癌,29例滤泡癌,24例髓样癌。52例肿瘤突破包膜,79例肿瘤未突破包膜。根据2002年UICC(Union for International Cancer Control)指南里甲状腺癌TNM分期[8],51例TNMⅠ+Ⅱ期,80例TNM Ⅲ+Ⅳ期,69例有淋巴结转移,62例没有淋巴结转移。
2.2 miRNA let7a和lncRNA H19在甲状腺癌组织、癌旁组织及正常甲状腺组织中的表达
qRT-PCR结果显示,miRNA let7a在甲状腺癌组织、癌旁组织及正常组织表达分别为0.54±0.31,1.03±0.43和1.13±0.38,miRNA let7a在甲状腺癌组织中表达降低(P<0.05)。lncRNA H19在甲状腺癌组织、癌旁组织及正常甲状腺组织中表达分别为4.02±0.85,3.24±0.73和3.07±0.81,lncRNA H19在甲状腺癌组织中表达升高(P<0.05)。lncRNA H19和miRNA let7a在癌旁组织和正常甲状腺组织中表达无明显差异(P>0.05,见图1)。
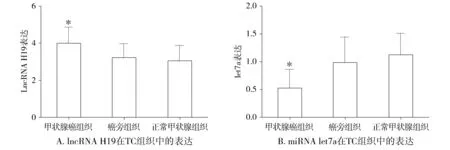
与癌旁组织和正常甲状腺组织比较,*P<0.05图1 lncRNA H19和miRNA let7a在甲状腺癌(TC)组织中的表达Figure 1 The expression of lncRNA H19 and miRNA let7a in TC
2.3 ROC曲线评价miRNA let7a和lncRNA H19对甲状腺癌的诊断价值
miRNA let7a ROC曲线下面积0.116 (95% CI 0.076-0.157),诊断阈值0.87,敏感度和特异度分别为84.0%和77.0%,约登指数0.61。lncRNA H19 ROC曲线下面积0.801(95% CI 0.747-0.855),诊断阈值3.58,敏感度和特异度分别为72.5%和75.4%。约登指数0.479。提示当miRNA let7a表达低于0.87或者lnc RNA H19表达超过3.58时,甲状腺癌发生机会增加(见图2)。
2.4 miRNA let7a和lncRNA H19表达水平与甲状腺癌临床病理特征的关系
根据约登指数,选取灵敏度和特异度之和的最高点为截断值,miRNA let7a诊断界点为0.87,≥0.87表示let7a高表达,<0.87表示let7a低表达。lncRNA H19诊断界点为3.58,≥3.58表示H19高表达,<3.58表示H19低表达。miRNA let7a和lncRNA H19表达情况在性别、年龄、组织病理分型和有无包膜浸润组间比较差异无明显统计学意义(P>0.05)。miRNA let7a和lncRNA H19表达在肿瘤直径≥1 cm和<1 cm组间比较,TNMⅠ+Ⅱ期和TNM Ⅲ+Ⅳ期组间比较,有无淋巴结转移组间比较,差异分别有统计学意义(均P<0.05)。在肿瘤直径≥1 cm,TNM Ⅲ+Ⅳ期,及伴随淋巴结转移组中,miRNA let7a低表达,相应的lncRNA H19高表达(P<0.05,见表2)。
2.5 miRNA let7a和lncRNA H19表达与甲状腺癌预后的相关性
术后随访5年的131例患者中,53例患者存活,78例患者死亡,死亡率59.5%。131例患者术后病理证实,21.3%(28/131)周围组织侵犯,10.7%(14/131)远处转移,6.1%(8/131)对侧甲状腺转移,52.6%(69/131)颈部淋巴结转移。远处转移的病例中,8例肺转移,1例肝转移,4例骨转移,1例肾上腺转移。其中乳头状癌死亡41例,髓样癌死亡18例,滤泡状癌死亡19例。其中64例死于该肿瘤,14例死于远处转移。Kaplan-Meier生存分析曲线显示,miRNA let7a低表达者5年生存率35.2%(37/105),高表达者5年生存率61.5%(16/26),低表达者预后差,二者比较差异有统计学意义(P<0.05);lncRNA H19高表达者5年生存率28.44%(27/95),低表达者5年生存率72.2%(26/36),高表达者预后差,二者比较差异有统计学意义(P<0.05,见图3)。
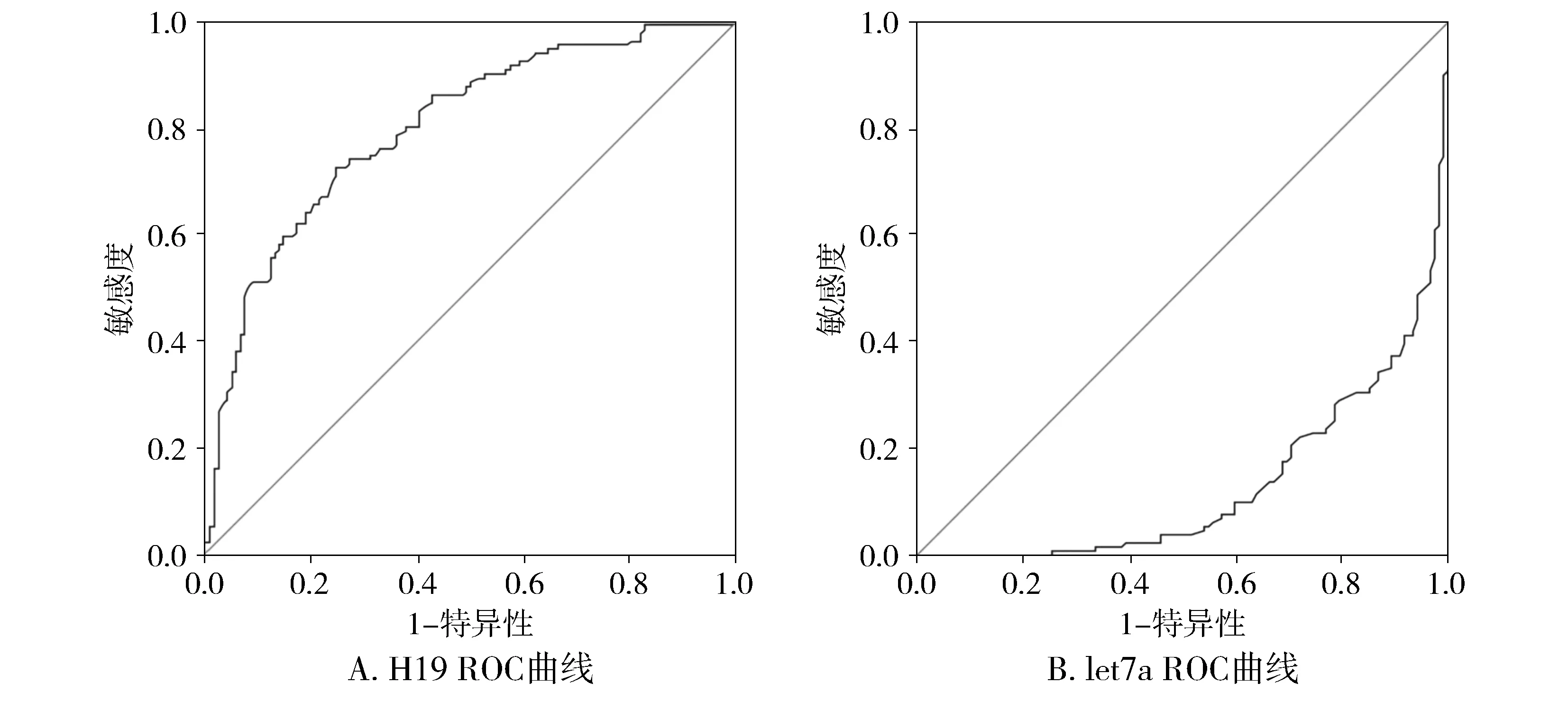
图2 lncRNA H19和miRNA let7a表达对TC诊断的ROC曲线Figure 2 ROC curve analysis of lncRNA H19 and miRNA let7a expression for TC
表2lncRNAH19和miRNAlet7a表达水平与甲状腺癌不同临床病理特征的相关性
Table2AssociationoflncRNAH19andmiRNAlet7aexpressionwithdifferentclinicopathologicalfeaturesofTC

临床病理特征总数lncRNAH19高表达(n=95)低表达(n=36)χ2PmiRNAlet7a高表达(n=40)低表达(n=91)χ2P性别2531011201240725 男4335(8140)8(1860)14(3256)29(6744) 女8860(6818)28(3182)26(2955)62(7045)年龄0137071100120912 <45岁5843(7414)15(2586)18(3103)40(6897) ≥45岁7352(7123)21(2877)22(3014)51(6986)肿瘤直径8915000480530005 <10cm4425(5682)19(4318)21(4773)23(5227) ≥10cm8770(8046)17(1954)19(2184)68(7816)组织病理分型3644016204350805 乳头状癌7860(7692)18(2308)25(3205)53(6795) 滤泡状癌2917(5862)12(4138) 9(3103)20(6897) 髓样癌2418(7500)6(2500)6(500)18(7500)包膜浸润2202013812970255 有5234(6538)18(3462)14(2692)38(7308) 无7961(7722)18(2278)26(3291)53(6709)TNM分期5771001625300<0001 Ⅰ+Ⅱ5131(6078)20(3922)29(5686)22(4314) Ⅲ+Ⅳ8064(8000)16(2000)11(1375)69(8625)淋巴结转移5461001916130<0001 有6956(8116)13(1884)10(1449)59(8551) 无6239(6290)23(3710)30(4839)32(5161)
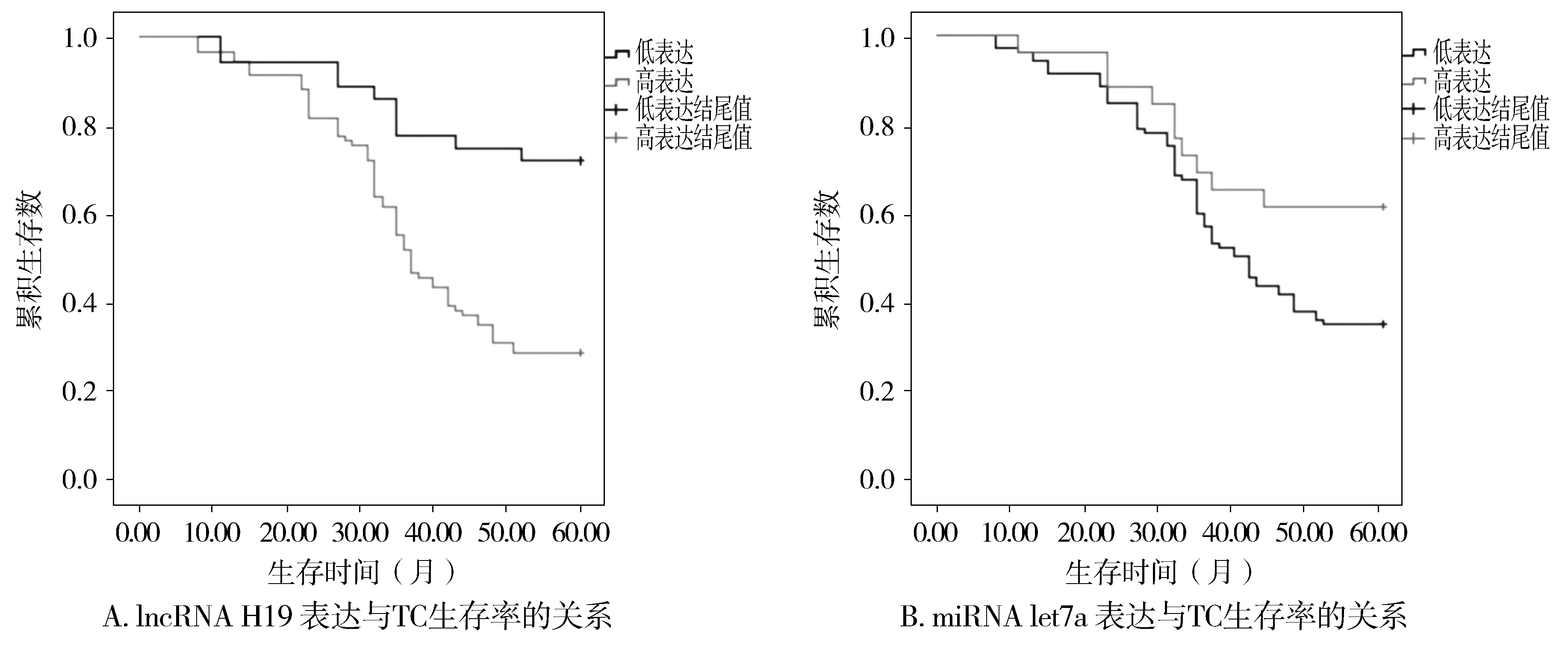
图3 Kaplan-Meier曲线分析lncRNA H19和miRNA let7a表达与TC生存率的关系Figure 3 Kaplan-Meier curve analysis of the relationship between lncRNA H19, miRNA let7a expression and TC survival rate
2.6 单因素分析影响甲状腺癌预后因素
预后相关单因素分析采用Log-rank检验,结果显示肿瘤直径≥1.0 cm,高的TNM分期和有淋巴结转移时,平均生存率降低(P<0.05)。总体生存率(overall survival rate,OS)与性别、年龄、组织病理分型、有无包膜浸润等临床病理特征无明显相关性(P>0.05,见表3)。
表3单因素分析影响甲状腺癌预后因素
Table3UnivariateanalysisofprognosticfactorsforTCpatients

影响因素n总体生存期(月)χ2P 性别02610609 男435019±232 女885060±172 年龄05040478 <45岁585302±178 ≥45岁734840±201 肿瘤直径353250001 <10cm446000±000 ≥10cm874339±192 组织病理分型40280133 乳头状癌785237±169 滤泡状癌294993±308 髓样癌244514±350 包膜浸润00860769 有525056±178 无795038±222 TNM分期55670018 Ⅰ+Ⅱ515430±189 Ⅲ+Ⅳ804624±192 淋巴结转移333860001 有694201±217 无625791±093
2.7 多因素分析影响甲状腺癌预后因素
COX回归模型结果提示,miRNA let7a和lnc RNA H19表达,肿瘤直径,TNM分期和淋巴结转移是影响甲状腺癌预后的独立风险因素(P<0.05)。年龄、性别、组织病理分型、有无包膜浸润与甲状腺癌预后无明显相关性(P>0.05,见表4)。
3 讨论
首先,从分子水平研究控制肿瘤生长、侵袭和转移机制对肿瘤发生和治疗至关重要。H19基因位于人染色体11p15,可转录成大小约2.3 kb的长链非编码RNA,即lncRNA H19参与基因表达的调控过程[9],转录的H19保守印记基因簇也转录编码胰岛素样生长因子2(IGF2),H19-IGF2基因对胚胎发育和生长控制有重要的作用,H19抑制胚胎胎盘生长,在胚胎发育过程中调节印记基因。然而它在肿瘤发生发展中的角色,是致癌基因还是抑癌基因,依赖于肿瘤分型和细胞内成分[10]。有证据显示lncRNA H19在不同恶性肿瘤多种病理状态下呈现高表达[11],其表达上调提示了它可能的致癌属性[12]。比如Wang等[13]发现了lncRNA H19在胆囊癌组织中高表达,并揭示了lncRNA H19表达与肿瘤尺寸及淋巴结转移相关,Liu等[14]证实体外实验中H19能够促进膀胱癌细胞增殖,lncRNA H19在膀胱癌组织中表达高于其旁非肿瘤组织。还有研究证实了lncRNA H19在胃癌组织有高表达率,且与TNM分期和淋巴结转移都是影响胃癌预后的独立危险因素[15]。尽管lncRNA H19已被证实参与多种肿瘤发生[16],但它在甲状腺癌发生发展中所扮演的角色鲜有报道。本研究结果显示lncRNA H19在甲状腺癌组织中表达较高,且高表达者5年生存率降低,提示lncRNA H19在甲状腺癌发生发展中有重要作用,表达水平影响甲状腺癌预后,有可能作为抗肿瘤治疗的潜在新靶点。
表4多因素分析影响甲状腺癌预后因素
Table4MultivariateanalysisofprognosticforTCpatients

影响因素BSEWaldSig.Exp(B)95%CI 年龄-006402850050082209380537-1639 性别-007603070061080409270508-1691 肿瘤直径18590431185710001∗6414 2755-14937 组织病理分型-017201730988032008420601-1181 包膜浸润-012302850188066508840506-1544 TNM分期-0795036747050030∗04510220-0926 淋巴结转移1455038414360001∗42842019-9092 lncRNAH19表达-0818029477620005∗04410248-0785 miRNAlet7a表达-0796039340960043∗04510209-0975
*P<0.05
其次,本研究对组织中miRNA let7a和lncRNA H19水平进行检测,发现lncRNA H19在甲状腺癌组织中升高,而miRNA let7a反而降低,说明两者之间具有一定关联性,lncRNA H19可能对miRNA let7a具有调控作用[17]。已经确定lncRNA不仅能够行使miRNA的功能,对下游基因进行调控,还能够对miRNA产生调控作用[18]。本研究通过进一步与甲状腺癌临床病理特征相关性及预后相关因素进行分析,发现二者均与临床分期相关联,lncRNA H19随肿瘤的进展程度表达随之升高,而miRNA let7a则随之下降。且lncH19表达上调者或者let7a表达下调者,5年生存率减低,说明二者对肿瘤的进展存在一定作用。miRNA let7a被认为与抑癌基因有关,有很多目的基因,比如RAS和HMGA2,它还能通过靶向分子Aurora-B抑制子宫内膜癌细胞生长[19]。目前,研究发现lncRNA H19可以抑制let7a内源性功能,导致高迁移率组AT-hook2的消沉,AT-hook2在胰腺导管腺癌中能够介导上皮细胞-间充质细胞转换过程(epithelial mesenchymal transition,EMT),导致肿瘤转移[20]。本研究结果也显示出lncRNA H19的高表达降低了let7a的抑癌作用,二者呈负向调控,尽管二者具体调控机制尚不清楚,我们可以得出结论,miRNA let7a和lncRNA H19能够进行筛选实验作为良好标志物的候选,对甲状腺癌早期诊断及预后判断有提示功能[21]。而对其基因调控机制的研究有助于分子治疗。
综上所述,结果表明miRNA let7a和lncRNA H19可能在甲状腺癌的发生发展过程中发挥重要作用,是影响甲状腺癌预后的独立危险因素。但由于受样本量限制,其与甲状腺癌患者的临床病理特征的相关性尚不明确,因此,对未来进一步研究的期望,尚需要扩大样本量进一步研究论证,细化肿瘤分期,继续深入讨论关于甲状腺癌不同临床病理特征的相关性的实验。并对miRNA let7a和lncRNA H19调控机制及二者表达情况做更进一步远期生存率的观察,期望发现一种新的甲状腺癌早期诊断和预后判断的方法。
参考文献:
[1] La VC, Malvezzi M, Bosetti C,etal. Thyroid cancer mortality and incidence: a global overview[J]. Int J Cancer, 2015, 136(9):2187-2195.
[2] Deirdre K, Catherine MK. Clinical overview of thyroid cancer and recent advances in treatment[J]. J Oncol Med Pract,2016,1(2):1-6.
[3] Schwaiger M, Scheidhauer K, Bamberg M. Multidisciplinary overview of the diagnosis and treatment of thyroid cancer[J]. Der Onkologe,2015, 21(7):574-576.
[4] Penha RCC, Lima SCS, Pinto LFR,etal. Radiation-induced senescence and thyroid cancer: a barrier or a driving force[J]. PAJAR,2015, 3(1):29-35.
[5] Reddi H, Kumar A, Kulstad R. Anaplastic thyroid cancer — an overview of genetic variations and treatment modalities[J]. Adv Genet, 2015, 5:43-52.
[6] Liz J, Esteller M. LncRNAs and microRNAs with a role in can-cer development[J]. Biochimica Et Biophysica Acta,2016, 1859(1):169-177.
[7] Xin Y, Zheng L. The role of microRNAs expression in laryngeal cancer[J]. Oncotarget, 2015, 6(27):23297-23305.
[8] Kim M, Kim WG, Oh HS,etal. Comparison of the seventh and eighth editions of the American Joint Committee on Cancer/Union for international cancer control Tumor-Node-Metastasis Staging System for differentiated thyroid cancer[J]. Thyroid, 2017, 27(9):1149-1155.
[9] Matouk IJ, Halle D, Gilon M,etal. The non-coding RNAs of the H19-IGF2 imprinted loci: a focus on biological roles and therapeutic potential in Lung Cancer[J]. J Transl Med,2015, 13(1):113-125.
[10] Looijenga LH, Verkerk AJ, De G N,etal. H19 in normal development and neoplasia[J]. Mol Reprod Dev,2015,46(3):419-439.
[11] Raveh E, Matouk IJ, Gilon M,etal. The H19 long non-coding RNA in cancer initiation, progression and metastasis-a proposed unifying theory[J]. Mol Cancer,2015, 14(1):184-198.
[12] 赵艳华,张新丽,张文玲.长链非编码RNA在肺癌中的功能及机制研究[J].中国肿瘤临床,2013,40(23):1473-1476.
[13] Wang SH, Wu XC, Zhang MD,etal. Long noncoding RNA H19 contributes to gallbladder cancer cell proliferation by modulated miR-194-5p targeting AKT2[J].Tumor Biol,2016, 37(7):1-10.
[14] Liu C, Chen Z, Fang J,etal. H19-derived miR-675 contributes to bladder cancer cell proliferation by regulating p53 activation[J]. Tumor Biol,2016, 37(1):263-270.
[15] Zhou X, Yin C, Dang Y,etal. Identification of the long non-coding RNA H19 in plasma as a novel biomarker for diagnosis of gastric cancer[J]. Sci Rep, 2015, 5(1):1-10.
[16] 魏晨晨,王朝霞.长链非编码RNA H19在肿瘤研究中的进展[J].临床肿瘤学杂志,2015,20(11):1041-1044.
[17] 蔚洪恩,王春芳,张传森.内含子microRNA和基因调控[J].山西医科大学学报,2010,41(8):745-747.
[18] Cai X, Cullen BR. The imprinted H19 noncoding RNA is a primary microRNA precursor[J]. RNA, 2007, 13(3):1-4.
[19] Mross K,Richly H,Frost A,etal.A phase I study of BI 811283, an Aurora B kinase inhibitor, in patients with advanced solid tumors[J]. Cancer Chemoth Pharm,2016,(2):1-13.
[20] Ma C, Nong K, Zhu H,etal. H19 promotes pancreatic cancer metastasis by derepressing let-7’s suppression on its target HMGA2-mediated EMT[J]. Tumour Biol, 2014, 35(9):9163-9169.
[21] 戴维德,马娜,王川予,等.超声引导细针穿刺标本BRAF V600E及CyclinD1联合检测对于甲状腺癌患者颈部淋巴结转移的预测价值[J].山西医科大学学报,2017,48(6):589-592.
