microPET大鼠脑模板研究
2018-05-08,,
, ,
(浙江工业大学 理学院,浙江 杭州 310023)
脑功能成像是指利用各种成像技术对大脑功能活动进行显示的过程,常用的技术有脑电图(Electroencephalography, EEG)、脑磁图(Megnetoencephalography, MEG)、功能磁共振成像(Functional magnetic resonance imaging, fMRI)和PET.从20世纪80年代开始,PET作为人体功能显像的医学影像技术越来越受到研究人员的关注[1].以氟代脱氧葡萄糖([18F] fluoro-2-deoxy-glucose,18F-FDG)为示踪剂的PET成像技术已经被广泛的应用于人类大脑功能研究[1-4].与此同时,啮齿类动物作为各种人类疾病和遗传特征的模型被越来越多地用于神经影像学研究.脑疾病的啮齿类动物模型主要包括神经退行性疾病、中风以及一些精神类疾病.微型正电子断层扫描技术(microPET)成像可以实现纵向随访,这在调查神经药物干预或表征疾病进程时非常重要[5-11].
在功能神经影像分析中,为了消除体素分析的个体差异,将对不同个体或者同一个体不同时刻的数据进行空间归一化,把不同次扫描的数据投射到一个共同的图谱空间[12-14].由于MRI和FDG-PET图像之间的空间分辨率差异较大,将FDG-PET数据直接配准到MRI模板的失配程度是非常高的.因此,已经建立的MRI模板[15-16]不能直接用于大鼠脑的FDG-PET数据研究.Casteels等[17]首先在Paxinos &Watson空间[16]中构建了大鼠脑的FDG-PET模板,用于空间归一化.他们的模板的引入加速了大量的FDG-PET研究[18-20].该方法基于SPM12中互信息最大化算法中的线性变换,通过MRI模板将PET功能模板标准化到Paxinos空间[21-22].但是,由于模板图像和图谱是由不同成像模式的图像构建的,仅有线性变换不能准确地将模板标准化到图谱空间.另外,Coello等[18]为了将模板和图谱配准中线性和非线性转换的方法结合起来,先将MRI图像分割成白质(White matter, WM)图像和灰质(Gray matter, GM)图像,然后进行GM和WM图像的加权求和,从MRI图像构建合成的FDG-PET(Synthetic PET, synPET)图像.最后,将个体的FDG-PET图像标准化到synPET模板上.笔者分别将大鼠个体FDG-PET图像直接配准到MRI-PET图像和配准到synPET图像两种方法来生成大鼠大脑的FDG-PET模板,以实现对个体FDG-PET图像的空间归一化,并比较以两种模板为参照进行配准时的配准误差,来制定合理的大鼠脑PET数据的处理流程.
1 实验和方法
1.1 实验平台与实验对象
实验中以20只成年雌性Sprague-Dawley大鼠为对象,体重在180~280 g.所有大鼠均饲养于可自由获得食物和水的动物房中,在注射示踪剂的前夜禁食6 h以上.这项研究由浙江大学医学院动物研究委员会批准,实验过程严格按照美国国立卫生研究院(NIH)发表的实验室动物护理和使用准则进行.实验中的每只大鼠都将在浙江大学附属第二医院PET中心的microPET R4扫描仪(CTI concorde microsystems, LLC)上进行三维的FDG-PET成像.microPET扫描仪由32 层探测器环组成,动物入口孔径为120 mm,横向视野为100 mm,轴向深度为78 mm.视野中心的轴向空间分辨率为1.88 mm,横向空间分辨率为1.9 mm.
1.2 PET扫描与图像采集
在扫描前,每只大鼠将进行称重,然后按体重注射400 mg/kg的水合氯醛进行麻醉.麻醉后的大鼠经尾静脉注射0.5~1 mCi18F-FDG后在饲养笼中安静休息30 min用于葡萄糖的吸收,然后将大鼠固定于一硬板上,放置于microPET扫描仪的扫描架上,调整其位置使大鼠的脑部位于microPET扫描仪视野的中心,进行15 min的microPET成像.经过microPET扫描后采集到的数据采用最大后验(Maximum a posteriori, MAP)算法[1]重建三维microPET图像.
1.3 制作模板
首先采用图像格式转换软件ImageJ (Wayne rasband, national institute of mental health, USA)将重建后的microPET脑功能图像转换为Analyse格式,再使用MRIcro (http://www.mricro.com)软件进行图像坐标的修正,最后使用SPM12在matlab平台上进行预处理[19].
由于SPM软件的默认参数是基于人脑图像设置的,而大鼠大脑的尺寸远小于人脑的尺寸见图1(a)(图中左中右图分别为冠状位、矢状位和横断位),为了使大鼠大脑体素尺寸和人脑相适应,预处理时先调整其大小为[1 1 1.6],再将其放大9倍得到图1(b).

图1 大鼠大脑microPET图像的预处理对比Fig.1 Rat brain PET images before and after preprocess
1.3.1 制作大鼠MR-PET脑模板
大鼠MR-PET脑模板制作过程如图2所示.第1步,从原始数据中取出一个被试个体图像,作为初始的参考图像见图1(b),图中大鼠大脑的冠状位、矢状位和横断位位置适中,大脑图像完整.第2步,在SPM平台上,使用平方和最小化算法和12参数仿射变换将其余19个大鼠大脑图像标准化到该参考图像.第3步,对标准化后的19幅图像以及参考图像取平均值,得到一幅平均值图像,该平均值图像将作为新的参考图像.第4步,计算新的参考图像与原始参考图像之间体素的残差平方根.当残差平方根和小于5%时,该参考图像进入下一步的处理[16,23]反之,则重复第2~4步,直到残差平方和小于5%.最后,采用互信息最大化算法并将该参考图像配准到MRI标准模板[15],并对所得模板进行高斯平滑处理[24-25],提高信噪比,所得图像称之为MR-PET模板[18].

图2 MR-PET标准模板建立流程图Fig.2 The establishment of MR-PET template
1.3.2 制作大鼠SynPET脑模板
我们将包含了小脑和嗅球的大鼠大脑MR模板[15](80×108×63)作为数据材料,并选取工具FMRIB软件库(FSL)[26]进行图像的分割[27].首先,使用脑提取工具[27-28](BET,阈值为0.65,(图3步骤1))提取去颅的大鼠大脑,然后,对去颅的大鼠大脑使用FAST分割工具来进行两级分割[16](图3步骤2),从FSL中得到其灰质(GM)图像和白质(WM)图像.最佳分割参数(MRF beta=0.75,迭代去偏置场为5,偏置场平滑(FWHM)为25 mm),一般认为GM对FDG的摄取WM中对FDG的摄取高4倍,通过对GM和WM映射按4∶1加权来合成synPET图像[16,18](图3步骤3),最后对图像进行平滑处理[29](FWTH=8 mm)以提高信噪比,最终可得synPET模板(图3步骤4)[15,18].

图3 synPET模板建立流程图Fig.3 The establishment of synPET template
1.4 配准误差
在实验中,为了定量地评估大鼠个体映射到PET模板的精确度,取20组预处理后的PET图像进行40次随机错位:10次平移,10次旋转,10次线性拉伸,以及10次前3个参数的组合变换[16].错位参数为均匀分布,在正交三维坐标中分别为:-5~5 mm的平移,-20°~20°的旋转变换,-10%~10%的线性拉伸.通过评估标准化到MR-PET模板和synPET模板的配准精度来选定更加适合的模板.使用SPM12中的12参数仿射变换将来自大鼠PET研究的20个解剖学标准化图像重新配准到MR-PET模板和synPET模板[1].相对于原始图像中的每个体素(x,y,z)的位置,计算配准后的图像体素位置(x+Δx,y+Δy,z+Δz).将所有大鼠大脑图像体素位置变化求取平均值,也就是距离(Δx2+Δy2+Δz2)1/2的均值,我们将之定义为图像的配准精度[17].
2 实验结果及分析
2.1 模板建立
2.1.1 MR-PET模板
按照上文所述的MR-PET模板建立方法,以图4(a)为PET初始参考图像可得到的MR-PET模板如图4(b)所示(残差小于5%).

图4 预处理后的PET数据以及MR-PET模板Fig.4 PET data after preprocess &MR-PET template
2.1.2 synPET模板
使用synPET模板建立方法,利用BET提取MR模板中的大鼠大脑,如图5(a)所示,再用FAST对大鼠大脑进行两级分割,可得到图6(a)的灰质图像GM和图6(b)的白质图像WM.此时能够清楚地分辨大鼠大脑内的灰质和白质.将WM图像和GM图像按4∶1加权合成,可得到synPET图像,对所得的synPET图像进行高斯平滑,可得图5(b)的synPET模板.

图5 去颅的MR模板以及synPET模板Fig.5 MR template without skull & synPET template
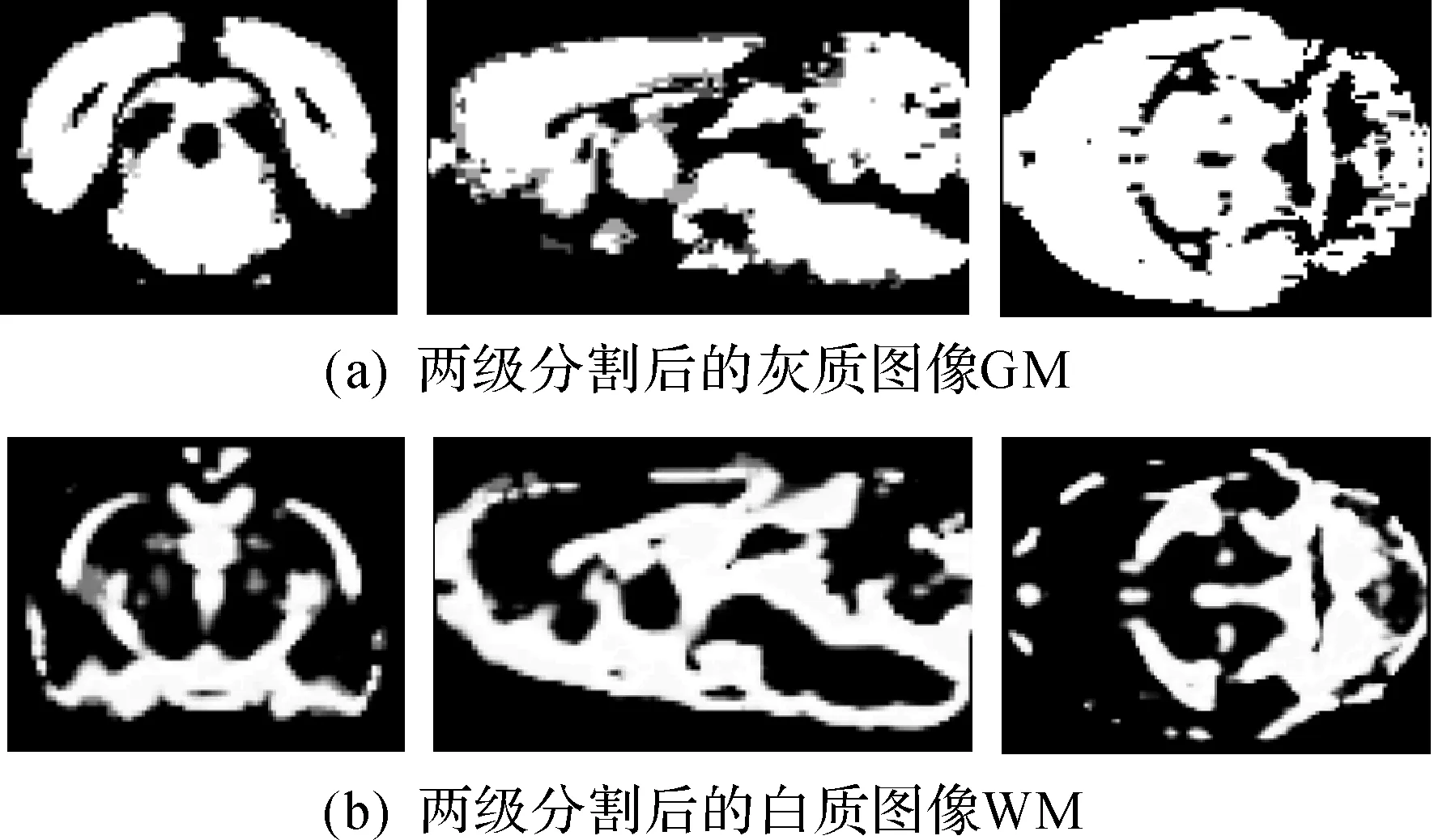
图6 两级分割后的灰质图像GM以及白质图像WMFig.6 GM and WM after 2-class segment
2.2 模板比较分析
为了评估MR-PET模板和synPET模板在大鼠大脑数据分析应用上的可行性,将预处理好的原始功能PET图像分别归一化到MR-PET模板和synPET模板上,比较两者之间的配准误差,通过定义的配准误差可以得出表1的结果.在表1中列出了分别使用MR-PET模板和synPET模板时获得的平均配准误差.从表1中可以看出:使用MR-PET模板进行标准化时的平均误差为1.818 mm,误差范围为1.093~2.752 mm;而使用synPET模板进行标准化时的平均误差为2.009 mm,误差范围在1.615~2.445 mm.利用2种方法制作的模板进行大鼠大脑图像的标准化时,基于MR大鼠脑模板制作的MR-PET模板的配准误差要小于synPET模板.
表1配准到MR-PET模板和synPET模板的配准精度

Table 1 Registration accuracy for MR-PET template and synPET template mm
3 结 论
在脑功能图像分析中,为了进行基于像素的统计分析,需要先将实验数据配准到一个标准化的模板.对于大鼠脑结构和脑功能实验数据的处理,基于Paxinos坐标空间大鼠脑模板的建立,使得大鼠脑图像能够进行自动化的解剖,方便VOI(Volume of interest)区域的定义及标准化的分析.无论是人类大脑图像还是大鼠大脑图像都已经具有较为成熟稳定的MR图像标准化模板,可以在很大程度上减小对MR图像进行统计分析时产生的误差.对于大鼠脑功能PET图像,还没有比较成熟的PET标准化模板,导致肉眼观察以及定量分析中存在定位困难,难以进行大数据量的分析.以大鼠大脑的MR模板为基础,分别建立了大鼠的MR-PET脑模板和synPET脑模板,并比较了以此两种模板为标准进行配准时的配准精度.结果表明基于MR大鼠脑模板制作的MR-PET模板具有更高的配准精度.大鼠PET脑模板的建立将为不同个体或者同一个体重复测量数据的处理提供便利.
参考文献:
[1] RAICHLE M E. A brief history of human brain mapping[J]. Trends in neurosciences,2009,32(2):118-126.
[2] JAGUST W J, BANDY D, CHEN K, et al. The alzheimer’s disease neuroimaging initiative positron emission tomography core[J]. Alzheimer’s & dementia,2010,6(3):221-229.
[3] HUANG Y C, HSU C C, HUANG P, et al. The changes in brain metabolism in people with activated brown adipose tissue: a PET study[J]. NeuroImage,2011,54(1):142-147.
[4] ZIMMER L, LUXEN A. PET radiotracers for molecular imaging in the brain: past, present and future[J]. NeuroImage,2012,61(2):363-370.
[5] MOONEN C T, VAN ZIJL P C, FRANK J A, et al. Functional magnetic resonance imaging in medicine and physiology[J]. Science,1990,250(4977):53-61.
[6] LIU Z, KE L, LIU H, et al. Changes in topological organization of functional PET brain network with normal aging[J]. Plos one,2014,9(2):e88690.
[7] KJONIGSEN L J, LILLEHAUG S, BJAALIE J G, et al. Waxholm space atlas of the rat brain hippocampal region:three-dimensional delineations based on magnetic resonance and diffusion tensor imaging[J]. Neuroimage,2015,108:441-449.
[8] LIU H, SHEN X, TANG H, et al. Using microPET imaging in quantitative verification of the acupuncture effect in ischemia stroke treatment[J]. Scientific reports,2013,3(3):1070.
[9] BUITER H J, VAN V F H, LEYSEN J E, et al. Reproducible analysis of rat brain PET studies using an additional [(18)F]NaF scan and an MR-based ROI template[J]. International journal of molecular imaging,2012,2012(5):580717.
[10] 龙胜春,尧丽君.行程长度纹理特征应用于肠癌病理图片识别[J].浙江工业大学学报,2015,43(1):110-114.
[11] 凌华强,龙胜春,项鹏远.主动形体模型法在肝脏CT图像分割中的应用[J].浙江工业大学学报,2012,40(4):450-453.
[12] KORNBLUM H I, ARAUJO D M , ANNALA A J, et al.Invivoimaging of neuronal activation and plasticity in the rat brain by high resolution positron emission tomography (microPET)[J]. Nature biotechnology,2000,18(6):655-660.
[13] FOX P T, PERLMUTTER J S, RAICHLE M E. A stereotactic method of anatomical localization for positron emission tomography[J]. Journal of computer assisted tomography,1985,9(9):141-153.
[14] SCHWARZ A J, DANCKAERT A, REESE T, et al. A stereotaxic MRI template set for the rat brain with tissue class distribution maps and co-registered anatomical atlas: application to pharmacological MRI[J]. Neuroimage,2006,32(2):538-550.
[15] SCHWEINHARDT P, FRANSSON P, OLSON L, et al. A template for spatial normalisation of MR images of the rat brain[J]. Journal of neuroscience methods,2003,129(2):105-113.
[16] NIE B, CHEN K, ZHAO S, et al. A rat brain MRI template with digital stereotaxic atlas of fine anatomical delineations in paxinos space and its automated application in voxel-wise analysis[J]. Human brain mapping,2013,34(6):1306-1318.
[17] CASTEELS C, VERMAELEN P, NUYTS J, et al. Construction and evaluation of multitracer small-animal PET probabilistic
atlases for voxel-based functional mapping of the rat brain[J]. Journal of nuclear medicine,2006,47(11):1858-1866.
[18] COELLO C, HJORNEVIK T, COURIVAUD F, et al. Anatomical standardization of small animal brain FDG-PET images using synthetic functional template: experimental comparison with anatomical template[J]. Journal of neuroscience methods,2011,199(1):166-172.
[19] KIEBEL S J, ASHBURNER J, POLINE J B, et al. MRI and PET coregistration-a cross validation of statistical parametric mapping and automated image registration[J]. Neuroimage,1997,5(1):271-279.
[20] NIE B, LIU H, CHEN K, et al. A statistical parametric mapping toolbox used for voxel-wise analysis of FDG-PET images of rat brain[J]. Plos one,2014,9(9):e108295.
[21] PAXINOS G, WATSON C. The rat brain in stereotaxic coordinates[M]. 4th ed. San Diego: Academic Press,1998.
[22] PAXINOS G, FRANKLIN K B J. The mouse brain in stereotaxic coordinates[M]. San Diego:Elsevier Academic Press,2001.
[23] 熊磊,李德民,单保慈,等.CFT-PET脑功能成像标准模板的制作与验证[J].中国医学影像技术,2009,25(8):1477-1480.
[24] 金燕,王卫静.基于稀疏优化字典的图像去噪算法[J].浙江工业大学学报,2017,45(3):320-324.
[25] FRISTON K J, ASHBURNER J, FRITH C D, et al. Spatial registration and normalization of images[J].Human brain mapp,1995,2(3):165-189.
[26] SMITH S M, JENKINSON M, WOOLRICH M W, et al. Advances in functional and structural MR image analysis and implementation as FSL[J]. Neuroimage,2004,23:S208-S219.
[27] GENOVESE C R, LAZAR N A, NICHOLS T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate[J]. Neuroimage,2002,15(4):870-878.
[28] ALANSARY A, ISMAIL M, SOLIMAN A, et al. Infant brain extraction in T1-weighted MR images using BET and refinement using LCDG and MGRF models[J]. IEEE journal of biomedical & health informatics,2015,20(3):925-935.
[29] 方赵林,彭洁,葛春霞,等.基于改进加权算法的实时图像数据融合研究[J].浙江工业大学学报,2017,45(3):325-329.
