Lactobacillus plantarum-12胞外多糖抑制志贺氏菌生物膜形成的研究
2018-05-07宋莹龙梁雪宋杏牟光庆妥彦峰姜淑娟钱方冯璐
宋莹龙,梁雪,宋杏,牟光庆,妥彦峰,姜淑娟,钱方,冯璐
(大连工业大学食品学院,辽宁大连116034)
细菌生物膜(bacteria biofilm)是指细菌为了适应生存环境,黏附于有生命或无生命物体表面后,通过其产生的胞外多聚物基质将自身包裹起来的有组织的细菌群体[1]。在自然界、某些工业生产环境(如发酵工业和废水处理)以及人和动物体内外,绝大多数细菌是附着在有生命或无生命物体的表面,以生物膜方式生长,而不是以浮游(planktonic)方式生长[2]。与浮游细菌相比,在生物膜内的细菌对传统抗生素及宿主免疫应答的抵抗能力最高可提升至1 000倍[3]。生物膜的形成对于食品加工而言有利也有弊,如在生产食醋的过程当中,在食醋表面会由醋酸菌形成一层生物膜[4],其对发酵用的醋酸菌有保护作用,同时又能阻止外界微生物的污染,是造醋成功的标志[5]。同样,在食品加工领域食源性致病菌的污染屡见不鲜,细菌黏附于食品,食品加工接触面以及食品设备表面[6],浮游细菌一旦形成生物膜后,将会变得难以被清除。因此,抑制致病菌生物膜的形成或者清除已形成的生物膜就变得极其重要。
Shigella(志贺氏菌)是常见的食源性致病菌[7],导致志贺氏菌感染最主要的食品包括畜禽肉、果汁和乳制品等等。其能够引发细菌性痢疾,造成水样性腹泻等症状[8]。近年来,在临床上使用大量的抗生素进行治疗使得Shigella产生了许多耐药性菌株。Shigella形成生物膜后对物理、化学等清洗方式有很强的抵抗能力,对抗生素同样有着很强的抵抗作用,包裹在Shigella周围的胞外多聚物基质使得细菌本身被很好的保护[9]。因此其易成为在食品生产过程中的持续污染源,造成交叉污染以及食品加工后置处理的污染[10]。
Valle等[11]发现Escherichia coli CFT073分泌的K2血清型的Ⅱ型荚膜多糖能抑制很多致病菌(E.coli,Klebsiella pneumonia,Pseudomonas aeruginosa,Staphylococcus aureus,Staphylococcus epidermidis,Enterococcus faecalis)生物膜的形成[12]。Jiang 等[3]报道了其从Vibrio sp QY101中分离出的多糖A101对革兰氏阳性及阴性细菌具有较广的生物膜抑制能力,其中多糖对Pseudomonas aeruginosa已形成的生物膜具有清除作用,同时多糖还能够增强抗生素的作用。Parrilli等[13]报道了Pseudoalteromonas haloplanktis TAC125的上清液存在抑制staphylococcus epidermidis生物膜的活性,并发现发挥活性作用的是TAC125的多糖成分。Alves等报道了一株[14]L.plantarum TCUESC02发酵上清液抑制了S.aureus生物膜的形成。Wang等[15]报道了L.plantarum YW32 抑制了 E.coli O157,S.flexneri CMCC,S.aureus AC1,Salmonella typhimurium S50333等致病菌的生物膜形成。
本论文以大连工业大学大连市益生菌功能特性研究重点实验室筛选保存的L.plantarum-12为研究对象,旨在获得一种能够抑制常见食源性致病菌生物膜形成的抑制剂或清除生物膜的清除剂,主要研究了L.plantarum-12对6常种见食源性致病菌生物膜形成的抑制作用及其可能的作用机制。
1 材料与方法
1.1 材料与试剂
Lactobacillusplantarum-12(分离于多宝鱼肠道)由大连工业大学大连市益生菌功能特性研究重点实验室保藏,培养于MRS液体培养基,培养条件37℃,18 h。
Shigella CMCC51574,Escherichia coli,ATCC25922,Staphyloccocus aureus ATCC29213,Listeria monocytogenes,salmonella,Vibrio Parahaemolyticus 由大连工业大学大连市益生菌功能特性研究重点实验室保藏,培养于LB液体培养基,培养条件37℃,24 h。
MRS肉汤培养基、LB肉汤培养基:北京奥博星生物技术有限责任公司;三氯乙酸(Trichloroacetic acid,TCA):上海沪试实验室器材股份有限公司;无水乙醇、甲醇、冰乙酸、二甲苯、氯化锂:天津市大茂化学试剂厂;透析袋(截留分子量8 000 Da~14 000 Da)、左氧氟沙星:北京索莱宝科技有限公司;环丙沙星:上海阿拉丁生化科技股份有限公司;0.22 μm滤膜:上海鲁汶生物科技有限公司;96孔板:苏州康宁杰瑞生物科技有限公司;PBS稀释液:北京陆桥技术股份有限公司;结晶紫:沈阳试三生化科技开发有限公司。
1.2 仪器与设备
冷冻离心机(Centrifuge 5840R):德国艾本德股份公司;酶标仪(Multiskan GO 1510):芬兰赛默飞世尔科技公司;光学显微镜(ECLIPSE Ci-L):日本尼康公司;微量离心机(Micro 17):德国赛默飞世尔科技公司;超声清洗机(KQ5200DE):昆山市超声仪器有限公司;生化培养箱(SHP-150):上海森信实验仪器有限公司。
1.3 试验方法
1.3.1 L.plantarum-12胞外多糖(Exopolysaccharides,EPS)提取
活化后的L.plantarum-12(1%)接种于新鲜MRS液体培养基37℃培养18 h。培养完成后取发酵液离心(8 000 r/min,10 min,4℃),除菌体保留上清液;上清液旋蒸浓缩至原体积的1/5;配置80%TCA加入上清液,使上清液中TCA终浓度为4%,室温下摇匀30 min,沉淀蛋白;离心(8 000 r/min,15 min,4℃),除蛋白保留上清液;上清液加入2倍体积冷无水乙醇,4℃放置12 h,沉淀多糖;离心(8 000 r/min,15 min,4 ℃),弃上清液保留多糖沉淀,并用适量去离子水溶解;4℃超纯水中透析48 h,每8h换一次水。冻干,得EPS样品。采用苯酚硫酸法和考马斯亮兰法分别测定EPS中的多糖含量和蛋白含量。
1.3.2 EPS对致病菌生物膜的影响
1.3.2.1 EPS对致病菌生物膜形成的抑制作用
采用结晶紫染色法[16]研究L.plantarum-12 EPS对致病菌生物膜形成的影响。L.plantarum-12 EPS溶于去离子水,过 0.22 μm 滤膜并配置成 0.2、0.5、1.0、2.0、4.0 mg/mL不同浓度EPS溶液。致病菌2%接种于LB培养基37℃培养24 h,取1%加入新鲜LB培养基进行稀释,取95 μL稀释菌液加入96孔板,将5 μL不同浓度EPS溶液加入菌液(对照孔加入95 μL菌液与5 μL LB培养基),37℃培养24 h后进行检测。培养结束后,吸去每孔菌液,并用生理盐水洗涤3次以洗去未黏附细菌,然后加入0.2 mL 95%甲醇固定菌体15 min,将平板倒空晾干,加入0.2 mL 2%结晶紫染色5 min,蒸馏水洗去多余染料,着色于菌体的染料用0.16 mL 33%冰醋酸重新溶解30 min,取125 μL加入另一干净的96孔板中,于590 nm处测OD。
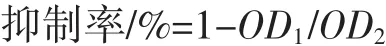
式中:OD1为EPS处理组的吸光度值;OD2为对照组的吸光度值。
1.3.2.2 显微观察
采用Sayem等[17]报道的方法用显微镜观察生物膜形成。S.flexneri以1%接菌量接种于10 mL LB液体培养基中,取9.5 mL菌悬液倒入放有1×1 cm2盖玻片的培养皿中,加入0.5 mL梯度浓度的EPS溶液,37℃培养24 h。然后取盖玻片,用生理盐水轻轻漂洗,以洗去未粘附菌体,接着用2%结晶紫染色5 min,用清水将多余的结晶紫洗净,将盖玻片置于10×40倍显微镜下观察。
1.3.2.3 EPS对S.flexneri生物膜的清除作用
S.flexneri以2%接种于LB培养基37℃培养24 h,取1%接种于LB培养基,取100 μL菌液加入96孔板,37℃培养24 h,生理盐水清洗每孔去除未粘附菌体,加入95 μL LB培养基及5 μL EPS溶液(梯度浓度:0.2、0.5、1.0、2.0、4.0 mg/mL),37 ℃培养 24 h 后使用结晶紫染色法检测[16]。
1.3.3 致病菌药敏性试验
采用Jiang等[3]报道的方法测定喹诺酮类抗生素环丙沙星与左氧氟沙星对S.flexneri的最低抑菌浓度(Minimum Inhibitory Concentration,MIC),最小杀菌浓度(Minimum Bactericidal Concentration,MBC)及最低生物膜清除浓度(Minimal Biofilm Elimination Concentra tion,MBEC)。MIC及MBC测定,配制含有抗生素的LB培养基,以2倍梯度稀释,使抗生素终浓度从1 024 μg/mL至0.031 25 μg/mL,吸取各梯度培养基100 μL加入96孔板,每组3平行,以空LB培养基为空白对照,向每孔培养基中加入菌液使S.flexneri终浓度达到105cfu/mL,37℃培养24 h后,于酶标仪测定OD600,确定该抗生素对S.flexneri的最低抑菌浓度MIC,蘸取将未见生长孔内的培养基,划线培养后,确定该抗生素对S.flexneri的最低杀菌浓度MBC。
MBEC测定,S.flexneri培养 24 h后调浓度至107cfu/mL,将稀释后的菌液加入到小孔中,每孔150μL,设空白对照;37℃培养24 h后吸去小孔中培养基,加入200 μL 0.9%生理盐水,摇晃1 min,以洗去未成膜菌体,吸去每孔液体,然后加入含有梯度浓度抗生素的培养基,37℃培养24 h;培养完成后,吸去培养基,加入200 μL 0.9%生理盐水,摇晃1 min,洗去未成膜菌体,吸去每孔液体,加入新鲜LB培养基,每孔0.2 mL,高强度超声5 min。37℃培养24 h使未死的S.flexneri生长至混浊,测定吸光值来测MBEC(OD600 nm<0.1)。
1.3.4 EPS对致病菌菌体表面性质的影响
1.3.4.1 致病菌菌体疏水性试验
采用Collado等[18]报道的方法测定6种常见食源性致病菌菌体疏水性。以2%接菌量接种于5 mL LB液体培养基中,37℃培养24 h。培养完成后,将菌悬液离心(8 000 r/min,10 min,4℃),弃去上清液,保留菌体,加入PBS使菌体重新悬浮,调整菌悬液OD600至0.2~0.3(OD1)。取2 mL菌悬液,然后加入同体积的二甲苯或者加入同体积二甲苯及100 μL 1 mg/mL EPS溶液,震荡30s后室温下静置1h分层,吸取水相200μL加入96孔板中测定OD600(OD2)。疏水性/%=(OD1-OD2)/OD1×100
1.3.4.2 EPS对S.flexneri自聚性的影响
采用Collado等[18]报道的方法测定S.flexneri菌体自聚性,1%过夜培养的S.flexneri接种到5 mL含有梯度浓度 EPS(0.5、1、2、4 mg/mL)的 LB 培养基,对照组LB培养基不含EPS,37℃培养24 h。从对照组和试验组菌液的上半部分吸出0.2 mL加至96孔板并测定OD600(作为涡旋前吸光度A0)。然后漩涡震荡使菌液重新悬浮均匀,吸出0.2 mL加至96孔板测定OD600(作为涡旋后的吸光度At),计算自聚性公式:
自聚性/%=(1-A0/At)×100
1.3.5 EPS对S.flexneri胞外多聚物基质的影响
采用Guo等[20]报道的方法提取胞外多聚物,S.flexneri以1%接种于含有梯度浓度EPS的LB培养基,37℃培养24 h。离心(10 000 r/min,20 min,4℃)弃去上清液,用PBS洗菌体3次,加入5 mL 5 mol/L的LiCl溶液,37℃孵育1 h,离心得到上清液为胞外多聚物提取液。采用苯酚硫酸法与考马斯亮蓝法分别测定多糖与蛋白质含量。
采用Kaplan[21]等报道的方法提取eDNA,S.flexneri以1%接种于含有梯度浓度EPS的LB培养基,37℃培养 24 h。离心(10 000 r/min,20 min,4℃)弃去上清液,加入1 mL Tris-EDTA缓冲液(10 mmol/L Tris,1 mmol/L EDTA,pH=8),摇匀后将其转入2 mL微量离心管中,微量离心机13 000 r/min离心30 s,弃去上清液,再加入500 μL TE缓冲液,离心后取上清液为eDNA提取液。于波长260 nm下测定样品溶液OD值。
1.3.6 数据分析
数据采用SPSS 20.0软件进行统计,差异显著性检验采用独立样本t检验和单因素方差分析(ANOVE,LSD)。所有数据均表示为平均值±标准误差,p<0.05表示差异显著。
2 结果与分析
2.1 胞外多糖对致病菌生物膜的影响
2.1.1 胞外多糖对致病菌生物膜形成的抑制作用
以L.plantarum-12为目标菌株,研究其EPS抑制不同常见食源性致病菌生物膜形成的能力。结果如表1所示。
L.plantarum-12 EPS对6种致病菌生物膜的形成均有不同程度的抑制作用。当EPS浓度为1.0 mg/mL时,EPS对E.coli,S.aureus,生物膜抑制率达到最大值(p<0.05)分别为 46.80%,34.74%。在 EPS浓度为2.0 mg/mL 时,S.flexneri,Salmonella,L.monocytogenes生物膜抑制率达到最大值分别为53.77%,44.78%及45.48%。EPS对V.Parahaemolyticus生物膜抑制率随着多糖浓度增大而增大,在多糖浓度为4.0 mg/mL时,抑制率达到39.09%。综合比较,L.plantarum-12 EPS对S.flexneri生物膜形成的抑制效果较好,在EPS浓度为1.0及2.0 mg/mL时达到了50%以上的抑制率,而EPS对其他病原菌生物膜的最大抑制率均不足50%。
目前,多糖类物质已经被报道为一种能够抑制病原菌生物膜形成的天然产物[3]。在微生物生物膜形成的 4个阶段(起始黏附,发展,成熟,放散)中[23],L.plantarum-12 EPS作为生物大分子,其进入致病菌菌体内部相对困难,因此推测其对于致病菌生物膜形成的抑制作用主要是因为EPS对于菌体表面自身多糖结合位点起到了封闭或竞争作用[24],阻碍了细菌菌体起始黏附以及菌体之间的聚集。接下来选择了抑制效果较好的S.flexneri作为受试致病菌进行相关试验。
在10×40倍显微镜下观察了不同浓度L.plantarum-12 EPS的影响下,S.flexneri生物膜的形成情况,结果见图1。
在未加入多糖的对照组中,S.flexneri呈团簇状聚集在一起,多而密集,随着EPS浓度的增加,黏附在盖玻片表面的菌体量有明显的减少,不再以大量菌体连接在一起形成的菌簇呈现,而多以单个菌体的形式黏附于盖玻片表面。
2.1.2 EPS对S.flexneri生物膜的清除作用
S.flexneri生物膜形成之后,加入不同浓度的L.plantarum-12 EPS溶液再进行培养,这时S.flexneri生物膜的形成过程已经进入了成熟及放散阶段。多糖对生物膜清除的效果如图2所示。
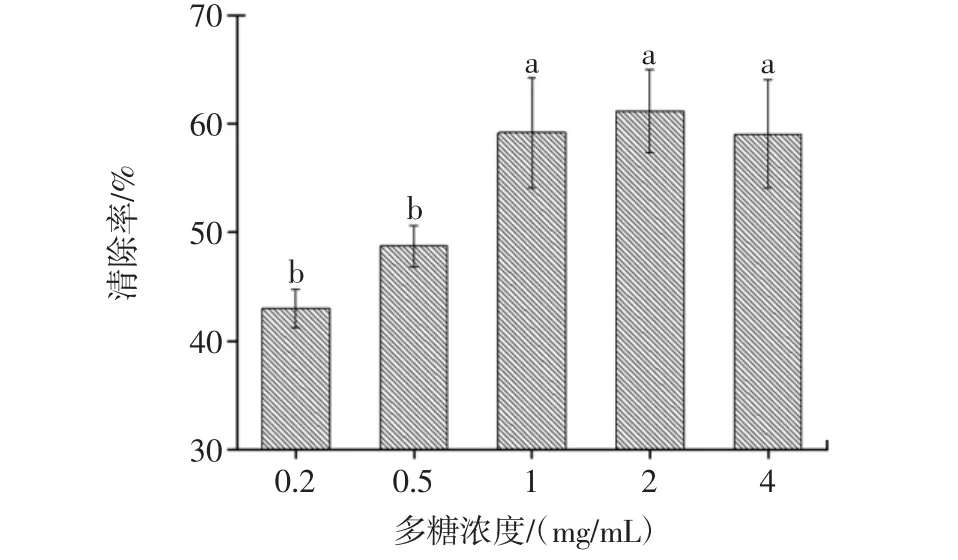
图2 L.plantarum-12 EPS清除S.flexneri生物膜的能力Fig.2 Different concentrations of EPS eliminated biofilm of S.flexneri
与未加入EPS的对照组相比,加入EPS进行培养的孔内生物膜的量有明显降低,并且随着EPS浓度的提高,生物膜的剩余量在逐渐减少,清除率逐渐增大,最高可达61.2%。推测其因为S.flexneri形成生物膜所必需的结合位点被L.plantarum-12 EPS取代结合,导至S.flexneri无法通过自身所产的胞外多糖紧密连接在一起[24];生物膜在成熟后,有些细菌菌体会自行或者在外界作用干扰的情况下脱离生物膜,也就是生物膜的放散阶段[25],EPS可能在此阶段同样发挥着作用,通过与细菌表面受体相结合,从而使菌体大量地从已形成的生物膜中脱离再次成为浮游菌体。
2.2 EPS对致病菌药敏性的影响
为了验证EPS对S.flexneri生物膜的抗生素耐受性是否有影响。测定了S.flexneri对于2种喹诺酮类抗生素左氧氟沙星,环丙沙星的最低抑菌浓度MIC,最小杀菌浓度MBC及最低生物膜消除浓度MBEC,结果如表2所示。

表2 S.flexneri最低抑菌浓度,最小杀菌浓度及最低生物膜消除浓度Table 2 Antibiotic sensitivity of S.flexneri as a planktonic population(MIC and MBC)and as a biofilm population(MBEC)
两种抗生素对S.flexneri的作用处于同一水平。在浓度为0.25 μg/mL时,两种抗生素对于浮游状态下的S.flexneri有着抑制其生长的作用。而如果要彻底杀死浮游状态下的菌体,则两种抗生素的浓度需要达到0.5 μg/mL。两种抗生素浓度达到256 μg/mL时,可消除S.flexneri已形成的生物膜。结果表明,形成生物膜后的S.flexneri相较于浮游状态下的菌体,耐药能力提升了1 000倍。所以,S.flexneri一旦形成生物膜,其将会变得难已应对。然而,在加入EPS后,抗生素对生物膜的消除能力有着显著地提升,在64 μg/mL时,就已经达到消除目的。EPS使S.flexneri的耐药能力降低了75%,从而变得更易清除。Jiang等[3]发现,一株Vibrio sp QY101的胞外多糖对于Pseudomonas aeruginosa的抗生素耐药性有降低作用。
2.3 EPS对致病菌菌体表面性质的影响
2.3.1 致病菌疏水性
加入EPS后致病菌菌体疏水性变化结果见表3。

表3 多糖对不同致病菌疏水性的抑制Table 3 Inhibitory effect of EPS on the hydrophobicity of pathogen strains
如表3所示,向不同致病菌培养液中加入L.plantarum-12 EPS,致病菌菌体表面疏水性显著降低(p<0.05),其中S.flexneri疏水性下降了91.37%。以S.flexneri为指示菌进一步研究不同浓度EPS在对其菌体疏水性的影响,结果如图3所示。

图3 EPS对S.flexneri疏水性抑制作用Fig.3 Inhibitory effect of EPS on the hydrophobicity of S.flexneri
发现随着EPS浓度由0升至4 mg/mL时S.flexneri疏水性从26.1%下降至2.4%。在S.flexneri与EPS共培养的初期,由于S.flexneri疏水性的降低,从而使其更容易在液体培养基中呈现浮游状态。细菌菌体的疏水性与其黏附及聚集效应密切相关,EPS使致病菌疏水性降低可能是其抑制致病菌形成生物膜的因素之一。菌体在生物膜形成的第一阶段起始黏附过程中,与有生命或无生命的载体表面相接处,进而附着于表面上,菌体表面疏水性越高也就意味着其更容易发生黏附及自聚效应,越容易形成细菌簇,这也就增强了其对不良环境的抵抗能力[26]。相反疏水性降低则其黏附及自聚效应会相对降低,从而影响细菌形成生物膜。有研究表明,细菌菌体表面的疏水性多由蛋白类物质提供,而亲水性则多由多糖类物质提供[18]。那么,加入多糖之后,多糖可能与菌体表面的某些特定部位相结合从而给菌体增加了亲水性基团,或者掩盖了部分疏水性基团,使菌体的疏水性降低,抑制了细菌之间的聚集,进而抑制了生物膜的形成。
2.3.2 EPS对S.flexneri自聚性的影响
EPS对S.flexneri自聚性抑制作用见图4。

图4 EPS对S.flexneri自聚性抑制作用Fig.4 Inhibitory effect of EPS on the auto-aggregation of S.flexneri
如图4所示,S.flexneri自聚性在EPS影响下逐渐降低,与对照组相比,在加入4 mg/mL EPS的LB培养基中S.flexneri的自聚性为16.6%,显著低于(p<0.05)对照组中S.flexneri自聚性27.1%。细菌的自聚性与细菌粘附能力是相关联的[18-19],且细菌菌体表面成分脂壁酸,蛋白,碳水化合物等与细菌自聚性也有一定的相关性,L.plantarum-12 EPS也有可能抑制了S.flexneri某些表面成分的表达,从而降低了S.flexneri的自聚性[27]。
2.4 EPS对S.flexneri胞外多聚物基质的影响
S.flexneri生物膜胞外多聚物基质组分测定结果如图5所示。
在L.plantarum-12 EPS的作用下,S.flexneri胞外多聚物中EPS的含量显著降低(p<0.01),最低仅为对照组的5.4%。而胞外多聚物中,蛋白质及eDNA的含量并无显著性变化。细菌在形成生物膜的过程中会释放大量的胞外多聚物基质将菌体包裹起来,其中蛋白质,胞外多糖,胞外DNA等是胞外多聚物的重要组成成分,胞外多糖等构成了细菌生物膜的框架,相互黏连的菌体就附着于框架表面[25]。由此可见,L.plantarum-12 EPS抑制了S.flexneri形成生物膜时自身多糖的分泌,这也就使S.flexneri缺少了可以附着的框架。S.flexneri能够分泌群体感应信号分子AI-2进行群体行为调控[28-29],L.plantarum-12 EPS可能也充当了一种信号分子对涉及S.flexneri形成生物膜的基因表达有一定的抑制作用[15],Y.Kim等研究发现Lactobacillus acidophilus A4分泌的多糖对E.coli的菌毛基因表达有明显的抑制作用从而抑制了E.coli生物膜的形成[30]。而L.plantarum-12 EPS可能抑制了S.flexneri分泌多糖基因的表达,因而抑制了其生物膜的形成。

图5 EPS对S.flexneri胞外多聚物基质的影响Fig.5 Influence of EPS on the extracellular polymeric substances of S.flexneri
3 结论
本研究结果表明L.plantarum-12 EPS能够抑制6种常见食源性致病菌E.coli,S.aureus,Salmonella,L.monocytogenes,V.Parahaemolyticus,S.flexneri生物膜的形成,其中对S.flexneri菌株生物膜抑制率最高达53.24%;且EPS能够降低S.flexneri疏水性与自聚性,抑制S.flexneri胞外多聚物中多糖的表达量;L.plantarum-12 EPS可使S.flexneri生物膜耐药性降低75%。综上,L.plantarum-12 EPS对于预防或清除S.flexneri生物膜有着潜在的应用前景。其中的作用机制需要进一步的相关研究。
参考文献:
[1]崔海英,张雪婧,赵呈婷,等.细菌生物膜的研究进展[J].江苏农业科学,2015(8):11-14
[2]李彤,庄辉.细菌生物膜的研究进展[J].中华微生物学和免疫学杂志,2002(3):111-114
[3]Jiang P,Li J,Han F,et al.Antibiofilm activity of an exopolysaccharide from marine bacterium Vibrio sp.QY101[J].PLoS One,2011,6(4):e18514
[4]Maria José Valeraa,Maria Jesús Torijaa,Albert Masa,et al.Acetic acid bacteria from biofilm of strawberry vinegar visualized by microscopy and detected by complementing culture-dependent and culture-independent techniques[J].Food Microbiology,2015,46:452-462
[5]魏冉,张宝善,李亚武,等.醋酸菌产膜机理及膜对食醋发酵品质的影响[J].食品与发酵工业,2014(3):182-186,200
[6]陈小雪,陈晶瑜,韩北忠.食品加工过程中细菌生物被膜的危害及控制[J].中国酿造,2016(1):1-4
[7]张传斌,袁飞,黄海兰,等.食品中志贺氏菌检测方法的研究进展[J].食品工业,2017(6):262-266
[8]崔庆刚,杨志远,杜永新,等.志贺氏菌的生化特性及检测方法的研究进展[J].上海畜牧兽医通讯,2017(1):23-25
[9]黄伟,李旭廷,刘兴福.细菌生物膜与细菌耐药性研究进展[J].畜牧与饲料科学,2012,33(8):81-83
[10]Nagar V,Pansare Godambe L,Shashidhar R.Radiation sensitivity of planktonic and biofilm-associated Shigella spp.and Aeromonas spp.on food and food-contact surfaces[J].International Journal of Food Science&Technology,2017,52(1):258-265
[11]Valle J,Da Re S,Henry N,et al.Broad-spectrum biofilm inhibition by a secreted bacterial polysaccharide[J].Proe Natl Acad Sci U S A,2006,103(33):12558-12563
[12]段高飞,韩峰,李京宝,等.细菌生物膜相关感染的防治方法研究进展[J].中国海洋大学学报(自然科学版),2010,40(5):107-111
[13]Parrilli E,Papa R,Carillo S,et al.Anti-biofilm activity of pseudoalteromonas haloplanktis tac125 against staphylococcus epidermidis biofilm:Evidence of a signal molecule involvement?[J].International Journal of Immunopathology&Pharmacology,2015,28(1):104-113
[14]Alves M T,Ferreira D S T,Evangelista D A M,et al.Inhibition of Staphylococcus aureus biofilm by Lactobacillus isolated from fine cocoa[J].Bmc Microbiology,2016,16(1):250
[15]Wang J,Zhao X,Yang Y,et al.Characterization and bioactivities of an exopolysaccharide produced by Lactobacillus plantarum YW32[J].International Journal of Biological Macromolecules,2015,74:119-126
[16]Stepanovic S,Vukovic D,Dakic I,et al.A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J].Journal of Microbiological Methods,2000,40(2):175-179
[17]Sayem S A,Manzo E,Ciavatta L,et al.Anti-biofilm activity of an exopolysaccharide from a sponge-associated strain of Bacillus licheniformis[J].Microbial Cell Factories,2011,10(1):74
[18]Collado M C,Meriluoto J,Salminen S.Adhesion and aggregation properties of probiotic and pathogen strains[J].European Food Re-search&Technology,2008,226(5):1065-1073
[19]Gowrishankar S,Sivaranjani M,Kamaladevi A,et al.Cyclic dipeptide-cyclo(L-leucyl-L-prolyl)from marine Bacillus amyloliquefaciens mitigates biofilm formation and virulence in Listeria monocytogenes.[J].Pathogens&Disease,2016,74(4):ftw017
[20]郭远骥.乳杆菌菌株对人肠上皮细胞屏障功能的影响[D].大连:大连工业大学,2016
[21]Kaplan J B,Izano E A,Gopal P,et al.Low Levels of β-Lactam Antibiotics Induce Extracellular DNA Release and Biofilm Formation in Staphylococcus aureus[J].Mbio,2012,3(4):e00198-12
[22]邵丽.产胞外多糖乳杆菌的筛选及其多糖的分离、结构和生物活性研究[D].无锡:江南大学,2015
[23]George O'Toole,Heidi B Kaplan,Roberto Kolter.Biofilm Formation sa Microbial Development[J].Annual Review of Microbiology,2000,54:49-79
[24]李京宝.一种海洋的弧菌胞外多糖A101的抗生物膜作用研究[D].青岛:中国海洋大学,2007
[25]祝司霞.细菌生物膜的结构及形成机制的研究进展[J].沈阳医学院学报,2015,17(2):115-117
[26]Lather Puja,Mohanty A K,Jha Pankaj,et al.Contribution of Cell Surface Hydrophobicity in the Resistance of Staphylococcus aureus against Antimicrobial Agents[J].Biochemistry Research International,2016(2):1-5
[27]Boris S,Suárez J E,Barbés C.Characterization of the aggregation promoting factor from Lactobacillus gasseri,a vaginal isolate[J].Journal of Applied Microbiology,1997,83(4):413-420
[28]徐苹,杨晶,陆丽兰,等.密度感应系统对弗氏志贺菌生长竞争能力的影响[J].遗传,2015,37(5):487-493
[29]Jr D W,Maurelli A T.Shigella flexneri LuxS quorum-sensing system modulates virB expression but is not essential for virulence[J].Infection&Immunity,2001,69(1):15-23
[30]Younghoon K,Sejong O,Saehun K.Released exopolysaccharide(r-EPS)produced from probiotic bacteria reduce biofilm formation of enterohemorrhagic Escherichia coli O157:H7[J].Biochemical&Biophysical Research Communications,2009,379(2):324-329
