杏扁PaCBF1基因的克隆及其生物信息学分析
2018-05-07王连荣薛拥志王宝地
王连荣,薛拥志,王宝地
(1.河北北方学院 园艺系,河北 张家口 075131;2.河北北方学院 动物科技学院,河北 张家口 075131;3.河北北方学院 理学院,河北 张家口 075000)
非生物逆境胁迫如低温、干旱等是限制植物正常生长、发育的重要因素,严重时会对植物造成伤害甚至死亡。但是植物在面对非生物逆境胁迫时并不是完全被动和消极的,它能够快速感知逆境,并通过信号传递积极而主动的适应[1]。植物中存在一个以CBF(C-repeat binding factor/dehydration-responsive element binding factor,CBF/DREB1) 转录因子为主导的低温和脱水响应通路[2],该类转录因子能调控下游抗逆基因的表达[3-6],从而提高植物对干旱、低温等非生物逆境胁迫的抵抗。CBF是一个基因家族,1997年Stockinger等[7]首次在低温诱导的拟南芥中分离出CBF1转录因子,1998年Gilmour等[8]又从低温诱导的拟南芥cDNA文库中克隆了CBF1、CBF2、CBF3基因,随后又相继从拟南芥中克隆出CBF4、CBF5、CBF6基因。
目前,已经从多种植物中克隆出转录因子CBF基因[2,9-10],并对CBF基因在逆境条件下的诱导表达进行了研究[10-13]。但杏扁CBF基因的克隆研究未见报道。杏扁(PrunusarmeniacaL.)抗旱耐寒,防风固沙,经济和生态效益显著[14],然而生产中杏扁基地建设一般面向丘陵山区,以干旱地带为主,春季花和幼果又常遭遇低温和晚霜危害。因此,克隆和分析杏扁CBF基因,对杏扁抗逆性的研究具有重要的意义。本研究选取生产上较抗寒的杏扁品种围选1号为试材,克隆其CBF基因全长,并对其进行生物信息学分析。为今后进一步研究杏扁CBF转录因子的功能并对逆境环境的抵抗机制提供理论基础,为生产中提高杏扁的抗逆性提供科学依据。
1 材料和方法
1.1 材料与处理
本试验以河北北方学院园艺系标本园内栽植的杏扁品种围选1号为材料。于2016年4月树体萌芽时,采集1年生的枝条,带回实验室,4 ℃水培处理4 h后采集幼叶。幼叶经液氮速冻后置于-80 ℃冰箱保存,用于PaCBF1基因的克隆。
1.2 试验方法
1.2.1 围选1号总RNA的提取及检测 利用植物总RNA小量提取试剂盒提取总RNA。采用琼脂糖凝胶电泳技术,对提取的RNA进行完整性检测。
1.2.2 cDNA第 1链的制备 利用TIANScriptⅡ cDNA第1链合成试剂盒合成cDNA第1链。
1.2.3PaCBF1基因编码区全长cDNA的扩增 根据GenBank公布的梅CBF基因序列(登录号:NM_001301005.1)设计特异引物,扩增围选1号CBF基因编码区全长cDNA。引物序列CBF1-F:5′-GCATATAGCTTACTCTAATGGAC-3′;CBF1-R:5′-CCGCTCGAGTTAAATGGAGAAACTCCACAATT-3′,由上海生工生物工程股份有限公司合成。在CBF1-R引物的5′端添加了XhoⅠ酶切位点CTCGAG及保护碱基CCG。
PCR反应体系:模板cDNA 1 μL,CBF1-F(10 μmol/L) 1 μL,CBF1-R(10 μmol/L) 1 μL,2×PCR mix 10 μL,ddH2O 7 μL,总体积20 μL。采用降落PCR扩增,循环参数为:94 ℃预变性5 min;94 ℃变性50 s,60 ℃退火60 s,72 ℃延伸80 s,2个循环;94 ℃变性50 s,58 ℃退火60 s,72 ℃延伸80 s,2个循环;94 ℃变性50 s,56 ℃退火60 s,72 ℃延伸80 s,2个循环;94 ℃变性50 s,54 ℃退火60 s,72 ℃延伸80 s,25个循环;最后72 ℃延伸10 min。第一轮PCR反应结束后,以第1轮反应产物为模板进行第2轮PCR扩增。第2轮PCR扩增时的反应体系与反应程序同第1轮PCR反应。
1.2.4PaCBF1基因片段的回收、连接、转化及阳性克隆的筛选PaCBF1基因片段采用琼脂糖凝胶DNA回收试剂盒进行回收;将回收的PaCBF1基因片段采用pGM-T克隆试剂盒与pGM-T载体连接构成重组DNA,然后将重组DNA转化到DH5α感受态细胞中,并涂布于含有氨苄青霉素、 IPTG和X-gal的LB固体筛选培养基上,37 ℃过夜培养。挑取白色单菌落于含100 μg/mL氨苄青霉素的LB液体培养基中培养8 h,提取质粒,PCR检测后,挑选阳性克隆,送北京华大基因公司测序。
1.2.5PaCBF1基因的生物信息学分析 对获得的杏扁PaCBF1基因序列利用DNAMAN 8.0软件寻找最长的开放阅读框(Open reading frame,ORF);在NCBI上用Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对PaCBF1基因序列和蛋白序列进行比对分析;使用ProtParam tool(http://web.expasy.org/protparam/)在线分析杏扁PaCBF1蛋白的氨基酸组成以及理化性质;使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)在线预测PaCBF1蛋白的二级结构;使用SWISS-MODEL(https://swissmodel.expasy.org/interactive)构建 PaCBF1蛋白的三级结构。使用BaCelLo(http://gpcr2.biocomp.unibo.it/bacello/pred.htm)以及PSORT Ⅱ(https://psort.hgc.jp/form2.html)在线工具对杏扁PaCBF1蛋白进行亚细胞定位预测;使用SignalP-4.1 Server在线软件(http://www.cbs.dtu.dk/services/SignalP/)对 杏扁PaCBF1蛋白进行信号肽分析;采用 Kinase Phos(http://kinasephos.mbc.nctu.edu.tw/)对杏扁PaCBF1蛋白进行磷酸化位点分析。
2 结果与分析
2.1 杏扁PaCBF1基因编码区全长cDNA的克隆
以杏扁品种围选1号cDNA的第1链为模板,CBF1-F和CBF1-R序列为引物,进行RT-PCR 扩增,获得了750 bp左右的cDNA片段(图 1)。将扩增片段回收、连接、转化,提质粒检测,挑取阳性克隆测序。测序结果经过Nucloetide Blast比对,与GenBank公布的梅CBF基因序列(登录号:NM_001301005.1)同源性达到94%,这说明该序列属于CBF基因家族成员。将该序列命名为杏扁PaCBF1,并将该序列提交到GenBank,获得基因登录号:MF491392。
2.2 杏扁PaCBF1基因编码区全长cDNA的序列分析
利用DNAMAN 8.0软件分析,杏扁PaCBF1基因具有一个完整的ORF,片段长度为 723 bp,终止密码子为 TAA,编码 240个氨基酸(图2)。对杏扁PaCBF1基因的氨基酸序列进行Protein Blast比对,结果表明,其含有转录因子家族保守的AP2结构域(图3)。进一步分析发现(图2),杏扁PaCBF1蛋白含有植物CBF蛋白的保守结构域,分别为:PKKRAGRRVFKETRHP域,该氨基酸序列仅在CBF蛋白中发现,作为碱性氨基酸残基核心定位信号;DSAWR域,该序列也仅在CBF蛋白中发现;LWSF域,该序列主要作为双子叶植物CBF蛋白特征[15]。
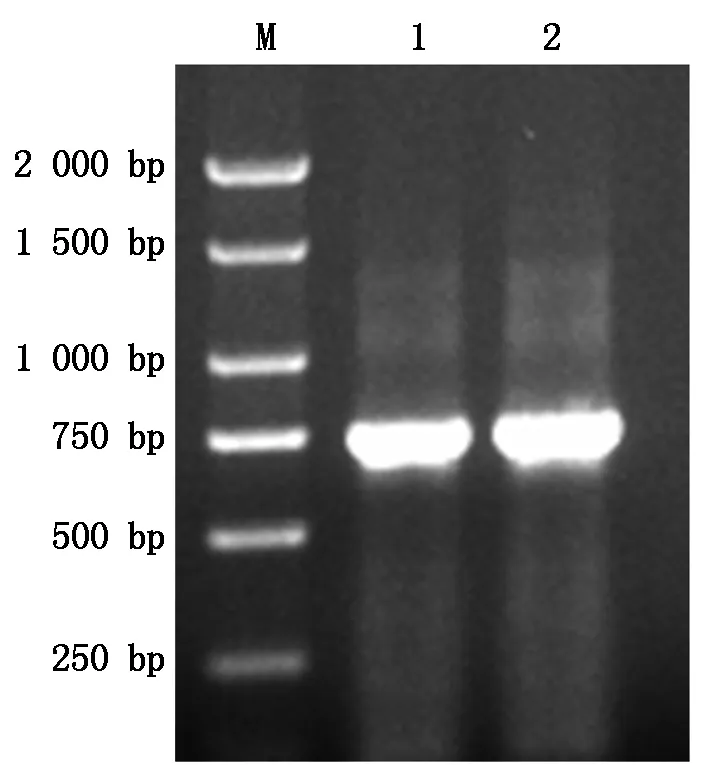
M.DL2000 DNA Marker;1~2.RT-PCR扩增产物。M.DL2000 DNA Marker;1-2.Amplified product of RT-PCR.

上排为cDNA序列,下排为氨基酸序列;ATG为起始密码子,TAA为终止密码子;双下划线标注的为植物CBF蛋白保守结构域,单下划线标注的为AP2 DNA结构域。The upper lines are cDNA sequences,the lower lines are amino acid sequences;ATG is the start codon,TAA is the stop codon;Amino acids on double underlines represent characteristic sequences of CBF protein of the plant,amino acids on single underline represent AP2 DNA-binding domains.
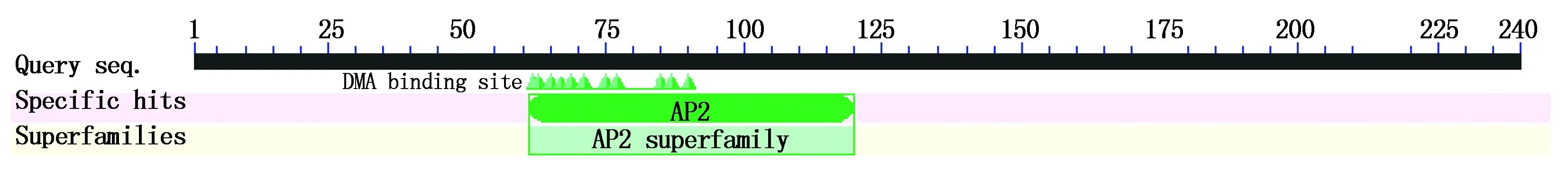
图3 保守域预测Fig.3 Putative conserved domains
2.3 杏扁PaCBF1蛋白理化性质的预测及其氨基酸组成的分析
使用ProtParam tool在线预测杏扁PaCBF1蛋白的相对分子质量为 26.928 ku,理论等电点为6.35,分子式为 C1160H1842N344O363S16,原子总数为3 725,半衰期为30 h。该蛋白的疏水性平均值为-0.555,由于正值越大表示越疏水,负值越大表示越亲水,说明该蛋白为亲水蛋白。PaCBF1蛋白的氨基酸组成见表1,Ser、Arg、Ala的相对含量较高,分别为10.8%,9.6%,9.2%;Gln、Tyr的相对含量最低,均为1.7%。带负电荷的Asp残基数为20,Glu残基数为17;带正电荷的Arg残基数为23,Lys残基数为13。
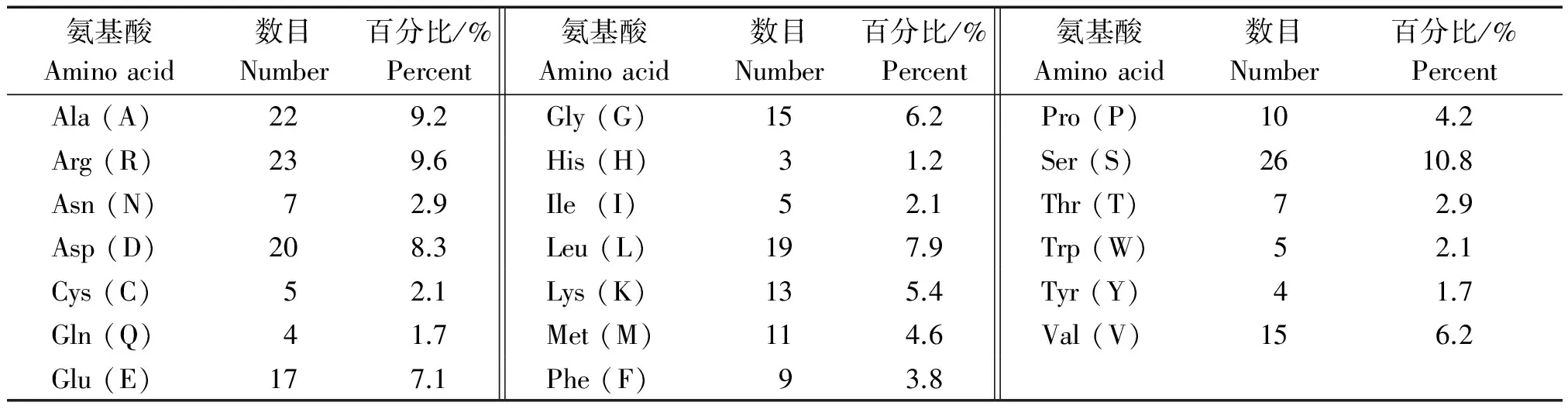
表1 PaCBF1蛋白的氨基酸组成Tab.1 Amino acid composition of PaCBF1 protein
2.4 杏扁 PaCBF1蛋白二级结构以及三级结构的预测
使用SOPMA在线预测杏扁PaCBF1蛋白的二级结构,结果显示该蛋白主要由38.75%的无规则卷曲(Random coil)、29.58%的α-螺旋(Alpha helix)、22.92%的延伸链(Extended strand)和8.75%的β-转角(Beta turn)组成(图4)。利用SWISS-MODEL进行杏扁PaCBF1蛋白的三级结构的构建,预测结果显示有α-螺旋、β-折叠和β-转角,及该蛋白的三维空间结构(图5)。
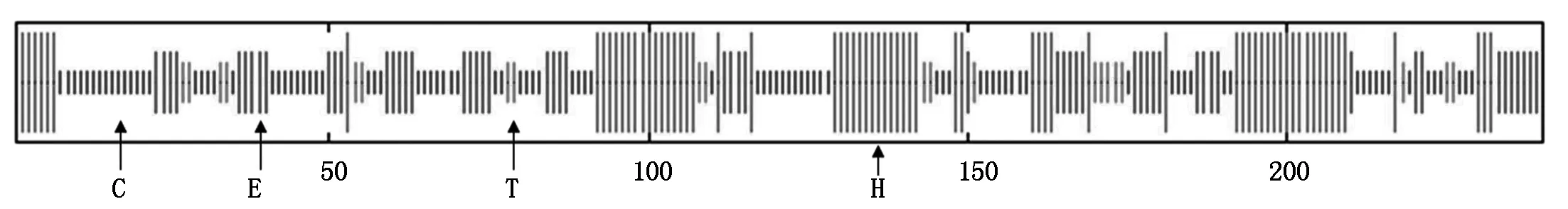
C.无规则卷曲;E.延伸链;T.β-转角;H.α-螺旋。C.Random coil;E.Extended strand;T.Beta turn;H.Alpha helix.
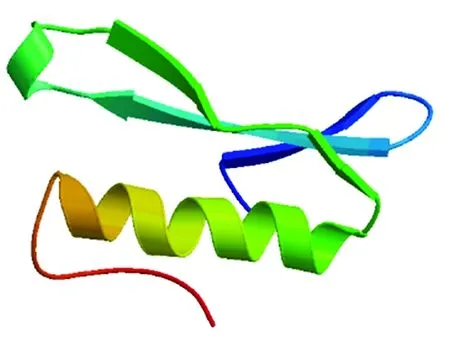
图5 PaCBF1蛋白三级结构预测Fig.5 Tertiary structure prediction of PaCBF1 protein
2.5 杏扁PaCBF1蛋白亚细胞定位预测
使用PSORTⅡ在线工具预测杏扁PaCBF1蛋白的亚细胞定位情况,结果显示:PaCBF1蛋白定位在细胞核中的可能性为60.9%,定位在细胞骨架的可能性为17.4%,定位在细胞质的可能性为13.0%,定位在高尔基体的可能性为4.3%,因此,推断杏扁PaCBF1蛋白定位在细胞核中。同时使用BaCelLo在线分析结果表明,杏扁PaCBF1蛋白也定位在细胞核中(图6)。
2.6 杏扁PaCBF1蛋白信号肽分析
使用SignalP-4.1 Server在线软件对杏扁PaCBF1蛋白进行信号肽分析,结果显示S值、C值、Y值的变化趋势均较平稳,D值中的signal peptide为No,说明该蛋白不存在信号肽序列,没有剪切位点,不是分泌蛋白 (图7)。
2.7 杏扁PaCBF1蛋白磷酸化位点分析
采用Kinase Phos 在线工具对杏扁PaCBF1蛋白进行磷酸化位点分析,结果见图8。 从图8可以看出,杏扁PaCBF1蛋白的每个磷酸化位点所处的位置。该编码蛋白共有1处酪氨酸(Tyrosine,Y)磷酸化位点、1处苏氨酸(Threonine,T)磷酸化位点、11处丝氨酸(Serine,S)磷酸化位点。
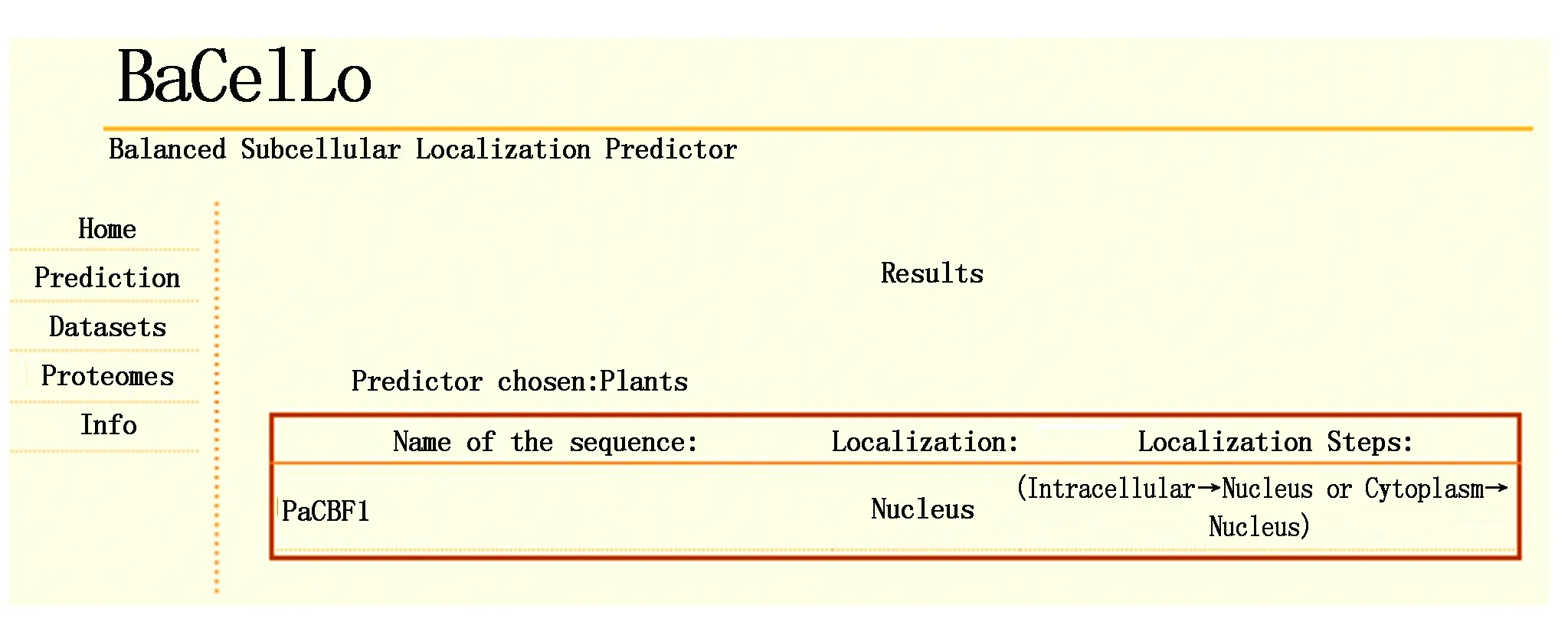
图6 PaCBF1蛋白亚细胞定位Fig.6 Subcellular localization of PaCBF1 protein

图7PaCBF1蛋白信号肽分析
Fig.7SignalpeptideanalysisofPaCBF1protein
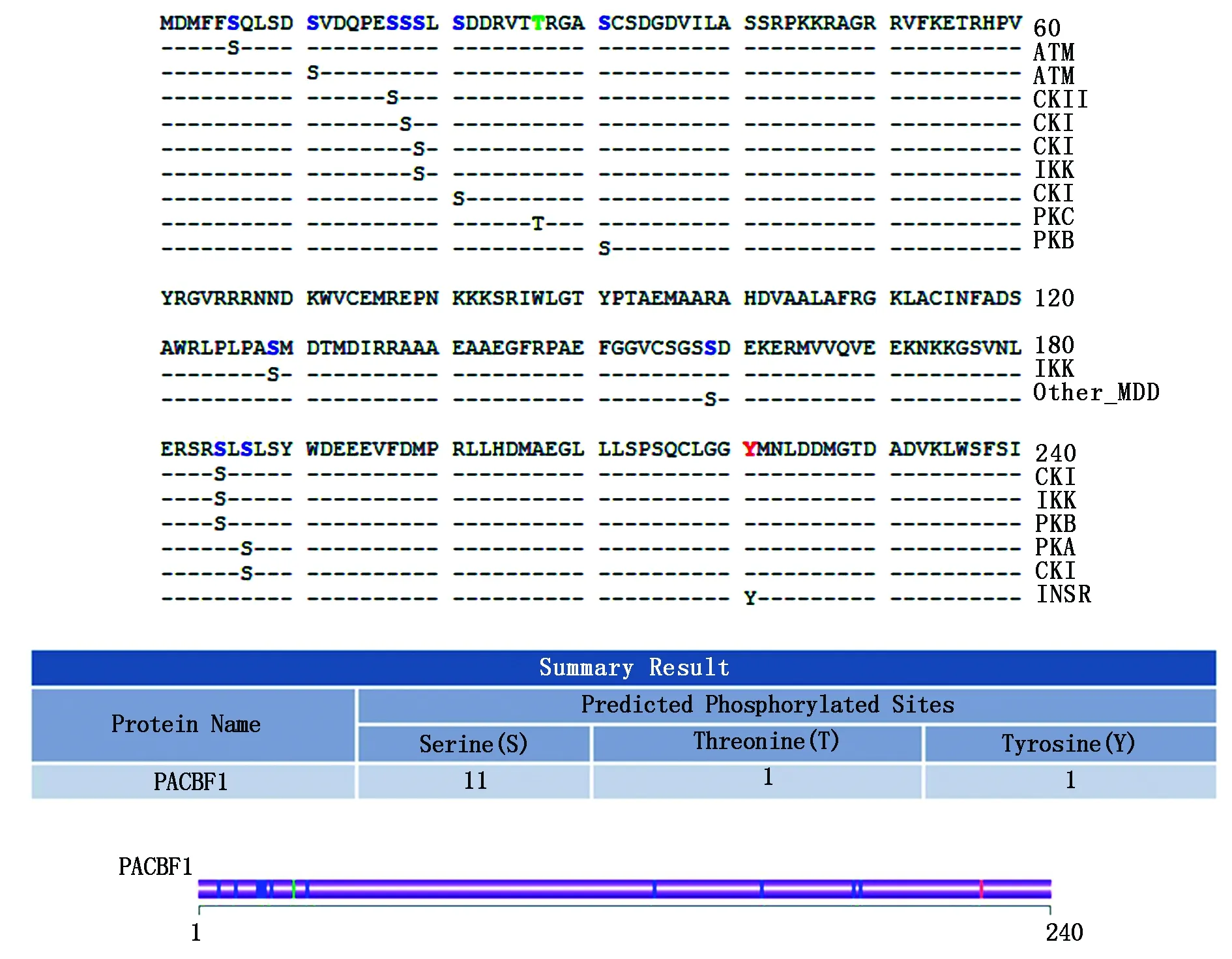
图8 PaCBF1蛋白磷酸化位点分析Fig.8 Phosphorylation site analysis of PaCBF1 protein
3 讨论
生物信息学就是从核酸和蛋白质序列出发,分析序列中表达的结构功能的生物信息。在基因研究中,利用生物信息学进行前期或后续分析越来越普遍[16]。本研究应用生物信息学对杏扁PaCBF1基因和PaCBF1蛋白序列进行了具体的分析。
目前,低温信号转录因子中被研究最多的就是CBF转录因子[17]。它属于AP2 转录因子家族,含有非常保守的DNA 结构域,不含内含子[18],能结合到CRT/DRE(CCGAC/TACCGACAT)顺式作用元件上[7],起反式作用因子功能,调控植物的细胞周期、生长发育以及非生物逆境胁迫相关基因的表达[16],进而提高植物的抗逆性。本研究在杏扁围选1号中克隆了1个CBF基因,命名为杏扁PaCBF1,GenBank上基因登录号为MF491392。进一步分析发现杏扁PaCBF1蛋白含有一个高度保守的AP2结构域,以及植物CBF蛋白的保守结构域PKKRAGRRVFKETRHP和DSAWR,这与前人研究相吻合[19-20];该蛋白在AP2结构域处含有1个α-螺旋、3个β-折叠,其中第14位的缬氨酸(V14)和第19位的谷氨酸(E19)是决定CBF/DREB与CRT/DRE特异性结合的关键位点[21],这2个氨基酸残基在PaCBF1蛋白中保守存在。
信号肽位于分泌蛋白的N-端,由15~60个氨基酸组成,指导分泌蛋白发生跨膜转移与定位[22]。目前Signal是预测蛋白质是否含有信号肽的应用最广泛的预测软件之一[23]。本研究使用SignalP-4.1对杏扁PaCBF1蛋白进行信号肽分析,结果表明,该蛋白不存在信号肽序列,没有剪切位点,不是分泌蛋白,这与张亮等[24]对扁桃CBF1基因的研究结果相一致。同时对杏扁PaCBF1蛋白的亚细胞定位进行预测,结果显示该蛋白定位在细胞核中。
蛋白质磷酸化是蛋白质翻译后修饰的一种重要方式,包括蛋白质磷酸化修饰与去磷酸化修饰,是一种可逆的过程[25]。磷酸化修饰具有改变和调控蛋白质-DNA/RNA互作、蛋白质-蛋白质互作、蛋白质稳定性以及酶活性的潜能,进而影响蛋白质功能[26]。在真核生物中,蛋白质磷酸化主要发生在丝氨酸、苏氨酸和酪氨酸上[27]。一个磷酸化蛋白质可能含有1个或多个磷酸化氨基酸位点[28]。本研究采用Kinase Phos在线工具分析杏扁PaCBF1蛋白,结果表明,该蛋白有11处丝氨酸磷酸化位点、1处苏氨酸磷酸化位点和1处酪氨酸磷酸化位点。磷酸化修饰是生物体内重要的共价修饰方式之一,与信号传导、细胞周期、生长发育等密切相关。由此推测,杏扁PaCBF1蛋白质的可逆磷酸化可能是杏扁在逆境胁迫下的主要信号传递方式。
参考文献:
[1] 李天忠,张志宏.现代果树生物学[M].北京:科学出版社,2008:211.
[2] 成 伟,郑艳茹,葛丹凤,等.甘蔗转录激活因子ScCBF1基因的克隆与表达分析[J].作物学报,2015,41(5):717-724.
[3] 刘 辉,李德军,邓 治.植物应答低温胁迫的转录调控网络研究进展[J].中国农业科学,2014,47(18):3523-3533.
[4] Jaglo K R,Kleff S,Amundsen K L,et al. Components of theArabidopsisc-repeat/dehydration-responsive element binding factor cold-response pathway are conserved inBrassicanapusand other plant species[J]. Plant Physiology,2001,127(3):910-917.
[5] Mizoi J,Shinozaki K,Yamaguchi-Shinozaki K. AP2/ERF family transcription factors in plant abiotic stress responses[J]. Biochimica et Biophysica acta,2012,1819(2):86-96.
[6] Licausi F,Ohme-Takagi M,Perata P. APETALA2/ethylene responsive factor (AP2/ERF) transcription factors:mediators of stress responses and developmental programs[J]. The New Phytologist,2013,199(3):639-649.
[7] Stockinger E J,Gilmour S J,Thomashow M F.ArabidopsisthalianaCBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE,a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit[J]. Proceedings of the National Academy of Sciences of the United States of America,1997,94(3):1035-1040.
[8] Gilmour S J,Zarka D G,Stockinger E J,et al. Low temperature regulation of theArabidopsisCBF family of AP2 transcriptional activators as an early step in cold-induced COR gene expression[J]. Plant Journal,1998,16(4):433-442.
[9] 徐 丽,陈 新,张力思,等. 核桃JrCBF基因的克隆与表达和单核苷酸多态性分析[J]. 植物遗传资源学报,2014,15(2):320-326.
[10] 张 勇,汤浩茹,罗 娅,等. 草莓FaCBF1基因的克隆及表达分析[J]. 园艺学报,2014,41(2):240-248.
[11] Chen H,Chen X,Chai X,et al. Effects of low temperature on mRNA and small RNA transcriptomes inSolanumlycopersicoidesleaf revealed by RNA-Seq[J]. Biochemical and Biophysical Research Communications,2015,464(3):768-773.
[12] Byun M Y,Lee J,Cui L H,et al. Constitutive expression of DaCBF7,an Antarctic vascular plant Deschampsia Antarctica CBF homolog,resulted in improved cold tolerance in transgenic rice plants[J]. Plant Science :an International Journal of Experimental Plant Biology,2015,236(7):61-74.
[13] Karimi M,Ebadi A,Mousavi S A,et al. Comparison ofCBF1,CBF2,CBF3 andCBF4 expression in some grapevine cultivars and species under cold stress[J]. Scientia Horticulturae,2015,197(17):521-526.
[14] 王连荣,薛拥志,常美花,等. 外源激素对杏扁抗寒生理指标的影响[J]. 核农学报,2016,30(2):396-403.
[15] 章 镇,韩振海. 果树分子生物学[M]. 上海:上海科学技术出版社,2012:190.
[16] 蒋 瑶,陈其兵. 植物CBF1转录因子的生物信息学分析[J]. 林业科学,2010,46(6):43-50.
[17] 冯勋伟,才宏伟. 结缕草CBF基因的同源克隆及其转基因拟南芥的抗寒性验证[J]. 作物学报,2014,40(9):1572-1578.
[18] Skinner J S,Von Zitzewitz J,Szucs P,et al. Structural,functional,and phylogenetic characterization of a largeCBFgene family in barley[J]. Plant Molecular Biology,2005,59(4):533-551.
[19] Liu Q,Kasuga M,Sakuma Y,et al. Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression,respectively,inArabidopsis[J]. The Plant Cell,1998,10(8):1391-1406.
[20] Medina J,Bargues M,Terol J,et al. The arabidopsisCBFgene family is composed of three genes encoding AP2 domain-containing proteins whose expression is regulated by low temperature but not by abscisic acid or dehydration[J]. Plant Physiology,1999,119(2):463-469.
[21] Sakuma Y,Liu Q,Dubouzet J G,et al. DNA-binding specificity of the ERF/AP2 domain ofArabidopsisDREBs,transcription factors involved in dehydration-and cold-inducible gene expression[J]. Biochemical and Biophysical Research Communications,2002,290(3):998-1009.
[22] 杨俊誉,张志超,韩永花,等. 马铃薯青枯菌Po82菌株质粒基因组分泌蛋白信号肽的分析[J]. 西南农业学报,2016,29(5):1121-1127.
[23] 吕伟强,刘 聪,黄丽丽,等. 内生菌KM-1-2 全基因组ORFs 信号肽和分泌蛋白预测及功能分析[J]. 微生物学报,2017,57(3):411-421.
[24] 张 亮,张智俊,李 疆,等. 扁桃CBF1基因的克隆与生物信息学分析[J]. 中国农学通报,2014,30(34):16-23.
[25] 刘 秋,钟月仙,万伟峰,等. 植物磷酸化蛋白质组学研究进展[J]. 福建农林大学学报:自然科学版,2015,44(3):225-231.
[26] 苑克俊,程来亮,牛庆霖,等. 着色与非着色苹果品种中磷酸化蛋白质的鉴定与分析[J]. 中国农业科学,2016,49(8):1530-1539.
[27] 姜 铮,王 芳,何 湘,等. 蛋白质磷酸化修饰的研究进展[J]. 生物技术通讯,2009,20(2):233-237.
[28] 张 倩,杨 振,安学丽,等. 蛋白质的磷酸化修饰及其研究方法[J]. 首都师范大学学报:自然科学版,2006,27(6):43-49.
