胃癌组织YAP1、E-cadherin、N-cadherin表达及临床意义
2018-05-07肖磊黄昌浩袁伟杰陈晋湘骆晴晴陈子华
肖磊,黄昌浩,袁伟杰,陈晋湘,骆晴晴,陈子华
(中南大学湘雅医院 1. 胃肠外科 2. 肿瘤科,湖南 长沙 410008)
胃癌是世界上最常见的恶性肿瘤之一,全世界每年约有95万例诊断为胃癌,2012年全球因胃癌死亡72.3万例[1]。在我国,胃癌在总体肿瘤发生和死亡例数中均居于第2位[2]。胃癌侵袭转移能力强是导致胃癌患者死亡的重要原因。而目前胃癌侵袭转移的分子机制仍不清楚。因此,研究胃癌侵袭转移的分子机制,探寻有效的早期诊断及转移预警标志物,对于提高胃癌治疗疗效,改善胃癌患者预后具有十分重要的意义,也一直是胃癌研究的热点及重点。
上皮-间质转化(epithelial-mesenchymal transition,EMT)是指具有上皮形态和功能的细胞由于极性消失、细胞间连接丢失、细胞骨架重排从而表现出间质细胞样特征的生理与病理学过程[3]。多项研究显示,EMT进程与肿瘤的发生发展具有密切关系,能调节多种肿瘤细胞特性,如抗失巢凋亡、抗细胞衰老、免疫抑制、化疗耐药、干细胞特性的获得与维持以及肿瘤相关炎症等。其使肿瘤细胞间的黏附能力减弱、生存能力及侵入间质的能力增强,因此成为肿瘤细胞脱离肿瘤母体向周围组织侵袭及远处转移的重要起始事件。在诸多实体肿瘤如胃癌、肺癌、乳腺癌、结直肠癌的研究中,EMT被认为是肿瘤侵袭转移的重要进程。E-cadherin是上皮样细胞的重要细胞膜标志物,在EMT进程中表达降低;与之相反,N-cadherin是间质样细胞的重要标志物,在EMT进程中表达升高。许多信号通路如TGF-β/Smad、Ras/MAPK、Notch、Wnt/β-catenin和Hippo等参与调节EMT的发生。
YAP1(Yes-association protein 1)是Hippo信号通路的关键性信号分子,Hippo信号通路最早在果蝇中发现,具有高度保守性,通过抑制细胞增殖,诱导细胞凋亡,维持器官发育至正常体积[4]。肿瘤细胞中Hippo通路活性通常处于抑制状态,参与多种肿瘤细胞特性如细胞增殖、细胞凋亡、干细胞特性以及侵袭转移能力的获得与调控[5],YAP1入核后与TEAD等结合形成转录复合物调控靶基因的表达,促进肿瘤细胞的侵袭和转移[6]。目前多项最新研究表明,在肝癌[7]、肺癌[8]、宫颈癌[9]等恶性实体肿瘤中,YAP1可诱导EMT发生,促进肿瘤侵袭转移。但在胃癌的研究中,尚缺乏基于临床病理学资料的研究。而目前许多研究表明,EMT是胃癌侵袭转移进程中的重要环节,且胃癌脉管侵犯和淋巴转移被认为是胃癌侵袭转移能力的的重要标之一[10]。笔者推测,在胃癌组织中,YAP1通过促进EMT进程参与促进胃癌侵袭转移。
1 材料与方法
1.1 一般资料
收集2015年6月—2016年6月在中南大学湘雅医院胃肠外科进行根治性胃癌手术(D2)患者组织标本共135例,其中男99例,女36例。上述患者术前均未进行化疗、放疗及靶向药物等治疗。术前经胃镜病理检查确诊为胃癌。术中肿块离体后半小时内取明显癌变组织(去除坏死组织)及距离肿瘤>5 cm正常胃黏膜组织作为对照。术后分期参照2018年第8版UICC/AJCC推荐TNM分期标准。术后采取电话随访,患者术后随访>12个月,主要采集患者术后治疗、复发及生存状态等相关情况,术后患者复发以影像学依据为主。
1.2 试剂
兔抗人E-cadherin(3195S)单克隆抗体购置于美国Cell Signaling Technology公司,YAP1(abs115219)、N-cadherin(abs109031)购置于中国上海爱必信生物科技有限公司(YAP1稀释浓度1:200),免疫组化试剂盒(SP法)购置于北京中杉金桥公司。
1.3 胃癌组织芯片制作
将胃癌/癌旁组织常规脱水后包埋,切片后行HE染色。经2名病理科医师镜下诊断为胃癌并标记癌组/正常黏膜部位。取2 mm孔径穿刺针垂直穿入癌组/正常黏膜对应石蜡块。按事先标记顺序排列芯片石蜡组织,再次包埋(注意黏膜面/肿瘤面朝切面)。切片后再次HE染色明确取样部位。
1.4 免疫组化
将组织芯片石蜡切片(0.4 mm),经过烤片→二甲苯→梯度酒精→双氧水(3%)→柠檬酸钠→一抗孵育过夜(抗体稀释浓度YAP1 1:200;E-cadherin 1:500;N-cadherin 1:500)→二抗孵育→生物素孵育→DAB显色→苏木素染核→盐酸酒精反蓝→封片。将染色后玻片全景扫描,采用CaseViewer系统分别取×5、×10、×200、×400截图后检测免疫组化染色强度。
1.5 结果判读
YAP1表达在细胞质和细胞核,N-cadherin表达于细胞膜和细胞质,E-cadherin表达于细胞膜、细胞质和细胞核。结果判读:200倍镜下胃癌细胞YAP1染色面积/总面积:0~25%为1,26~50%为2,51~75%为3,>75%为4;染色强度:未染色及淡黄色为1,黄色为2,棕黄色为3,再将染色面积×染色强度所得积分组成半定量结果。总积分<7分为阴性表达(-),>7为阳性表达(+)[11]。N-cadherin[12]、E-cadherin[13]依据染色强度评估:无(0),淡黄色(+),黄色(++)棕黄色(+++),细胞膜染色(+++)。
1.6 统计学处理
采用SPSS 18.0统计学软件,所得数据进行统计学分析,其中计数资料显著性比较采用χ2检验分析,计量资料、等级资料比较采用t检验分析,以P<0.05作为差异有统计学意义。采用Spearman法进行相关性分析。
2 结 果
2.1 YAP1、E-cadherin以及N-cadherin在胃癌组织及正常胃黏膜组织中表达
YAP1在癌组织中表达总体呈黄色或棕黄色,染色均一,部分细胞核染色。在正常胃黏膜组织中表达呈淡黄色或黄色,表达不均一,自基底膜至游离缘胃黏膜细胞中免疫组化染色逐层变淡。癌组织中YAP1染色积分明显高于癌旁黏膜组织(P<0.0001)(图1)(表1)。

图1 47例胃癌/癌旁胃黏膜组织芯片YAP1染色及局部不同放大倍数图(×5,×400)Figure1 Images of immunohistochemical staining for YAP1 in tissue microarray containing 47 cases of gastric cancer/adjacent tissue and local regions with different magnif i cations (×5, ×400)

表1 YAP1在135例胃癌/癌旁组织中表达评分(n)Table 1 Immunohistochemical scores of YAP1 in the 135 cases of gastric cancer/adjacent gastric mucoca (n)
E-cadherin在胃癌组织中表达呈黄色或淡黄色,在癌旁黏膜组织中表达呈棕黄色,且细胞膜呈强阳性,E-cadherin胃癌中阳性表达显著低于癌旁组织表达(P<0.01);N-cadherin在胃癌中表达呈棕黄色和黄色,在癌旁黏膜组织中呈现黄色或淡黄色,或阴性表达,且自基底膜至游离缘胃黏膜细胞中免疫组化染色逐层变淡,N-cadherin胃癌中阳性表达与癌旁组织表达差异无统计学意义(P>0.05)(图2)(表2)。

图2 免疫组化检测E-cadherin与N-cadherin表达 A-B:分别为芯片中胃癌组织与癌旁组织E-cadherin表达(×5);C-D:分别为芯片中胃癌组织与癌旁组织N-cadherin表达(×5);E-H:局部高倍图(×400)Figure 2 Immunohistochemical staining for E-cadherin and N-cadherin expressions A–B: E-cadherin expressions in tissue microarray with gastric cancer and adjacent tissues (×5); C–D: N-cadherin expressions in tissue microarray with gastric cancer and adjacent tissues(×5); E–H: High magnif i cation images of local regions (×400)

表2 E-cadherin和N-cadherin在135例胃癌/癌旁组织中的表达(n)Table 2 The expressions of E-cadherin and N-cadherin in 135 cases of gastric cancer/adjacent gastric tissues(n)
2.2 YAP1与E-cadherin、N-cadherin在胃癌组织中表达的相关性
根据免疫组化染色结果,YAP1、E-cadherin和N-cadherin均为等级资料。经Spearman相关性检验,在胃癌组织中,YAP1与E-cadherin表达呈负相关(r=-0.273,P=0.032),YAP1与N-cadherin表达呈正相关(r=0.304,P=0.019)。
2.3 YAP1与胃癌患者临床病理学因素间相关性分析
统计胃癌组织芯片中YAP1的免疫组化表达结果,分别分析其与患者临床病理因素之间的关系,发现YAP1的表达与淋巴结转移、TNM分期以及神经、脉管侵犯存在统计学差异。但是,YAP1表达与患者的年龄、性别、肿瘤大小、分化程度、浸润深度、区域淋巴结转移数目无明显关系(均P>0.05)(表3)。
2.4 YAP1表达与胃癌患者预后的关系
用Kaplan-Meier生存分析方法描述YAP1的表达对胃癌患者1年内生存情况的影响,所观测结局为出现以影像学为依据出现复发或因肿瘤复发导致死亡,发现YAP1阳性表达组的总的生存率明显低于阴性表达组,差异有统计学意义(χ2=4.354,P=0.037)(图3)。

表3 YAP1表达与胃癌患者临床病理因素间的关系[n(%)]Table 3 Relations of YAP1 expression with clinicopathologic variables of gastric cancer patients [n (%)]
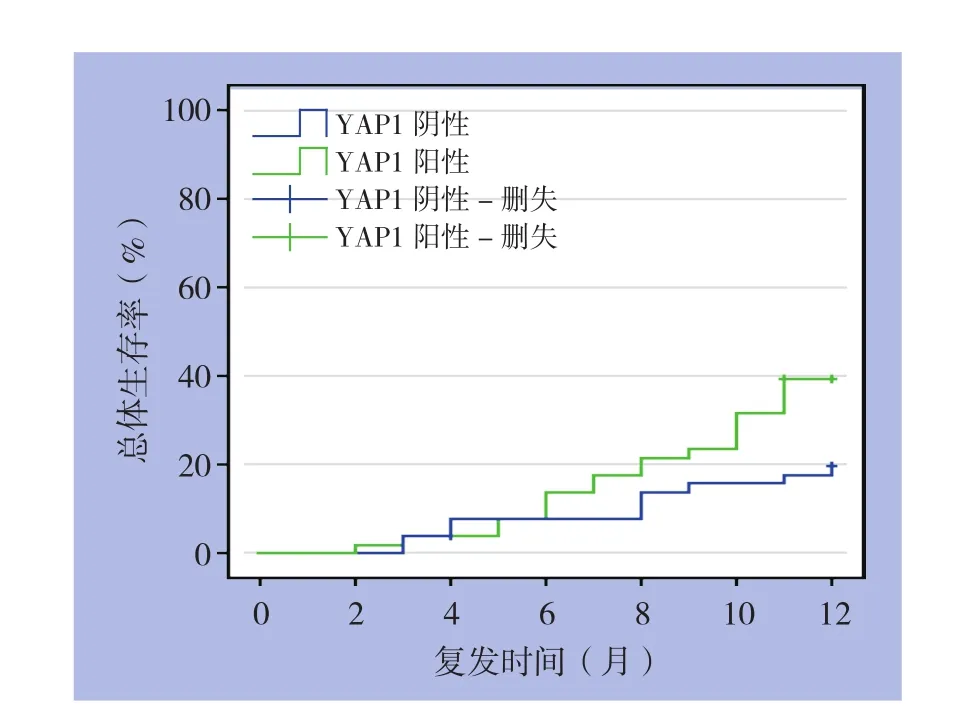
图3 YAP1阳性与阴性患者生存曲线Figure 3 Survival curves of patients with positive and negative YAP1 expression
3 讨 论
胃癌依然是一个世界性的公共卫生问题,尤其是在亚洲。在过去的10年里,胃癌的治疗模式已发生了很大变化[14],但胃癌致死率仍然极高,是中国发病率和病死率都居前三的肿瘤[15],其原因可能是胃癌患者早期症状不明显,又缺乏敏感的早期诊断标记物,导致许多患者就诊时已并非早期,尽管目前胃癌诊疗技术有了较大突破,但各项研究显示进展期胃癌患者5年生存率并未得到显著提高,因此研究胃癌的发生、发展及侵袭转移等分子机制,具有重要的临床意义。YAP1作为Hippo信号通路的关键信号分子,广泛表达于哺乳动物各组织器官中,在正常组织中,YAP1受Hippo信号通路其他信号分子如Lats1/2、Mst1/2、Sav1、MOB1/2等调控[16],产生级联放大作用,其中,YAP1入核为Hippo信号通路的关键事件。在YAP1入核后,特异性与TEAD等蛋白结合,共同发挥转录增强子作用,促进DNA的转录[17]。在生理情况下,Hippo信号受多种膜信号调控,YAP1受多种信号分子激活后磷酸化,阻断其入核,减少对核内DNA转录的激动,使组织器官维持原有体积。然而器官在幼年或损伤阶段时,Hippo信号通路受到抑制,从而使YAP1入核增加,促进细胞分裂、增殖。而在最近一系列研究中发现肿瘤组织中YAP1表达增高,特别是在细胞核内高表达,表明YAP1参与肿瘤的发生发展。本文探讨了YAP1在胃癌中的表达情况 ,并探讨其表达与胃癌患者相关临床病理因素及预后的关系。
最近研究[7-8]发现YAP1可通过诱导EMT从而参与肝癌、肺癌侵袭转移,同年,惠慧等[18]也报道在宫颈癌细胞中通过沉默YAP1的表达可以明显抑制HeLa细胞的增殖及侵袭能力,上述研究在一定程度上与本研究结果相符。本研究显示,与正常组织相比,YAP1在胃癌组织中表达较正常组织普遍升高(49.6%vs.25.2%,P=0.000),且细胞核阳性仅出现在癌组织中,考虑其与胃癌肿瘤发生、过度增殖相关。另外本研究发现,与YAP1阴性表达组相比,其阳性表达组淋巴结转移显著增加(58.5%vs.39.0%,P<0.05),淋巴结转移是影响胃癌患者预后的重要因素[19],与此同时,YAP1阳性表达组脉管侵犯显著增加(65.1%vs.38.8%,P<0.05),上述结果表明YAP1可以促进胃癌侵袭和淋巴结转移转,目前认为癌细胞从原发肿瘤部位向淋巴结以及最近和最远的组织和器官播散的能力是恶性肿瘤的基本特征,是导致治疗失败的主要原因[20],而且胃癌组织中神经及脉管侵犯被认为是胃癌侵袭转移能力的的重要标志[10]。因此YAP1可以视为预测淋巴结转移和脉管侵犯的重要辅助诊断分子。另外,本研究通过Kaplan-Meier生存分析显示YAP1阳性表达组生存率明显低于阴性表达组,从而表明YAP1阳性表达患者预后较差。同样国内Li等[21]研究也发现YAP1表达与胃癌预后不良相关。胃癌患者约40%在术后1年内出现复发和转移。因此,YAP1对于胃癌预示不良预后具有重大的临床意义,但本次研究随访期限为术后1年,因此更长时间的追踪随访笔者及其所在的课题组将继续随访。
EMT是胚胎发育和组织修复的重要机制,但目前研究发现,EMT也有助于疾病的进展,特别的最近研究证实EMT在多种肿瘤的发生发展中其关键作用,同样YAP1与EMT相关性令人瞩目,多项研究表明在胶质瘤[22]、前列腺癌[23]、结直肠癌[24]中YAP1通过介导EMT促进肿瘤的增殖侵袭和转移。EMT相关信号分子包括E-cadherin、N-cadherin、β-catenin、vimentin、snail等,其中E-cadherin与EMT呈负相关,余信号分子均与EMT呈正相关。EMT多发生于原位肿瘤中,而在转移癌中,多呈现MET状态,即间质样肿瘤细胞向上皮样细胞转换。在本研究中,通过Spearman相关性检验分析YAP1与E-cadherin及N-cadherin在胃癌中表达的相关性,发现YAP1在胃癌组织中的表达与E-cadherin表达呈负相关(r=-0.273,P=0.032),与N-cadherin表达呈正相关(r=0.304,P=0.019),提示YAP1可能参与胃癌EMT进程,从而与胃癌侵袭转移密切相关。E-cadherin在胃癌组织中表达低于癌旁正常组织(P<0.05),进一步证实,E-cadherin与肿瘤EMT发生呈负相关。但在本研究中N-cadherin在胃癌组织和癌旁组织中表达差异无统计学意义,考虑需进一步扩大样本量进一步确认。
目前,国内外已有大量基础研究证明YAP1与恶性肿瘤的发生、发展密切相关,但目前对于YAP1与胃癌的相关性的研究并不多见,本研究通过免疫组化分析初步探讨YAP1与胃癌临床病理相关因素及其预后的关系,具有一定的创新性。综上所述,YAP1在胃癌中表达上调,提示其与胃癌的发生发展相关,并通过促进EMT进程在胃癌侵袭转移过程中起重要作用。特别是,YAP1表达上调与胃癌术后患者早期复发呈正相关,因此,提示YAP1的表达对胃癌患者早期预后的判定具有一定的临床指导作用。
[1]Chen W, Zheng R, Baade PD, et al. Cancer statistics in china,2015[J]. CA Cancer J Clin, 2016, 66(2):115-132. di: 10.3322/caac.21338.
[2]Chen W, Zheng R, Zuo T, et al. National cancer incidence and mortality in China, 2012[J]. Chin J Cancer Res, 2016, 28(1):1-11.doi: 10.3978/j.issn.1000-9604.2016.02.08.
[3]Tsai JH, Yang J. Epithelial-mesenchymal plasticity in carcinoma metastasis[J]. Genes Dev, 2013, 27(20):2192-2206.
[4]Harvey K, Tapon N. The Salvador-Warts-Hippo pathway–an emerging tumour- suppressor network[J]Nat Rev Cancer, 2007,7(3):182-191.
[5]Cottini F, Hideshima T, Xu C, et al. Rescue of Hippo coactivator YAP1 triggers DNA damage-induced apoptosis in hematological cancers[J]. Nat Med, 2014, 20(6):599-606. doi: 10.1038/nm.3562.
[6]Chen Q, Zhang N, Xie R, et al. Homeostatic control of Hippo signaling activity revealed by an endogenous activating mutation in YAP[J]. Genes Dev, 2015, 29(12):1285-1297. doi: 10.1101/gad.264234.115.
[7]Zhang L, Yu Z, Xian Y, et al. microRNA-497 inhibits cell proliferation and induces apoptosis by targeting YAP1 in human hepatocellular carcinoma[J]. FEBS Open Bio, 2016, 6(2):155-164.doi: 10.1002/2211-5463.12032.
[8]Xiao L, Zhou H, Li XP, et al. MicroRNA-138 acts as a tumor suppressor in non small cell lung cancer via targeting YAP1[J]. Oncotarget, 2016, 7(26):40038-40046. doi: 10.18632/oncotarget.9480.
[9]Pan Y, Robertson G, Pedersen L, et al. miR-509-3p is clinically significant and strongly attenuates cellular migration and multicellular spheroids in ovarian cancer[J]. Oncotarget, 2016,7(18):25930-25948. doi: 10.18632/oncotarget.8412.
[10]Park JM, Lee HJ, Yoo JH, et al. Overview of gastrointestinal cancer prevention in Asia[J]. Best Pract Res Clin Gastroenterol, 2015,29(6):855-867. doi: 10.1016/j.bpg.2015.09.008.
[11]Zhao X, Gao S, Ren H, et al. Hypoxia-inducible factor-1 promotes pancreatic ductal adenocarcinoma invasion and metastasis by activating transcription of the actin-bundling protein fascin[J].Cancer Res, 2014, 74(9):2455-2464. doi: 10.1158/0008-5472.CAN-13-3009.
[12]Da C, Wu K, Yue C, et al. N-cadherin promotes thyroid tumorigenesis through modulating major signaling pathways[J].Oncotarget, 2017, 8(5):8131-8142. doi: 10.18632/oncotarget.14101.
[13]Bozzi F, Brich S, Dagrada GP, et al. Epithelioid peritoneal mesothelioma: a hybrid phenotype within a mesenchymal-epithelial/epithelial-mesenchymal transition framework[J]. Oncotarget, 2016,7(46):75503-75517. doi: 10.18632/oncotarget.12262.
[14]J i a n g Y X. 多学科方法综合治疗胃癌[J]. 中国普通外科杂志, 2015, 24(10):1354-1355. doi:10.3978/j.issn.1005-6947.2015.10.002.Jiang YX. Multidisciplinary approach for the treatment of gastric cancer[J]. Chinese Journal of General Surgery, 2015, 24(10):1354-1355. doi:10.3978/j.issn.1005-6947.2015.10.002.
[15]陈万青, 张思维, 曾红梅, 等. 中国2010年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014, 23(1):1-10. doi:10.11735/j.issn.1004-0242.2014.01.A001.Chen WQ, Zhang SW, Zeng HM, et al. Report of Cancer Incidence and Mortality in China, 2010[J]. China Cancer, 2014, 23(1):1-10.doi:10.11735/j.issn.1004-0242.2014.01.A001.
[16]Pan D. The hippo signaling pathway in development and cancer[J].Dev Cell, 2010, 19(4):491-505. doi: 10.1016/j.devcel.2010.09.011.
[17]Yamamoto M, Ohsawa S, Kunimasa K, et al. The ligand Sas and its receptor PTP10D drive tumour-suppressive cell competition[J].Nature, 2017, 542(7640):246-250. doi: 10.1038/nature21033.
[18]惠慧, 吴磊, 胡艳, 等. siRNA 沉默 YAP1对宫颈癌 Hela 细胞增殖和侵袭的影响[J]. 现代肿瘤医学, 2016, 24(2):177-180.doi:10.3969/j.issn.1672-4992.2016.02.002.Hui H, Wu L, Hu Y, et al. Effect of YAP1 expression down -regulated by siRNA interference on cell proliferation and invasion of human cervical cancer Hela cells[J]. Journal of Modern Oncology,2016, 24(2):177-180. doi:10.3969/j.issn.1672-4992.2016.02.002.
[19]欧阳喜, 郝腾飞. 胃癌淋巴结微转移的研究进展[J]. 中国普通外科杂志, 2015, 24(4):589-592. doi:10.3978/j.issn.1005-6947.2015.04.023.Ouyang X, Hao TF. Lymph node micrometastasis in gastric cancer:research advances[J]. Chinese Journal of General Surgery, 2015,24(4):589-592. doi:10.3978/j.issn.1005-6947.2015.04.023.
[20]Hu X, Xin Y, Xiao Y, et al. Overexpression of YAP1 is correlated with progression, metastasis and poor prognosis in patients with gastric carcinoma[J]. Pathol Oncol Res, 2014, 20(4):805-811. doi:10.1007/s12253-014-9757-y.
[21]Li P, Sun D, Li X, et al. Elevated expression of Nodal and YAP1 is associated with poor prognosis of gastric adenocarcinoma[J].J Cancer Res Clin Oncol, 2016, 142(8):1765-1773. doi: 10.1007/s00432-016-2188-2.
[22]Lu J, Yang Y, Guo G, et al. IKBKE regulates cell proliferation and epithelial-mesenchymal transition of human malignant glioma via the Hippo pathway[J]. Oncotarget, 2017, 8(30):49502-49514. doi:10.18632/oncotarget.17738.
[23]Liu CY, Yu T, Huang Y, et al. ETS (E26 transformation-specific)up-regulation of the transcriptional co-activator TAZ promotes cell migration and metastasis in prostate cancer[J]. J Biol Chem, 2017,292(22):9420-9430. doi: 10.1074/jbc.M117.783787.
[24]Sun M, Song H, Wang S, et al. Integrated analysis identifies microRNA-195 as a suppressor of Hippo-YAP pathway in colorectal cancer[J]. J Hematol Oncol, 2017, 10(1):79. doi: 10.1186/s13045-017-0445-8.
