IVB期结直肠癌患者原发灶切除的临床意义:基于SEER数据库的倾向得分匹配分析
2018-05-07鲁伟群刘海鹰
鲁伟群,刘海鹰
(广州医科大学附属肿瘤医院 胃肠肿瘤外科,广东 广州 510095)
目前,结直肠癌在全球癌症致死病因中位居前列[1],我国也是高发地区之一。据统计,我国结直肠癌发病率为33.13例/万,发病率位居第四,病死率位居第五[2-3]。在初次就诊时已有20%~30%肠癌患者伴有肝转移、肺转移、锁骨上淋巴结转移等远处转移;对于远处转移灶不能切除的患者,其原发灶的处理问题多数采取以化疗为主的非手术治疗[4],但目前有不少研究尝试探索切除原发病灶的价值,但其作用和地位仍存在很大争论,需要进一步、大样本量的研究证实。
SEER(surveillance epidemiology and end results,SEER,https://seer.cancer.gov)由美国国立癌症研究所于上世纪70年代所建立,是北美最具代表性的大型肿瘤登记注册数据库之一,收集了大量循证医学的相关数据,覆盖了美国约28%的癌症患者数据资料,为临床研究和临床决策提供重要的数据支撑。由于SEER纳入多个癌症登记中心数据,数据存在一定不均衡性,为平衡各组间基线特征差异,本研究拟收集SEER数据库中IVB期结直肠癌患者临床病理和预后数据,通过倾向得分匹配(propensity score matching,PSM)方法匹配各组间差异,比较接受手术切除原发灶是否改善晚期结直肠癌患者生存期。
1 资料与方法
1.1 资料来源
通过SEER*Stat v8.3.4软件提取、筛选SEER数据库中病理确诊为结直肠癌的患者。本研究入排标准如下:⑴ 就诊时间为2010—2013年;⑵ 随访信息完整;⑶ 依据第7版UICC/AJCC TNM分期系统对病例进行分期,肿瘤分期为IVB期,即远处转移分布于一个以上的器官/部位或腹膜转移。排除标准如下:⑴ 多源性肿瘤;⑵ 原位癌;⑶ 肿瘤类型、分化程度及分期不完整。本研究收集了符合要求的结直肠癌患者共6 934例。
1.2 治疗
在6 934例患者中,接受全身化疗为主治疗的患者共4 110例(化疗组),接受手术切除原发灶联合全身化疗的患者共2 824例(手术化疗组)。
1.3 统计学处理
应用SPSS 20.0软件包进行统计分析,采用Kaplan-Meier法计算生存率,生存率比较采用Logrank法。P<0.05为差异具有统计学意义。倾向性匹配评分采用R语言v3.4.4的Matchit包实现,校正阈值设定0.2,采用nearest neighbor matching方法匹配两组基线特征差异。
2 结 果
2.1 匹配前两组预后资料比较
结直肠癌患者的中位生存时间为11个月,其中手术化疗组中位生存期14个月,化疗组中位生存期8个月。Kaplan-Meier生存曲线分析显示两组差异具有统计学意义,化疗组患者预后差于手术化疗组患者(HR=1.540,95%CI=1.423~1.667,P<0.001)(图1)。
2.2 匹配前后两组基线资料比较及预后资料
但比较两组基线特征,发现化疗组和手术化疗组两组的性别分布、年龄分布、原发灶部位、病理分化程度、T分期、原发病灶大小、N分期、远处转移情况、CEA水平均具有统计学差异(均P<0.001);为了匹配两组基线特征差异,本研究采用PSM匹配方法平衡两组基线特征偏移,按照1:1比例匹配后共筛选出3 826例患者,化疗组和手术化疗组各1 913例。以此为基础,比较匹配后的两组患者,χ2检验显示两组患者临床病理特征差异均明显缩小(表1)(图2-4)。

图1 匹配前手术化疗组和化疗组患者生存曲线Figure 1 Survival curves of patients in the surgery-chemotherapy group and chemotherapy group before matching

表1 PSM匹配前后化疗组和手术化疗组患者临床病理资料分布特征[n (%)]Table 1 Distribution profiles of the clinicopathologic factors of patients in chemotherapy group and surgery-chemotherapy group before and after PSM macthing [n (%)]

表1 PSM匹配前后化疗组和手术化疗组患者临床病理资料分布特征[n (%)](续)Table 1 Distribution profiles of the clinicopathologic factors of patients in chemotherapy group and surgery-chemotherapy group before and after PSM macthing [n (%)](continued)

图2 手术化疗组和化疗组两组患者PSM匹配前后倾向性评分分布特征Figure 2 Distributions of propensity scores between the surgery-chemotherapy group and chemotherapy group before and after PSM

图3 通过PSM筛选及剔除的患者分布特征Figure 3 Distribution prof i les of fi lter-in and fi lter-out patients after PSM
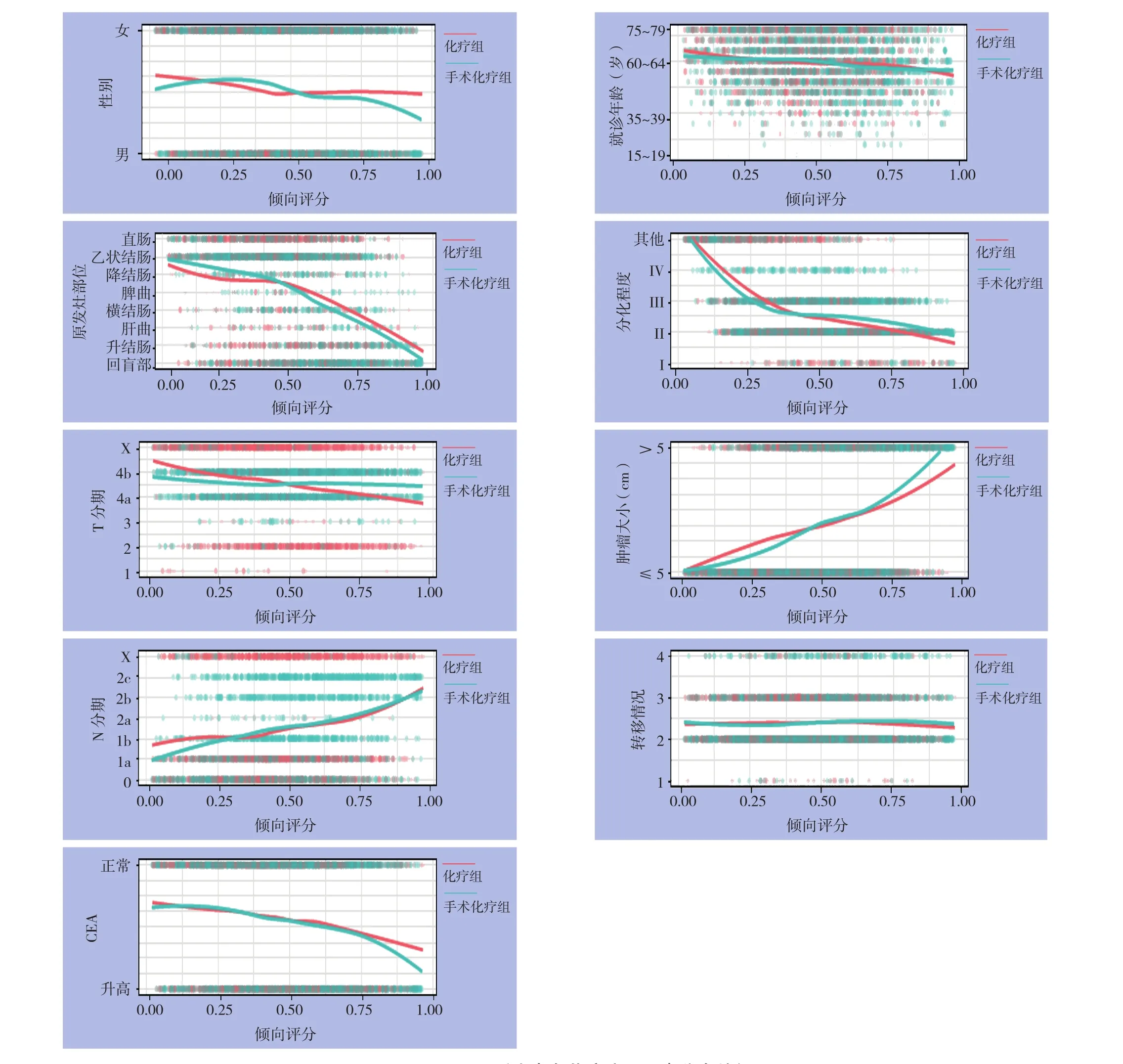
图4 PSM匹配后患者各临床病理因素分布特征Figure 4 Distributions of each clinicopathologic factors of the patients after PSM
2.3 匹配后两组预后资料比较
匹配后化疗组患者中位生存期8个月,手术化疗组患者中位生存期15个月;Kaplan-Meier生存曲线分析显示两组生存差异具有统计学意义,化疗组预后差于手术化疗组(HR=1.603,95%CI=1.439~1.787,P<0.001)(图5)。

图5 匹配后手术化疗组和化疗组两组患者生存曲线Figure 5 Survival curves of patients in the surgery-chemotherapy group and chemotherapy group after matching
3 讨 论
PSM具有一次同时匹配多个因素的特点,最大化的降低混杂偏倚,较亚组分析等分析具有优势,被誉为具有“较好的模拟临床研究”的特点,尤其是在前瞻性临床研究缺乏或临床研究质量不高的情况下,基于PSM后的大样本分析更有参考指导价值[5-7]。在本研究中,通过PSM后,手术化疗组和化疗组两组的临床病理分布特征差异得到明显改善,提高了后续分析研究结论的可靠性。
Poultsides等[8]研究发现233例远处转移的结直肠癌患者在治疗过程中,仅16例(7%)患者因原发灶需要手术干预治疗。基于此,NCCN专家组[9]认为原发灶不切除,并不会导致出现影像生命的并发症,推荐对于梗阻等并发症可以通过放置肛管/支撑管联合放化疗等非手术方法解除梗阻,专家组推荐只有在原发灶存在出血、梗阻或穿孔等风险时,才考虑姑息性手术切除原发灶;2012年欧洲肿瘤内科学会(ESMO)结直肠癌诊疗共识依据患者转移灶和病情发展速度等作出个体化推荐[10],但与NCCN指南有较多相似之处,即对于起始无症状,以系统化疗为主治疗方案,采取“观察等待(watchful waiting)”的策略对患者随诊,仅在出现或存在肿瘤相关症状,采取手术等干预使肿瘤快速消退以缓解症状。与前面两大指南不同,我国结直肠癌肝转移诊断和综合治疗指南(2016版)[11]推荐,原发灶无出血、梗阻或穿孔等风险时,亦可行原发灶切除、全身化疗方案的序贯治疗。指南意见的不一致,也从侧面反映手术治疗IVB期结直肠癌原发灶的价值尚未完全明确。
虽然有数项研究[12-13]发现切除原发灶并不能改善结直肠癌晚期患者预后,并且手术治疗可能延误全身系统化疗。但这样研究样本量较小,证据说服力有限。而更多的研究[14-17],包括基于SEER的研究[18-19]支持本研究的结论,有理由相信,手术切除原发灶的价值得进一步肯定和推广。值得注意的是,SEER数据库样本量大,结论说服力强而受众多临床科学家的关注。回顾上述几篇SEER的研究,发现这些研究基于IV期,并未限定转移灶不可切除的IVB期,另外这些研究纳入研究的病例均位于2010年之前,而近几年新的靶向药和化疗药物、免疫抑制剂等治疗百花齐放[20-21],是否这一结论仍然存在尚无相关报道研究支持,因此开展本研究在当前晚期结直肠癌治疗进展背景下,具有重要的指导价值。本研究结果表明在手术切除原发病灶依然可以提高患者生存期。
对于切除原发灶改善预后的机制,目前尚不明确,但荷兰学者van der Wal等[22]开展了一项很有意义的研究,发现在同时性肝转移患者中,肝转移瘤旁肝组织中新生血管标记物(VEGF-A和VEGFR-1表达及Ang-2/Ang-1率)均较无原发灶的异时性肝转移瘤旁的肝组织更高,表明原发灶的存在诱导瘤旁的肝组织提供肿瘤侵袭、进展所需的新生血管环境。另一方面,腹腔镜辅助手术与机器人辅助手术等手段的开展[23],在保证安全性的前提,提高了手术效率,缩短术后恢复时间,从而使这一部分患者术后尽早的接受全身系统化疗[24-25],相信这些技术将进一步提高患者患者生存率。
尽管本研究纳入的病例数较大,但本研究仍存在一定的缺陷:比如其他特征一般体力情况、KRAS突变、化疗疗程、接受靶向治疗情况、疾病无进展时间等数据无法从SEER数据库中获取。在本研究中,虽然通过PSM匹配了大部分临床病理资料偏移问题,但仍有病理分化程度等变量无法得到匹配,受限于在化疗组部分资料无法完全准确获取,但这些变量的偏移已经通过PSM匹配得到部分改善。因此,需要前瞻性、多中心、大样本量临床研究的高级别循证医学证据来证实原发灶切除的治疗价值。庆幸的是,正在开展的PRODIGE 30等多中心临床研究的开展有助于进一步解答这个问题。
简而言之,基于SEER数据库的回顾性研究提示,切除原发灶可以提高IVB期结直肠癌患者生存期,对于可耐受手术治疗的患者应积极尝试手术切除原发灶。
[1]Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J].CA Cancer J Clin, 2018, 68(1):7–30. doi: 10.3322/caac.21442.
[2]高婷, 李超, 梁锌, 等. 中国癌症流行的国际比较[J]. 中国肿瘤,2016, 25(6):409–414. doi:10.11735/j.issn.1004–0242.2016.06.A001.Gao T, Li C, Liang X, et al. International Comparison of Cancer Incidence and Mortality in China[J]. China Cancer, 2016,25(6):409–414. doi:10.11735/j.issn.1004–0242.2016.06.A001.
[3]Aarons CB, Mahmoud NN. 现代结直肠癌外科治疗的思考[J]. 中国普通外科杂志, 2015, 24(4):459–466. doi:10.3978/j.issn.1005–6947.2015.04.001.Aarons CB, Mahmoud NN. Current surgical considerations for colorectal cancer[J]. Chinese Journal of General Surgery, 2015,24(4):459–466. doi:10.3978/j.issn.1005–6947.2015.04.001.
[4]Jones RP, Kokudo N, Folprecht G, et al. Colorectal Liver Metastases: A Critical Review of State of the Art[J]. Liver Cancer,2016, 6(1):66–71. doi:10.1159/000449348.
[5]D'Agostino RB Jr. Propensity score methods for bias reduction in the comparison of a treatment to a non-randomized control group[J].Stat Med, 1998, 17(119):2265–2281.
[6]Qiu J, Lu W, Yu N, et al. HabibTM 4X-assisted resection versus clamp-crush resection for hepatocellular carcinoma: a propensity-matching study[J]. Oncotarget, 2017, 8(3):4218–4227.doi:10.18632/oncotarget.13906.
[7]Hwang ES, Wang XF. Value of Propensity Score Matching to Study Surgical Outcomes[J]. Ann Surg, 2017, 265(3): 457–458.doi:10.1097/SLA. 0000000000002125.
[8]Poultsides GA, Servais EL, Saltz LB, et al. Outcome of primary tumor in patients with synchronous stage IV colorectal cancer receiving combination chemotherapy without surgery as initial treatment[J]. J Clin Oncol, 2009, 27(20):3379–3384. doi:10.1200/JCO.2008.20.9817.
[9]Amin MB, Edge S, Greene F, et al. AJCC Cancer Staging Manual[M]. 8th ed. New York: Springer, 2017.
[10]Schmoll HJ, Van Cutsem E, Stein A, et al. ESMO Consensus Guidelines for management of patients with colon and rectal cancer.a personalized approach to clinical decision making[J]. Ann Oncol,2012, 23(10):2479–2516. doi:10.1093/annonc/mds23.
[11]中华医学会外科学分会胃肠外科学组, 中华医学会外科学分会结直肠肛门外科学组, 中国抗癌协会大肠癌专业委员会, 等. 结直肠癌肝转移诊断和综合治疗指南(2016版)[J].中华消化外科杂志, 2016, 15(8):755–767. doi:10.3760/cma.j.issn.1673–9752.2016.08.001.Group of Gastrointestinal Surgery, Society of Surgery, Chinese Medical Association, Group of Colorectal & Anal Surgery, Society of Surgery, Chinese Medical Association, Colorectal Cancer Committee of Chinese Anti-cancer Association, et al. Guideline for the diagnosis and comprehensive treatment of colorectal cancer with liver metastases(2016 edition)[J]. Chinese Journal of Dignestive Surgery, 2016, 15(8):755–767. doi: 10.3760/cma.j.issn.1673–9752.2016.08.001
[12]Cirocchi R, Trastulli S, Abraha I, et al. Non-resection versus resection for an asymptomatic primary tumour in patients with unresectable stage IV colorectalcancer[J]. Cochrane Database Syst Rev, 2012, (8):CD008997. doi:10.1002/14651858.CD008997.
[13]Boselli C, Renzi C, Gemini A, et al. Surgery in asymptomatic patients with colorectal cancer and unresectable liver metastases:the authors' experience [J]. Onco Targets Ther, 2013, 6:267–272.doi: 10.2147/OTT.S39448.
[14]Kim MS, Chung M, Ahn JB, et al. Clinical signif i cance of primary tumor resection in colorectal cancer patients with synchronous unresectable metastasis[J]. J Surg Oncol, 2014, 110(2):214–221.doi:10.1002/jso.23607.
[15]Faron M, Pignon JP, Malka D, et al. Is primary tumour resection associated with survival improvement in patients with colorectal cancer and unresectable synchronous metastases? A pooled analysis of individual data from four randomised trials[J]. Eur J Cancer,2015, 51(2):166–176. doi: 10.1016/j.ejca.2014.10.023.
[16]Ishihara S, Hayama T, Yamada H, et al. Prognostic impact of primary tumor resection and lymph node dissection in stage IV colorectal cancer with unresectable metastasis: a propensity score analysis in a multicenter retrospective study[J]. Ann SurgOncol,2014, 21(9):2949–2955. doi:10.1245/s10434–014–3719–1.
[17]Clancy C, Burke JP, Barry M, et al. A meta-analysis to determine the effect of primary tumor resection for stage IV colorectal cancer with unresectable metastases on patient survival[J]. Ann SurgOncol,2014, 21(12):3900–3908. doi:10.1245/s10434–014–3805–4.
[18]Tarantino I, Warschkow R, Worni M, et al. Prognostic Relevance of Palliative Primary Tumor Removal in 37,793 Metastatic Colorectal Cancer Patients: A Population-Based, Propensity Score-Adjusted Trend Analysis[J]. Ann Surg, 2015, 262(1):112–120. doi:10.1097/SLA.0000000000000860.
[19]Cook AD, Single R, McCahill LE. Surgical resection of primary tumors in patients who present with stage IV colorectal cancer: an analysis of surveillance, epidemiology, and end results data, 1988 to 2000[J]. Ann Surg Oncol, 2005, 12(8):637–645. doi:10.1245/ASO.2005.06.012.
[20]Fakih MG. Metastatic colorectal cancer: current state and future directions[J]. J Clin Oncol, 2015, 33(16):1809–1824. doi:10.1200/JCO.2014.59.7633.
[21]Van Cutsem E, Kohne CH, Hitre E, et al. Cetuximab and chemotherapy as initialtreatment formetastatic colorectal cancer[J]. N Engl J Med, 2009, 360(14):1408–1417. doi:10.1056/NEJMoa0805019.
[22]van der Wal GE, Gouw AS, Kamps JA, et al. Angiogenesis in synchronous and metachronous colorectal liver metastases: the liver as a permissive soil[J]. Ann Surg, 2012, 255(1):86–94. doi:10.1097/SLA.0b013e318238346a.
[23]解龙, 樊启明, 郭磊, 等. 机器人辅助与腹腔镜结直肠癌手术疗效比较的Meta分析[J]. 中国普通外科杂志, 2016, 25(10):1412–1419.doi: 10.3978/j.issn. 1005–6947. 2016.10.008.Xie L, Fan QM, Guo L, et al. Robotic assisted versus laparoscopic colorectal cancer resection: a Meta analysis [J]. Chinese Journal of General Surgery, 2016, 25(10):1412–1419. doi:10.3978/j.issn.1005–6947.2016.10.008.
[24]Sun Z, Adam MA, Kim J, et al. Determining the optimal timing for initiation of adjuvant chemotherapy after resection for stage II and III colon cancer[J]. Dis Colon Rectum, 2016, 59(2):87–93.doi:10.1097/DCR.0000000000000518.
[25]Bos AC, van Erning FN, van Gestel YR, et al. Timing of adjuvant chemotherapy and its relation to survival among patients with stage III colon cancer[J]. Eur J Cancer, 2015, 51(17):2553–2561. doi:10.1016/j.ejca.2015.08.016.
