从《药品不良反应信息通报》分析中药注射剂ADR*
2018-05-05肖隆灏刘莘然
刘 洋 ,肖隆灏 ,刘莘然 ,李 霖 ,张 晗 ,李 楠 ,张 磊
(1.天津中医药大学中医学院,天津 300193;2.天津中医药大学第一附属医院,天津 300193)
《药品不良反应信息通报》(以下简称《通报》)是国家药品不良反应监测中心根据现有资料及时提供的客观信息反映,2001年11月首发,通报制度是我国药监部门保障公众用药安全而建立的一项重要制度,在保障公众健康,有效推动临床合理用药水平的提高发挥了积极作用[1]。
笔者采用回顾性分析法,收集自发布至今共74期《药品不良反应信息通报》(2001年11月—2017年4月),从28 118例涉及不良反应的中药及其制剂有关报道中,摘录20 169例有关中药注射剂致ADR的报道,由中药注射剂引起的不良反应例数占到总中药ADR报道数的71.6%,本文将从药品种类、临床表现、发生年份和引发原因等方面进行统计整理,旨在分析中药注射剂导致ADR的发生规律,以保障临床安全用药。
1 中药注射剂致ADR的一般情况
《通报》中共涉及38种中药及其制剂的不良反应报道,其中有关中药注射剂ADR的报告共计16种,占中药制剂总品种数的42.1%,中药注射剂致ADR主要表现为全身性损害、呼吸系统损害,过敏反应、皮肤及其附件损害、心血管系统损害、泌尿系统、神经系统、消化系统等。具体品种情况和不良反应报告例数见表1。
2 中药注射剂致ADR发生的年份
中药注射剂在《通报》中报道发生的年份,虽主要出现在2001—2006年和2009—2013年,但中药注射剂ADR的品种数,基本呈均匀分布,没有集中出现的年份,其中,除2012年有4种中药注射剂致ADR被报道外,其余每年的报道种类均为1~3种。见表2。
3 累及的系统-器官及临床表现
中药注射剂所致不良反应累及多个系统-器官,主要表现为全身性损害和呼吸系统损害,分别占47.7%和26.3%,其他的不良反应主要包括过敏反应、皮肤及其附件损害、心血管系统损害、泌尿系统、神经系统、消化系统等。由于部分《通报》涉及品种并未明确提及各系统损害的具体例数,本文仅就《通报》提及的例数进行统计,见表3。
4 中药注射剂不良反应致死亡的情况
《通报》中共报道17例关于中药注射剂不良反应致死亡的情况,表现为血管内溶血、过敏性休克和呼吸困难。见表4。这些死亡案例集中出现于2001、2002和2006年,即处于《通报》报道年份(2001—2017年)的前期,其中中药注射剂使用限制是否严格、医疗水平能否提供完善有效的急救措施,都可能是导致致死亡案例发生的相关因素。
5 ADR与用药剂量情况
经过分析《通报》中报道的病例后发现,在目前临床治疗上存在很多不合理使用中药注射剂的医疗现象,以《通报》第52期中红花注射液为例,其不良反应/事件报告分析显示,该品种在临床上存在超剂量用药,严重病例中涉及超量用药者占17.19%[2]。

表1 《通报》涉及的中药注射剂品种
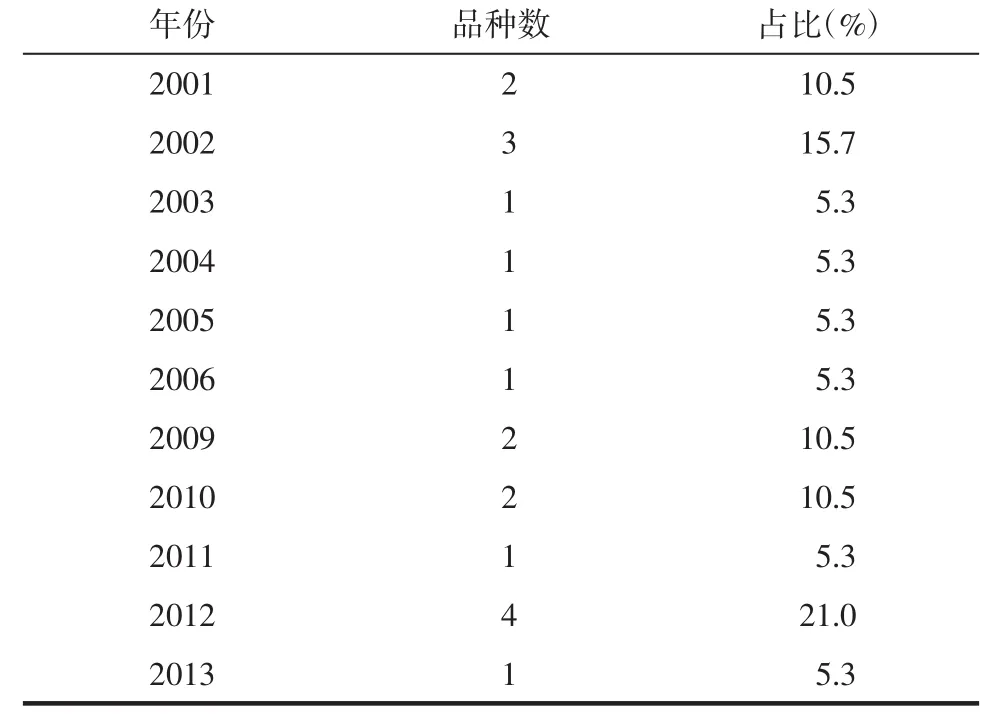
表2 中药注射剂在《通报》中出现的年份
6 讨论
6.1 ADR与患者个体因素 患者个体因素包括特殊体质如过敏史、家族史、用药史等,包括特殊人群如儿童,老人,妊娠、哺乳期妇女等。其中,出现ADR的患者与其年龄有着密切的关系,不良反应主要集中发生在儿童和中老年人群,这可能是由儿童正处于生长发育的阶段,各脏腑器官还没有发育完全,对药物的代谢能力较弱所导致;而中老年人的基础疾病则较多,生理功能逐步衰减,对药物代谢的能力也同样较弱,因而中药注射剂的不良反应在中老年人群中发生的概率也较高。
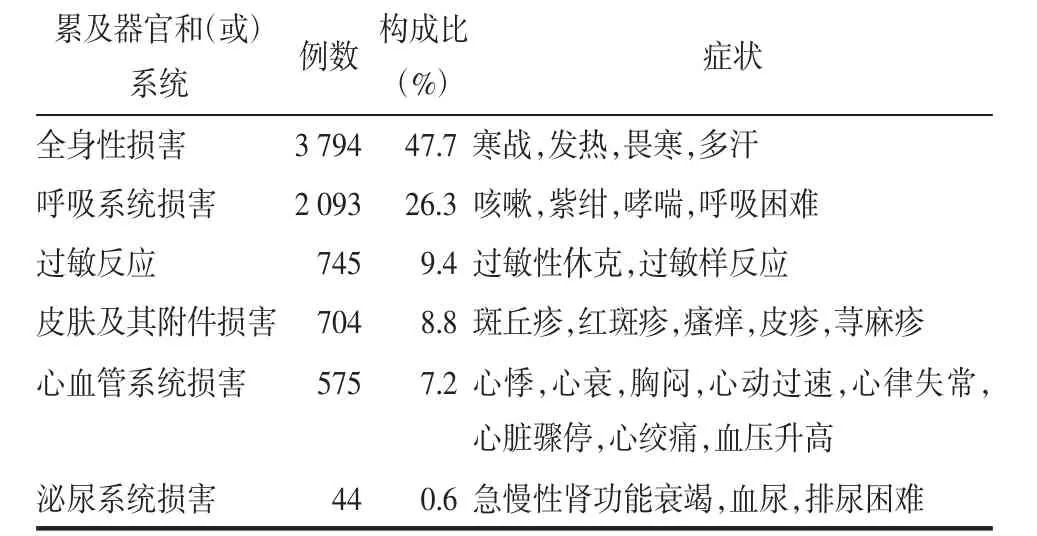
表3 中药注射剂累计累及器官和(或)系统的分布
所以,临床上为减少中药注射剂导致ADR的发生,在用药时应更加密切观测儿童和中老年患者的使用情况,以防止不良反应的发生。
6.2 ADR与剂型的关系 与中成药、中药颗粒剂相比,中药注射剂具有起效快的优势;而与西药相比,中药多组分多靶点作用特点,对治疗各种复杂疾病具有独特的优势,在近几年的发展中呈现出高度集中的趋势。中药注射剂已成为中药行业中市场份额所占比例最大的剂型,它被视为中药现代化的标志,但也存在着不可忽视的矛盾。中药注射剂成分复杂是其致ADR的首要原因,部分中药注射剂的制作工艺仅仅是简单的醇提或者水提,部分杂质和过敏原尚未分离,容易导致过敏反应的发生;除此以外,注射剂原料中药的质量不稳定也是不可轻视的原因,产地、季节和炮制工艺的差异,往往导致注射剂成分的不稳定;中药材种植中的农药残留等因素也应被纳入考虑。
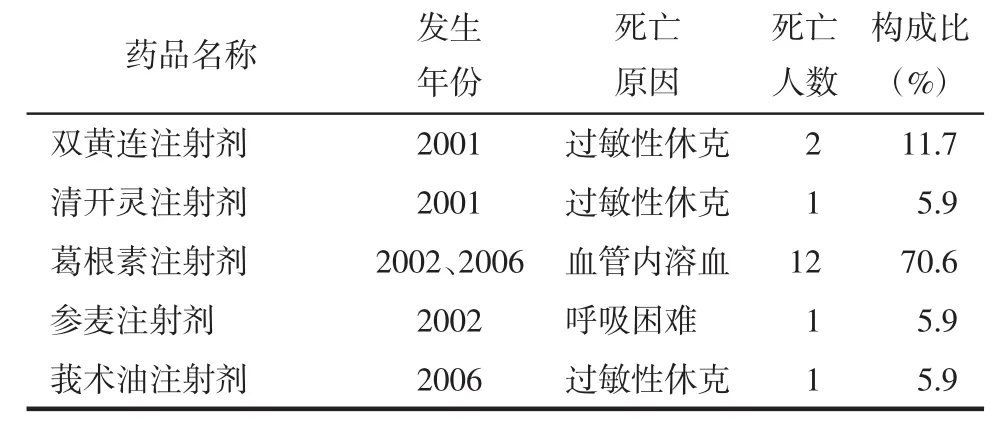
表4 中药注射剂不良反应致死亡情况
6.3 中药注射剂致ADR的临床表现分析 药品不良反应的定义为——合格药品在正常用法用量下出现的与用药目的无关或意外的有害反应[3]。该定义排除了治疗失败、药物过量、药物滥用、不依从用药和用药差错的情况。是伴随正常药物治疗的一种风险。因此临床上不合理使用中药注射剂的现象,属于药品不良事件或者药害。
在临床使用中药注射剂后出现不良事件或不良反应的原因,一方面应考虑药不对症,用药不合理、超剂量或超适应证使用,与不良事件的发生具有正相关性。另一方面,在临床使用中药注射剂中,中药西用,不辨证等中医学属性的缺失,缺乏中药注射剂中医证候关联性的循证依据,也应是重要因素之一[4]。因此要求医务人员,要确保用药时严格按说明书的规定用药,充分掌握中药注射剂的适应范围,最大限度地避免或者降低发生不良事件或ADR的可能。另一方面,患者的自身体质问题也可能是导致不良反应发生的潜在因素,必须关注患者家族史、过敏史和既往ADR发生史,并且准备好治疗不良反应的急救药品,以保证临床用药安全。
6.4 避免或减少中药注射剂导致ADR的建议
1)在中药注射剂致ADR的案例中,呼吸困难、过敏性休克位居前2位,因此医疗机构在使用中,应缓慢,密切观察患者的反应,特别是用药的前30 min,用药后一旦发现发生不良反应,立即停药并及时救治。
2)在使用中药注射剂给患者进行治疗前,需详细询问患者的过敏史、家族史等情况。对于初次使用中药注射剂的患者一定要告知其可能出现的不良反应,关注特殊使用人群,如孕妇、哺乳期妇女,以及儿童禁用,过敏体质者慎用等。
3)建议单独使用中药注射剂,避免与其他中药注射剂或西药联合用药。如确需联合使用,应谨慎分析考虑药物相互作用等事宜。更重要的是,中药注射剂的临床推广必须加强,要向医务人员传递中药注射剂的治疗价值,建立中药注射剂并非西药的辅助用药的意识,才能从根本上减少滥用、混用对中药注射剂的影响。
4)加强基层医疗机构对严重不良反应如过敏性休克等正确处理的培训,降低死亡等严重后果。在大型的诊疗机构使用中药注射剂出现不良反应的时候,基本可以采取及时的抢救措施,而当基层医疗机构使用时,则易出现不能正确进行抢救的情况,应当对基层医疗机构及其医务人员进行相关培训,能够正确处理出现的紧急情况。同时也应对其使用中药注射剂的业务能力进行相关提升培训,以促进基层用药安全。
5)要求中药注射剂的生产企业完善其说明书的相关内容,扩充对不良反应,尤其是严重不良反应症状的描述。同时开展加强药效物质的基础研究,开发可知成分更明晰的中药注射剂,避免因混入不明物质而导致药物不良反应;其次,药品生产企业需要加强药品生产质量管理,生产制备工艺亟需升级,提高产品质量和有效成分含量,减少鞣质和蛋白等杂质,有效减少导致ADR的出现。
6)加强中药注射剂上市后临床安全性再评价工作。由于ADR的发生与风险控制存在时滞现象[5],因此,对大部分中成而言,上市后临床安全性再评价工作刻不容缓[6]。国家已相继出台相关文件和政策,加强中药注射剂安全性再评价,多个大品种注射剂安全性再评价工作已经开展并被列入了国家科技计划,使得中药注射剂行业标准不断提升,亦提升了中药注射剂的安全使用前景。
7 结语
《通报》确实反映出中药及其制剂尚存在安全性问题,其中,中药注射液导致的不良反应,发生原因尤为复杂,因此,既不能简单认为中药“纯天然、安全无毒”,也不能放大中药的不良反应。更要注意明确不良反应与药害概念的区别。
中药注射剂起效快,作为现代新剂型,在急重症病等的防治中有不可替代的作用。随着企业对中药注射剂研发的倾斜投入,以及国家与地方各项优惠政策的大力支持,中药注射剂的市场份额必将持续增加,治疗的疾病范围也将更为广泛,其中脑血管疾病和肿瘤类病症用药中,市场份额前10的品种,中药注射剂品种均占了7个,从长期来看,规范的中药注射剂市场依然能持续高速发展[7]。在这样的形势下,关注中药注射剂的临床安全性,尤其具有现实意义。
在临床应用中,一方面,医务工作者需对中药注射液的相关信息高度注意并提高警惕。另一方面,生产企业与科研工作者需结合临床积极开展中药注射剂再评价工作,这其中要注重三点:第一是有效性,证据成链,可以是RCT,也可以是实验研究,但一定要保证数据真实;第二是明确临床定位。把药物的功效说清楚,否则,只能治疗疾病的某个阶段,中药将被置于辅助治疗的位置;第三是注重生产过程的质量控制。
从目前的统计数据分析,中药注射剂安全性问题,多数不在于中药注射剂本身的品质,而在于不合理的联合用药,基层用药不规范,这些是现实问题。建议企业在药盒要标明,不能联合用药,并进行大力宣传,尤其是对基层的宣教。
在当前国际范围内日益关注中药的研发与应用的新形势下,我们要详加关注可能发生的中药不良反应、正确认识不良反应,一方面尽力减少中药不良反应的发生,一方面尽量明确其发生的危险因素、以减少引发ADR的可能风险。相关药品管理部门也应当加强药品不良反应的数据监测和实施临床合理用药的相关宣传工作,从而大力推进中医药事业的发展。
参考文献:
[1] 张 冰.中药不良反应与警戒概论[M].北京:中国中医药出版社,2013:57.
[2] 中华人民共和国国家卫生和计划生育委员会.药品不良反应信息通报[R].第52期,2013.
[3] 中华人民共和国国家卫生和计划生育委员会.药品不良反应报告和监测管理办法[Z].2004-3-4.
[4]吴深涛.浅谈中药注射剂与证候关联性——中药注射剂不良反应成因及对策思考[J].天津中医药大学学报,2017,36(5):329-332.
[5] 李廷谦,王 刚,王 蕾.循证医学与中药上市后的再评价[J].中国循证医学杂志,2004,4(4):217-221.
[6] 郑文科,张俊华,商洪才.上市后中成药临床安全性再评价的现状、问题与展望[J].天津中医药大学学报,2017,36(5):333-336.
[7] 吴俊杰.中药注射剂医院市场走势上扬[J].中国处方药,2010,9:52-53.
