复方颠倒凝胶的设计与评价*
2018-05-05林姗姗王佳露国大亮
林姗姗,王佳露,刘 睿,年 莉,国大亮
(天津中医药大学,天津 300193)
痤疮作为一种常见皮肤病不仅影响个人美观,而且可引发心理疾病,因而得到医学界的广泛关注。《医宗金鉴》中的颠倒散治疗痤疮具有较好的疗效[1-4],其药物来源于天然植物和矿物,符合人们对于控制抗生素耐药性和降低药物毒副作用的需求[5]。但散剂在皮肤表面滞留时间短导致药效难以发挥,大量学者对其进行改良均取得了较好的效果[6-9]。现以颠倒散为基础加入黄柏、苦参、芦荟中抗痤疮的有效成分制成药效持久、安全性高且使用方便的复方颠倒凝胶并进行评价,为其治疗痤疮提供理论依据,同时为其他中药外用处方的剂型改制开拓新的思路。
1 实验材料
1.1 实验仪器 PHS-25型酸度计(上海皓庄仪器有限公司),NDJ-79旋转式黏度计(上海平轩科学仪器有限公司),BT125D型分析天平(德国赛得利斯公司),SPD-M20A高效液相色谱仪(日本岛津公司),YB-P6智能透皮实验仪(天津市鑫洲科技有限公司)。
1.2 药材与试剂 大黄总蒽醌(50%,南京朗泽生物科技有限公司),盐酸小檗碱(98%,南京朗泽生物科技有限公司),苦参碱(98%,南京朗泽生物科技有限公司),氧化苦参碱(98%,南京朗泽生物科技有限公司),芦荟提取物(10∶1,南京朗泽生物科技有限公司),升华硫(商丘市亮峰卫生用品有限公司),卡波姆-940(武汉瑞孚因科技发展有限公司),1-2丙二醇(分析纯,天津市富宇精细化工有限公司),甘油、三乙醇胺、氢氧化钠、尿素(均为分析纯,天津市风船化学试剂科技有限公司),蒸馏水(屈臣氏)。
2 复方颠倒凝胶的制备
2.1 凝胶成分的确立 本实验参考文献中的药物组成[9],以颠倒散为基础加入黄柏、苦参、芦荟,明确该5味药物中抗痤疮的有效成分,包括大黄总蒽醌、盐酸小檗碱、苦参碱、氧化苦参碱、芦荟提取物、升华硫。根据中医学中君臣佐使的方剂配伍理论确定中药原材料的比例,通过查阅文献得到所需的每种中药提取物的含量,确立复方颠倒凝胶的组成比例为:大黄总蒽醌∶盐酸小檗碱∶苦参碱∶氧化苦参碱∶芦荟提取物:升华硫=4∶2∶1∶1∶2∶100。
2.2 复方颠倒凝胶单因素考察
2.2.1 凝胶基质的选择 根据不同型号卡波姆的特点及应用范围,本实验最终选用卡波姆-940作为凝胶基质的基本材料。卡波姆-940在皮肤表面粘附性强、涂展性好,可延长药物在皮肤表面滞留时间,增加药物作用,被广泛用于皮肤疾病,并且其能吸收组织渗出液,有利于分泌物的排出,特别适宜治疗脂溢性皮肤病[10]。
2.2.2 凝胶处方胶凝温度的考察 以胶凝处方的胶凝温度和凝胶处方的黏度为指标筛选凝胶基质占处方总量20%、25%和30%的不同凝胶处方(n=3)。参考文献采取[11-12]以下方法进行胶凝温度的测定:分别取凝胶2 mL至玻璃试管中,将试管置于10℃恒温水浴中,其试管内液面低于水面2 cm,平衡10 min。水浴温度采用精度1℃的精密温度计测定,缓慢升温,升温速率为每分钟升高1℃。每升高1℃,取出试管,使试管迅速倾斜45℃,观察内容物流动情况。当试管内液体不流动时的温度即为胶凝温度,见表1。
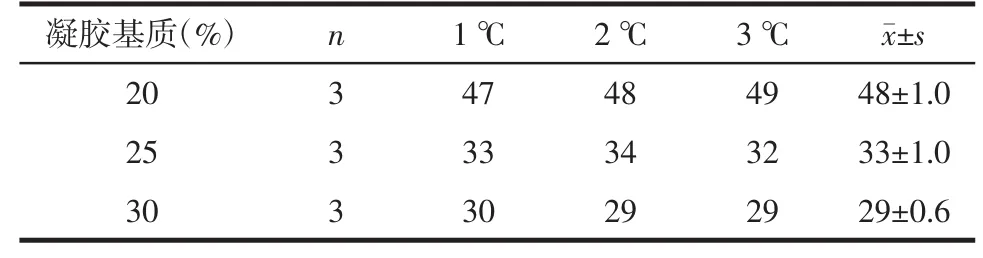
表1 凝胶处方的胶凝温度 ℃
2.2.3 凝胶处方黏度的考察 由于该凝胶呈现高黏度状态,故选择黏度计的第Ⅱ单元测定器、100#转筒,在相同温度条件下(实测室温:33℃)分别对凝胶基质占处方总量20%、25%、30%时的凝胶处方进行凝胶黏度的测定(n=3)。取凝胶约15 mL于测试容器中,直至凝胶达到该容器锥形面下部边缘,安装完成后,起动电机,待指针稳定后读取数据。根据所选的测定器和转筒,计算结果见表2。凝胶黏度值=刻度盘读取的数值×100(因子数)mPa/s
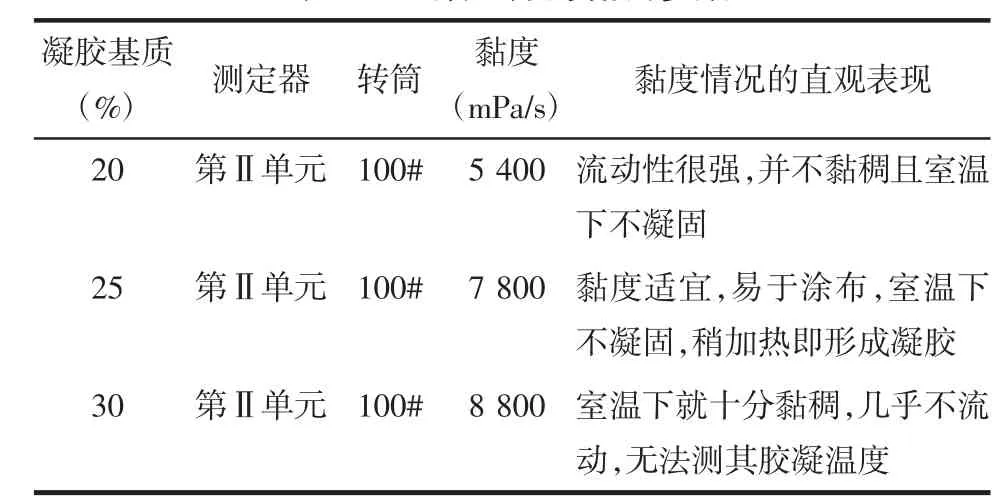
表2 凝胶处方的黏度参数
2.2.4 凝胶单因素考察结果 根据凝胶处方的胶凝温度和黏度的考察结果,确定最优处方为凝胶基质占处方总量的25%,该凝胶处方的胶凝温度为33℃,黏度为 7 800 mPa/s。
2.3 复方颠倒凝胶制备方法 将文献[13]中的制备方法进行改进,取卡波姆-940 10.0 g,加水至250 g,溶胀24 h,水浴加热并搅拌均匀,用三乙醇胺适量调节酸碱度至中性,即为空白凝胶基质;分别精密称取大黄总蒽醌4.0 g、盐酸小檗碱2.0 g、苦参碱1.0 g,氧化苦参碱1.0 g,芦荟提取物2.0 g和升华硫100.0 g,混合均匀,加甘油100.0 g,研磨至均匀细腻,加丙二醇200.0 g,搅拌均匀,即得到药物混悬液;取空白凝胶基质,将药物混悬液加至空白凝胶基质,快速搅拌,加尿素150.0 g,加水至1 000 g,搅拌均匀,即得到复方颠倒凝胶1 000 g。
3 复方颠倒凝胶的药物评价
3.1 外观 表现为金黄色乳胶状半固体,质地均匀细腻,黏稠度适宜,生物相容性及涂展性良好,无油腻感,见图1。

图1 复方颠倒凝胶的外观
3.2 酸碱度 多次精密测量复方颠倒凝胶的pH值,测量方法为:取本品10 g,加入20 mL蒸馏水中进行稀释,将两只电极放入稀释的溶液中,待显示值稳定后即可利用酸度计读取pH值(n=3),结果见表3。
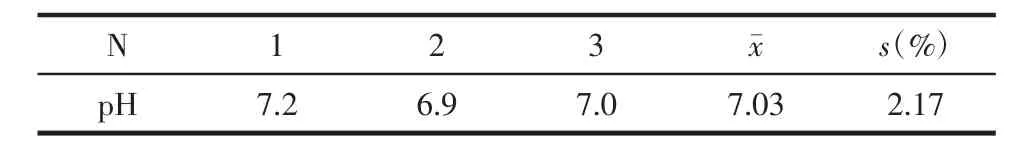
表3 复方颠倒凝胶的pH值
3.3 凝胶黏度的测定 方法同2.2.3,利用黏度计在相同温度条件下(实测室温:33℃)对复方颠倒凝胶的黏度进行测定(n=3),结果见表4。
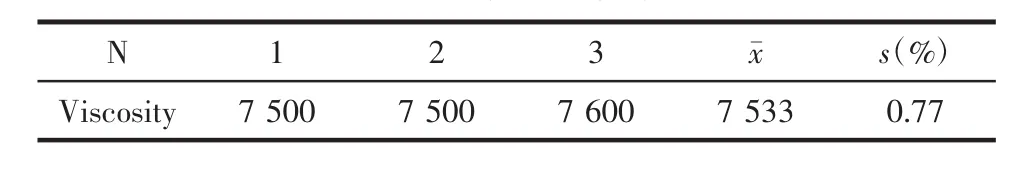
表4 复方颠倒凝胶的黏度
4 盐酸小檗碱体外释放度考察
4.1 色谱条件色谱柱Diamonsil C18(2)(250 mm×4.6 mm,5 μm);柱温:35 ℃;流速:1.0 mL/min;检测波长:350 nm;进样量:10 μL;流动相:乙腈:0.1%的磷酸溶液(20∶80)。
4.2 磷酸盐缓冲液(PBS)的配置 称取磷酸二氢钾(KH2PO4)0.24 g,磷酸氢二钠(Na2HPO4)1.44 g,氯化钠(NaCl)8.0 g,氯化钾(KCl)0.2 g,并加入 1 L 蒸馏水,搅拌使充分溶解,用稀盐酸调节pH,作为等渗溶液。
4.3 标准曲线的绘制 精密称取盐酸小檗碱对照品2.01 mg置于10 mL容量瓶中,加甲醇溶解并稀释至刻度线,得浓度为201 μg/mL的盐酸小檗碱对照品储备液,置4℃的冰箱中保存备用。将盐酸小檗碱对照品储备液以甲醇逐级稀释,得浓度分别为100.50、50.25、25.12、12.56、6.28、3.14、1.57 μg/mL,系列对照品溶液。按照4.1中的色谱条件进样,记录峰面积,以对照品浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,求得直线回归方程 Y=954.57X-1 000.5(r=0.999 3),如图 2 所示。表明浓度在1.57~100.50 μg/mL范围内线性关系良好,符合定量分析要求。
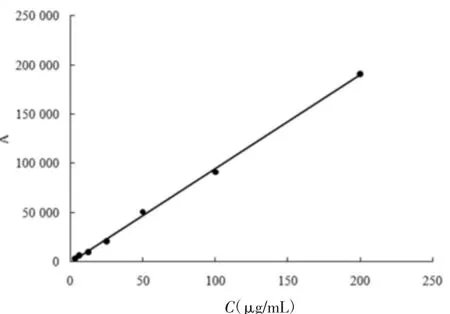
图2 盐酸小檗碱在甲醇中的标准曲线
4.4 体外释放实验
4.4.1 体外释放的考察方法 本实验选择的释放介质为PBS(pH7.8),采用膜透析法[14]考察复方颠倒凝胶的体外释药特性。具体实验步骤为:分别精密称取2.01 mg复方颠倒凝胶置于透析袋中,两端用透析袋夹夹紧,置于含60 mL释放介质PBS的烧杯中,设置磁力搅拌器转速为200 r/min,温度为(35±1)℃。分别于 0.5、1、2、3、4、6、8、10、12、14 h 取样1 mL,同时补加等温同体积的释放介质PBS。用高效液相色谱法(HPLC)测定药物释放量,每个样品进行3次平行实验。
累积释放量(Qn)和累积释放百分率(F%)分别由公式(1)和公式(2)求得:

公式中Qn为各时间点的累积释放量;F%为各时间点的累积释放百分率;t(min)为取样时间点;Cn为第n个取样时间点的实测药物浓度;V0为溶出介质总体积;Vi为每次取样体积;Ci为第i个取样时间点实测药物浓度;C0为总药物浓度。
4.4.2 体外释放的计算方法 体外释放实验结果通过计算测定浓度与初始制剂浓度之比得到药物累积释放百分率。以药物累积释放百分率(%)对取样时间(T)进行拟合,得到盐酸小檗碱和复方颠倒凝胶的体外累积释放率曲线。如图3所示,凝胶的累积释放率在1 h达到25.03%,表明药物前期释放突释,12 h达到90.38%,后期释药完全,说明凝胶中的有效成分能够持续释放,保证药物达到有效的治疗作用。将释放数据进行零级、一级、Higuchi,Hixcon-Crowell,Ritger-Peppas和 Weibull方程拟合并进行回归分析,比较各回归方程的相关系数。所得的拟合方程中以Ritger-Peppas方程的R值最高,R值为0.956 2,说明药物具有良好的缓释作用,如表5所示。

图3 复方颠倒凝胶的体外累积释放率
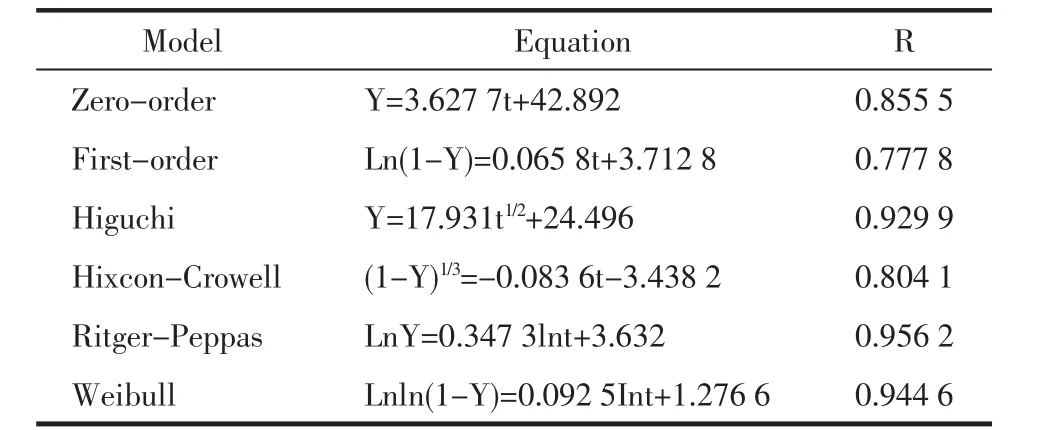
表5 体外释放的拟合方程结果
5 讨论
现代研究表明,大黄中的大黄酸、大黄素、芦荟大黄素、大黄酚、大黄素甲醚等大黄蒽醌类物质对痤疮丙酸杆菌、金黄色葡萄球菌均有较强的抑制作用[15],且具有明显的抗炎作用[16-18];硫磺中的硫易与皮肤作用生成硫化氢和五硫磺酸使表皮软化,具有脱脂、杀菌、止痒及角质促溶作用[19];黄柏中的盐酸小檗碱具有抗病原微生物等作用[20];苦参中的苦参碱和氧化苦参碱对金黄色葡萄杆菌有较强的抑制作用[21-22];芦荟具有抗菌作用,对葡萄球菌最为敏感[23],此外还有调节免疫功能、促进伤口愈合、抗炎以及抗氧化等作用[24],而且它是一种优良的天然保湿剂和皮肤营养剂,具有护肤美容功能。
本课题以中医治疗痤疮的传统有效方剂颠倒散为基础方,加黄柏、苦参、芦荟3味药物中抗痤疮的有效成分组成复方颠倒散。由于传统外用散剂表面积大,容易吸湿、结块和分散,导致散剂在皮肤表面的滞留时间短,不利于药效的发挥[25];且散剂调制麻烦、剂量难以确定、药物浪费大、不便于患者使用等诸多弱点日益突出[26],这些都不适应现代用药的需求,因此散剂的应用有着一定的局限性。凝胶具有良好的缓释作用,使药效持久,可以提高药物的安全性和有效性;凝胶可吸水膨润的特点保证其更好地吸收组织渗出液,促进药物透皮吸收;且使用剂量小,几乎无毒副作用,不妨碍皮肤的正常生理功能[27-28]。故本实验将传统外用散剂改制为凝胶剂。
选取卡波姆-940制成凝胶基质,是考虑到其良好的黏滞性和亲水凝胶性能够使凝胶剂在体外释放中有较好的缓释作用[29],可以产生持久并容易控制的血药浓度,避免峰谷现象的出现,减少用药次数,提高药物的安全性和有效性[30],因此凝胶剂在很大程度上克服了散剂的不足。另外,凝胶在不同温度条件下的黏度对保证其在被使用过程中的患者顺应性和治疗效果起决定作用,是重要的流变学参数,因此对凝胶温度和用量的考察可以保证复方颠倒凝胶常温下呈半固体的状态。
6 结论
本实验制得复方颠倒凝胶的凝胶基质占处方总量的25%,胶凝温度为33℃;其外观为金黄色带乳胶状半固体,pH值为7,凝胶黏度为7 533 mPa/s;体外释放实验中,复方颠倒凝胶在12 h释放率达到90.38%,符合Ritger-Peppas方程,表明凝胶具有良好的缓释作用。由此可见,复方颠倒凝胶制备工艺稳定,其外观、酸碱度、流变学和体外释放性能均良好,为复方颠倒凝胶临床上用于治疗痤疮提供理论依据,同时为中医领域其他中药外用处方的剂型改制开拓新的思路。
参考文献:
[1] 张怀亮,陈正琴,张新翠.赵炳南颠倒散古方痤疮、酒渣鼻和面部脂溢性皮炎传承治疗经验介绍[J].时珍国医国药,2012,23(8):2106-2108.
[2] 曹恩溥.“颠倒散”治疗痤疮52例[J].中医药临床杂志,1991,3(4):18.
[3] 马尊峰,霍文耀.古方颠倒散治疗痤疮50例临床观察[J].内蒙古中医药,2010,29(16):11.
[4] 清·吴谦.医宗金鉴·外科心法要诀[M].北京:人民卫生出版社,2001:181.
[5] 陈铁军.0.1%他扎罗汀凝胶联合硫磺甲硝唑霜面膜倒模治疗面部囊肿性痤疮[J].现代医院,2009,9(9):43-44.
[6] 郑水立,郭婷婷,陈 莹,等.复方颠倒散面膜治疗痤疮37例[J].中医外治杂志,2008,17(4):24-25.
[7] 张 斌.改良颠倒散治疗痤疮110例[J].甘肃中医学院学报,2008,25(2):32-33.
[8]王 燕.黄连软膜配合颠倒散外用治疗痤疮47例临床观察[J].中医中药,2011,19(9):232.
[9] 甄新现,李淑敏,陈恩生,等.复方颠倒散面膜治疗痤疮91例[J].中国中医药现代远程教育,2008,6(11):1347-1348.
[10]郭红叶,伊博文,闫小平,等.新型辅料卡波姆在凝胶剂中应用现状[J].中国实验方剂学杂志,2013,19(17):371-374.
[11]王志钢,王艳姣,李 慧,等.丹葛明目即型凝胶的制备研究[J].中国中药杂志,2012,37(1):46-51.
[12]娄 杰,贾运涛,田 睿,等.眼用小檗碱白蛋白纳米粒温敏原位凝胶的制备及性质研究[J].中草药,2013,44(3):277-281.
[13]江苏大学.大黄硫黄凝胶剂的制备方法[P].中国专利:CN1879710,2006-12-20.
[14]Shaikh J,Ankola DD,Beniwal V,et al.Nanoparticle encapsulation improves oral bioavailability of curcumin by at least 9-fold when compared to curcumin administered with piperine as absorption enhancer[J].European Journal of Pharmaceutical Sciences,2009,37(3):223-230.
[15]陈红斌,陈 钧.大黄对痤疮主要致病菌的体外抑菌作用研究[J].中药药理与临床,2006,22(3):111-113.
[16]高学敏.中药学[M].第2版.北京:中国中医药出版社,2007:158.
[17]聂 克.大黄药理作用研究及思考[J].山东中医药大学学报,2009,33(3):239-262.
[18]李晓红,李 蒙,陶艳蓉.大黄素及其衍生物药理作用研究新进展[J].现代药物与临床,2010,25(6):417-452.
[19]余 彬,何渊明,文 清.复方硫洗剂、螺内酯片联合维胺酯胶囊治疗寻常型痤疮的疗效观察[J].临床合理用药,2010,3(16):59-60.
[20]曾宪玉.丙酸杆菌的耐药研究及盐酸小檗碱对耐药株的抑制机制研究[D].长沙:湖南中医药大学,2014.
[21]陈 静,哈丽娜,王秀青,等.苦参碱对耐甲氧西林金黄色葡萄球菌体外抗菌作用的实验研究[J].长治医学院学报,2012,26(3):161-163.
[22]张爱君,赵清国,哈丽娜,等.氧化苦参碱对耐甲氧西林金黄色葡萄球菌体外抗菌活性的实验研究[J].包头医学院学报,2013,29(3):11-13.
[23]Strickland FM,Pelley RP,Kripke ML.Prevention of ultraviolet radiation-induced suppression of contact and delayed hypersensitivity by Abe barbadenesis gel extract[J].J Invest Dermatol,1994,102:197-204.
[24]徐 莲,符旭东,熊 蕊,等.芦荟的药理作用及其临床应用研究进展[J].中国药房,2016,27(10):1418-1421.
[25]曹韧楠.生肌散的经皮给药剂型研究[D].北京:中国协和医科大学中国医学科学院,2007.
[26]肖立新,彭力平,马笃军,等.消瘀散涂膜剂和即型凝胶剂治疗急性软组织挫伤的实验研究[J].中华中医药学刊,2013,31(1):184-188.
[27]卢 丰.浅谈凝胶剂在中药制剂中的研究进展[J].中国中医药现代远程教育,2012,10(17):162-164.
[28]赖宝林,王利胜,张 升,等.中药凝胶剂的研究进展[J].中药新药与临床药理,2010,21(2):211-213.
[29]王苏莉,刘艺萍,余伟民,等.卡波姆-对乙酰氨基酚骨架缓释片的体外释放度及药动学[J].中国医院药学杂志,2010,30(12):1004-1008.
[30]张丽华.外用凝胶剂的研究进展[J].海峡药学,2016,28(1):8-10.
