黄丹化瘀饮对大鼠脑缺血再灌注损伤及脑组织BDNF、VEGF表达的影响
2018-05-05鲁利甫邱雪银
鲁利甫,邱雪银
(1.河南省濮阳市中医医院药剂科,濮阳 457000;2.河南省濮阳市人民医院肿瘤科,濮阳 457000)
缺血性脑血管疾病是因脑血管病变致使血流减少或中断,使血管供应区出现缺血缺氧情况,出现一些病理生理反应。缺血后最重要的代偿机制就是促进损伤区的血管再生,搭建良好的侧支循环。有研究证实[1-2],血管内皮生长因子(VEGF)及其受体(VEGFR)在重建缺血性脑血管病变的微循环中作用重大,是脑缺血后使血管再生的调控中心。脑源性神经生长因子(BDNF)在神经生长因子的家族中代表性最强,当神经元发生病变或损伤时,在神经元及其胶质细胞中会有BDNF大量表达,发挥支持、营养、再生等功能。
1 材料和方法
1.1 材料
1.1.1 动物 SD大鼠,均为健康雄性,SPF级,体质量平均(224±16)g,动物合格证号为 SYXK(苏)2013-0018,由南京正大天晴公司提供。
1.1.2 药液 黄丹化瘀饮组方主要包括:黄芪、丹参、葛根、钩藤各30 g,川芎10 g,三七粉4.5 g。将中药饮片浸泡30 min(蒸馏水),用文火煎煮15 min,煎煮3次后,煎煮药液混合并过滤,过滤后的药液分别浓缩为浓度为100%、200%、400%的黄丹化瘀饮(生药含量分别 1、2、4 g/mL),储于冰箱(4℃)中备用。
1.1.3 试剂与仪器 兔抗鼠VEGF一抗、BDNF一抗、VEGFR-1抗体、鼠抗兔二抗试剂盒均由武汉博士德公司提供;蛋白定量试剂盒(BCA);ECL显影液。自动脱水机,德国ASP200S;石蜡包埋机,德国EG1150H;冰箱,日本SANYO;图文分析系统,德国。
1.2 方法
1.2.1 分组 实验动物随机分为5组(每组12只):假手术组、脑缺血再灌注模型组(模型组)、小剂量组[7.20 g/(kg·d)]、中剂量组[14.40 g/(kg·d)]、大剂量组[28.80 g/(kg·d)]。剂量根据大鼠与人体的剂量折算[3]。假手术组、模型组用等体积蒸馏水代替。各组均术前7 d开始给药(灌胃),每日1次,最后一次给药1 h后,制备脑缺血模型(大脑中动脉)。
1.2.2 大鼠模型制备 制备大鼠大脑中动脉栓塞模型,用Liu F[4]改良线栓法。具体方法:大鼠仰卧位固定,麻醉大鼠(用10%水合氯醛,剂量350 mg/kg),经颈部正中切口将颈动脉三角暴露,分离左侧颈总动脉、颈内及颈外动脉,将颈总动脉及颈外动脉结扎,在颈外动脉接近分叉的地方剪“V”形切口,用钝性鱼线线栓(赖氨酸包被、直径0.26 mm)斜行插入,由颈内动脉推进入大脑中动脉,遇到有阻力时止(约插入18~20 mm)。然后肌肉、皮肤缝合,术中大鼠肛温(37.0±0.5)℃。假手术组不插线栓,其他组均此操作。
1.2.3 神经功能评分检测 根据神经功能缺损评分(ZeaLonga评分法)[4](5分制)进行大鼠神经功能评分:无神经功能损伤的症状,为0分;对侧前爪无法完全伸展,为1分;向右侧转圈,为2分;向右侧倾倒,为3分;意识丧失、不能自发行走,为4分。评分为1~3分的大鼠入组实验。
1.2.4 脑梗死体积测定 大鼠脑缺血2 h后再灌注24 h,麻醉迅速取脑,速冻(-20℃)18 min后,将脑组织置入脑槽,随脑组织冠状面切成5片,并放入2,3,5-氯化三苯基四氮唑(TTC)2%的溶液中,避光置入水浴箱中(37℃)30 min。然后脑片放入多聚甲醛溶液(4%)中固定4~6 h,用数码相机拍照,图像分析系统计算梗死面积。
1.2.5 组织学检查 在大鼠脑缺血2 h后进行再灌注,24 h后,水合氯醛(10%)麻醉,并迅速开胸,心脏用生理盐水冲洗,4%多聚甲醛灌注并固定,然后断头取脑,并置入同样灌注液,在4℃的条件下固定1周,脱水透明浸蜡、包埋,HE染色、封片,并观察(在光镜下)。
1.2.6 免疫组织化法 取大鼠脑组织切片,根据试剂盒说明书严格操作,双氧水(H2O2)(3%)室温孵育,兔抗鼠VEGF、BDNF、VEGFR-1一抗工作浓度均为1∶200,然后加二抗,蒸馏水冲洗,复染(苏木素)、分化(盐酸乙醇)、脱水(乙醇)、透明(二甲苯)、封片(中性树胶),显微镜下观察。
1.2.7 蛋白质印迹法(Western blot)检测 取缺血侧的大脑皮质,提取蛋白,BCA法对蛋白浓度进行测定。蛋白变性后,电泳(SDS-PAGE)、转膜并封闭,然后分别加入一抗(VEGF、BDNF、VEGFR-1均为1∶1 000;β-actin 为 1∶2 000),在 4 ℃下孵育过夜。羊抗兔二抗(1∶2 000,HRP 标记),室温孵育,增强化学发光法(ECL)显色,凝胶成像、显影。Western blot条带灰度值用Image J图像分析系统,结果为VEGF、BDNF、VEGFR-1和β-actin的灰度值之比表示。
1.3 统计学方法 采用SPSS16.0进行统计学处理,计量资料数据用均数±标准差(x±s)表示,多组间比较采用重复测量的单因素方差分析,组间两两比较采用q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组神经功能评分及梗死体积分析 模型组脑缺血再灌注24 h后脑梗死体积及神经功能评分与假手术组比较,差异有统计学意义(P<0.05);中剂量组、大剂量组脑梗死体积及神经功能评分与模型组比较,差异有统计学意义(P<0.05);小剂量组与模型组比较,差异无统计学意义(P>0.05)。见表1,图1。

表1 各组神经功能评分及梗死体积分析(x±s)
2.2 各组脑缺血组织VEGF、BDNF、VEGFR-1蛋白表达分析 模型组VEGF、BDNF、VEGFR-1蛋白表达明显高于假手术组,差异有统计学意义(P<0.05);中剂量组、大剂量组VEGF、BDNF、VEGFR-1蛋白表达明显高于模型组,差异有统计学意义(P<0.05);小剂量组与模型组比较,VEGF、BDNF、VEGFR-1蛋白表达差异无统计学意义(P>0.05)。见表2,图2,图 3,图 4。

表2 各组脑缺血组织VEGF、BDNF、VEGFR-1蛋白表达分析(x±s)
3 讨论
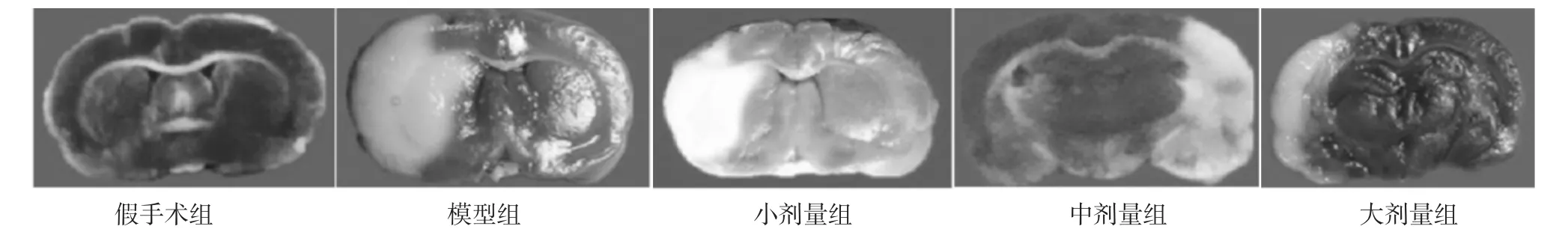
图1 各组脑梗死再灌注24 h后TTC染色情况,深色为正常脑组织,浅色为梗死组织
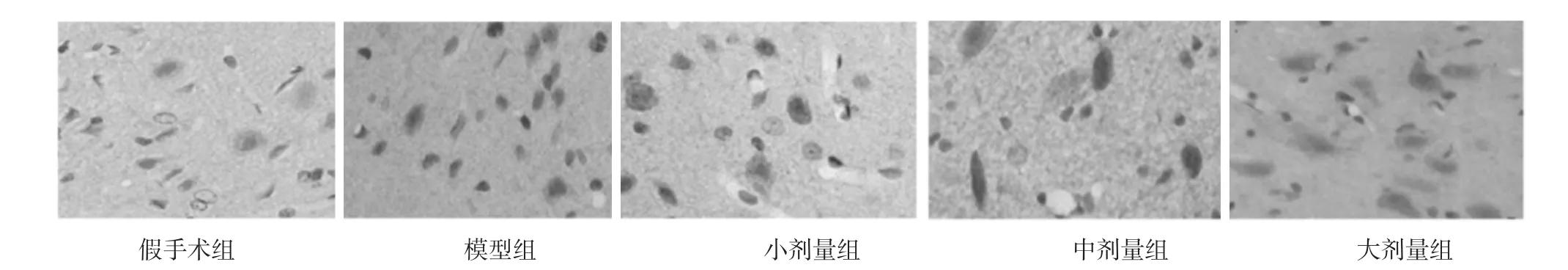
图2 各组脑缺血组织VEGF蛋白表达(immunohistoche-mistry,×400)

图3 各组脑缺血组织BDNF蛋白表达(immunohistoche-mistry,×400)
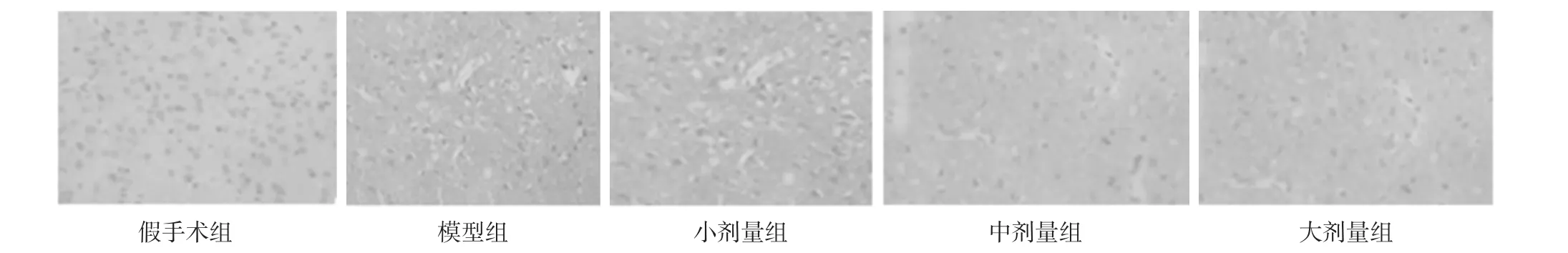
图4 各组脑缺血组织VEGFR-1蛋白表达(immunohistoche-mistry,×400)
黄丹化瘀饮为本院多年总结出的治疗缺血性脑血管病的中药方剂,其由黄芪、丹参、钩藤、三七、川芎、葛根等草药组成,主要通过活血、益气、化瘀等发挥脑缺血损伤的治疗作用[5]。赵志敏等[6]现代药理证实,三七中的三七总皂苷能明显使缺血再灌注大鼠脑组织BDNF蛋白合成明显增加,上调BDNF mRNA的含量。丹参中的丹参酮ⅡA能明显降低局部脑缺血再灌注大鼠脑梗死体积,也有研究证明其能够上调人CREB调节转录辅激活因子1(TORC1-CREB)信号通路,增强相关基因转录,上调某些神经营养因子的表达,调节神经元损伤后再生等[7-8]。本研究结果显示,黄丹化瘀饮中剂量、大剂量组大鼠神经功能评分、脑梗死面积均明显低于模型组,由此提示此汤剂的有效性。
本研究结果显示,模型组大鼠缺血再灌注损伤后,VEGF蛋白表达明显高于假手术组,这是机体对抗脑组织损伤自身保护的一种方式,与模型组比较,中剂量组及大剂量干预后,能明显上调BDNF、VEGF表达,从而发挥保护神经细胞的作用[9-10]。本研究结果还显示,中剂量组及大剂量干预后,使VEGFR-1表达也明显升高,这说明中、大剂量黄丹化瘀饮促进VEGF蛋白表达的同时,也能够上调其受体表达来促进缺血区的血管生成。此结果和刘秀萍[11]的研究不同,分析其原因,可能是因为研究缺血再灌注时间不同所致(本研究选取时间点为缺血2 h/再灌注24 h,刘秀萍[11]的研究选取时间点为缺血2 h/再灌注12 h,药物促进VEGFR-1表达作用可能还没有充分显现出来)。
黄丹化瘀饮用于脑缺血再灌注后脑损伤模型大鼠,能通过上调VEGF、BDNF、VEGFR-1蛋白水平发挥神经保护作用。不足的是,本研究是多种中药方剂,对具体药物的具体成分发挥的上调VEGF、BDNF、VEGFR-1蛋白水平的作用仍需进一步研究。
参考文献:
[1] 何 佳,丁凤菲,刘敏珍,等.VEGF/VEGFR在脑缺血再灌注损伤中的神经保护作用[J].神经损伤与功能,2013,3(8):177-180.
[2] Mǎrgǎritescu O,Pirici D,Mǎrgǎritescu C.VEGF expression in human br-ain tissue after acute ischemic stroke[J].Rom J Morphol Embryol,2011,52(4):1283-1292.
[3] Oshikawa J,Urao N,Kim HW,et al.Extracellular SOD-derived H2O2promotes VEGF signaling in caveolae/lipid rafts and post-ischemic angiogenesis in mice[J].Plos one,2010,5(4):e10189.
[4] Yang J,Yao Y,Chen T,et al.VEGF ameliorates cognitive impairment in vivo and in vitro ischemia via improving neuronal viability and function[J].Neuromolecular Med,2014,16(2):376-388.
[5] 周赛男,蔺晓源,易 健,等.补阳还五汤对脑缺血大鼠神经功能及细胞形态的影响[J].中国实验方剂学杂志,2013,19(2):251-254.
[6] 赵志敏,肖志娟,薛 茜,等.康脑液对脑缺血再灌注动物血管新生的影响[J]中国临床药理学,2014,30(10):429-431.
[7] 承韶晖,陈晓蓉,侯冠峰,等.丹参酮ⅡA磺酸钠对脑缺血/再灌注模型大鼠脑梗死及神经功能评分影响的实验研究[J].中国中西医结合急救杂志,2012,19(5):287-289.
[8] 金锡娇,欧阳洁,郭 莹,等.葛根黄酮对脑缺血再灌注损伤大鼠脑组织NO及NOS的影响[J].中国中医急症,2013,22(8):1360-1361.
[9] 王任烨,俞雪锋,谢昫珮,等.氟西汀对恐惧记忆形成阶段 BDNF、Bcl-2表达的影响[J].药学学报,2014,19(4):463-469.
[10]马建鹏.康脑液对大鼠脑缺血再灌注损伤后神经血管因子、MMP-9、ERK1/2表达的影响[D].石家庄:河北北方学院,2015.
[11]刘秀萍,邓 方.银杏内酯和白果内脂对大鼠脑缺血再灌注损伤后VEGF的表达的影响[J].中风与神经疾病杂志,2015,32(2):108-110.
