复方车前凝胶贴膏的制备及初步评价*
2018-05-05夏珍珍李冰韶王永洁谢远平林红梅
夏珍珍,陈 柽,李冰韶,王永洁,谢远平,林红梅,吴 清
(北京中医药大学中药学院,北京 102488)
复方车前水浸膏组方为车前子、牵牛子、大腹皮等多味中药。临床上将其涂抹于腹部治疗恶性肿瘤引起的癌性腹水,临床使用多年,疗效显著且年需求量逐渐增加。但因浸膏流动性过大,黏着力差,使用不便,患者顺应性较差,阻碍了该方的进一步推广。凝胶贴膏作为一种新型的经皮给药剂型,因载药量大,含水量高,刺激性,敏性小,生物相容性好,使用方便等优势[1-2],近年来成为外用制剂研发的热点[3-6]。因此,本研究选择凝胶贴膏为复方车前水浸膏的新剂型,在复方车前浸膏基础上,对复方车前凝胶贴膏处方进行优化,为进一步开发复方车前凝胶贴膏提供基础。
1 材料
LC-20AT型高效液相色谱仪、SPD-20A检测器(日本岛津国际贸易有限公司),JY1002电子天平(上海舜宇恒科学仪器有限公司),BSA-224S电子天平(赛多利斯科学仪器北京有限公司),5DM-03-R万能混合搅拌机(株式会社三英制作所),涂布机(自制);CZY-G型初黏力测试仪(济南兰光机电技术有限公司),CZY-S型持黏力测试仪(济南兰光机电技术有限公司),BLD-200N型电子剥离试验机(济南兰光机电技术有限公司),TK-24BL型药物透皮扩散试验仪(上海锴凯科技贸易有限公司)。
NP700[亚什兰(中国)投资有限公司],甘羟铝(北京凤礼精求商贸有限公司),L(+)-酒石酸(国药集团化学试剂有限公司),甘油(北京化工厂,分析纯),PVPK90(天津市福晨化学试剂厂),京尼平苷酸(上海源叶,批号P25F8F30154),圆形透析膜片(截留分子量3.5KD,批号SP132488,生工生物工程上海股份有限公司),甲醇(Sigma,色谱纯),水(娃哈哈),昆明小鼠[SPF级,斯贝福(北京)生物技术有限公司,许可证号 SCXK(京)2016-0002],Mouse VEGF Elisa Kit(Proteintech)。
2 方法与结果
2.1 凝胶贴膏的制备 通过前期实验[7-8],确定凝胶贴膏的制备工艺。取一定量NP700、甘羟铝均匀分散于适量的甘油中,作为A相;将一定量的酒石酸溶解于蒸馏水中,再加入PVPK90,放置过夜,使PVPK90充分溶胀,作为B相;将B相和一定量的浸膏加入A相中充分搅拌,涂布后装入铝箔袋中,放置成型,即得。
2.2 凝胶贴膏的评价指标
2.2.1 初黏力测定 参照中国药典(2015)[9]。测量值以小球质量计算,单位:质量(g),以测得最大值为35分,其余的与之相比计算得分。
2.2.2 持黏力测定 参照中国药典(2015)[9]。测量值以剥离力计算,单位:牛顿(N),以测得最大值为35分,其余的与之相比计算得分。
2.2.3 剥离强度测定 参照中国药典(2015)[9]。测量值以掉落时间计算,单位:s,以测得最小值为30分,其余的与之相比计算得分。
2.2.4 综合感官评分[7-8]
2.3 Plackett-Burman设计筛选显著影响因子 本实验筛选出对凝胶膏成型影响较大的因素,为Box-Behnken设计提供指导。
2.3.1 实验因素及水平设计 根据预实验,将NP700、PVPK90、甘油、甘羟铝、酒石酸 5 个因素作为Plackett-Burman设计的因素,因素水平设计表,见表1。
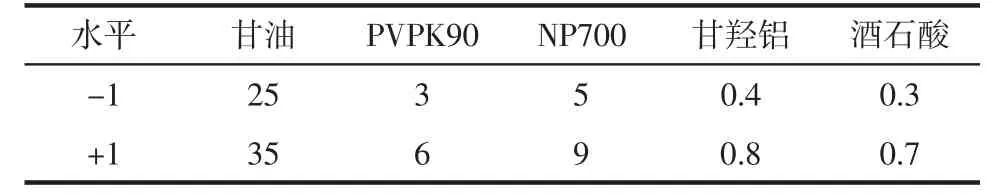
表1 Plackett-Burman水平设计 g
2.3.2 Plackett-Burman实验结果及分析 根据Plackett-Burman设计表进行实验,按“2.2.1/2.2.2/2.2.3”项对凝胶膏3个黏性指标进行考察,综合得分。实验设计及响应值,见表2。

表2 Plackett-Burman实验设计及结果
以Design-Expert8.0.6软件设计实验方案,实验结果及方差分析,见表3。
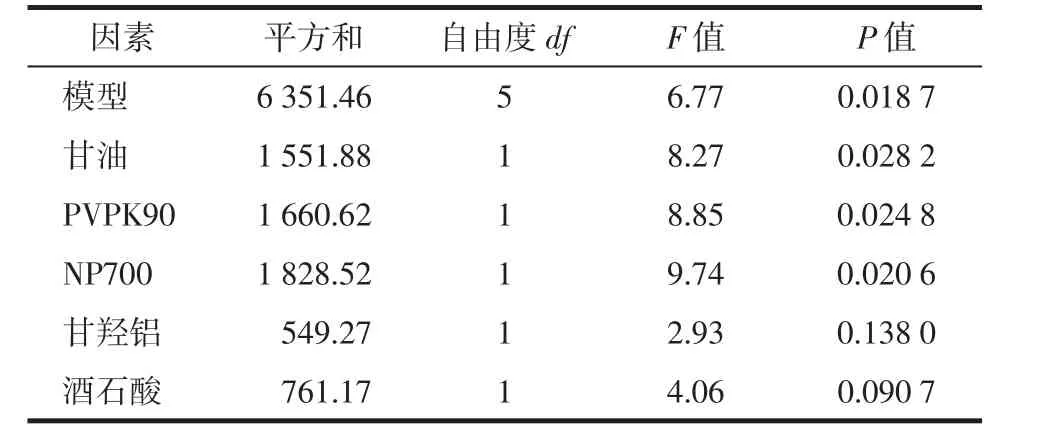
表3 Plackett-Burman方差分析表
从表3中可以看出,该模型回归显著,模型r2=0.981 3,说明回归拟合程度较好,甘油、PVPK90、NP700具有显著性,因此选择NP700、PVPK90、甘油3个因素作进一步响应面分析,以确定这些因素的最优水平。
2.4 单因素实验考察显著因子最佳用量范围 本节实验以综合感官评分为指标,在Plackett-Burman设计结果基础上考察显著因子NP700、PVPK90、甘油的最佳用量范围。按2.1项下制备凝胶贴膏,按2.2.4项下评分标准进行评价,最终得到PVPK90 4~6 g,NP700 5~8 g,甘油 30~35 g 为 Box-Behnken实验设计因素水平。
2.5 Box-Behnken设计筛选最优处方
2.5.1 Box-Behnken设计实验 根据Plackett-Burman实验及单因素实验结果结果,利用Design-Expert8.0.6软件,将对凝胶膏成型影响较大的NP700、PVPK90、甘油3个因素及水平设计[10],见表4。
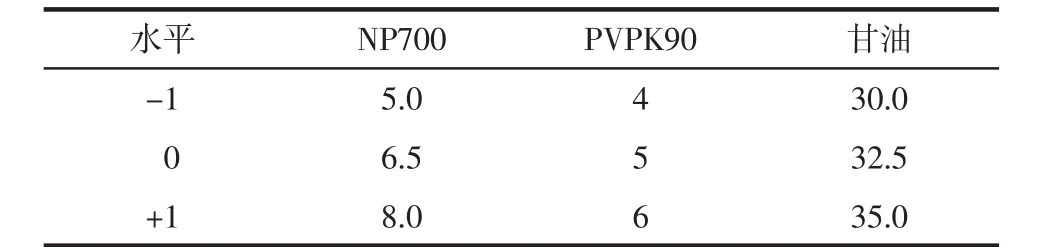
表4 Box-Behnken设计实验因素水平g
2.5.2 Box-Behnken实验结果 按照Box-Behnken设计表进行实验,以初黏力、持黏力、180°剥离强度为评价指标,各组实验综合评分结果,见表5。
2.5.3 模型的建立及显著性检验 以Design-Expert8.0.6软件设计处理结果及方差分析,见表6。
根据实验结果,应用Design-Expert8.0.6软件,以评价指标分别对各因素进行二项式拟合,表5所示为不同配方响应值的相应变化。表6为本实验的方差分析结果,经F检验显示总模型方程显著(P=0.000 2),r2=0.968 3,表明该回归模型的拟合情况良好,回归方程的代表性较好,能准确地预测实际情况。由表 6 可知 A、B、C、AB、AC、A2、B2、C2 有显著性差异,利用Design-Expert 8.0.6软件进行多元回归拟合,得二次多项回归模型:Y=83.20+13.68A+10.01B+8.21C+15.04AB-10.24AC+5.96BC-5.92A2-32.84B2-12.72C2。式中Y为响应值,A,B,C分别为NP-700、PVAK90、甘油。该方程相关系r2=0.968 3。由表 6 可知,整体模型达到显著水平(P=0.000 2),表示该二次方程模型比较显著,失拟值=0.286 8>0.05,没有显著性,变异系数(CV)为 11.61,其值较小,说明实验稳定可信。由表6可知,模型中A、B、C、AB、AC、B2、C2 项具有显著性,表明各个自变量与因变量之间不是简单的线性关系,具有一定的交互作用。在各影响因素中,因素A的影响最大,其次是因素B。
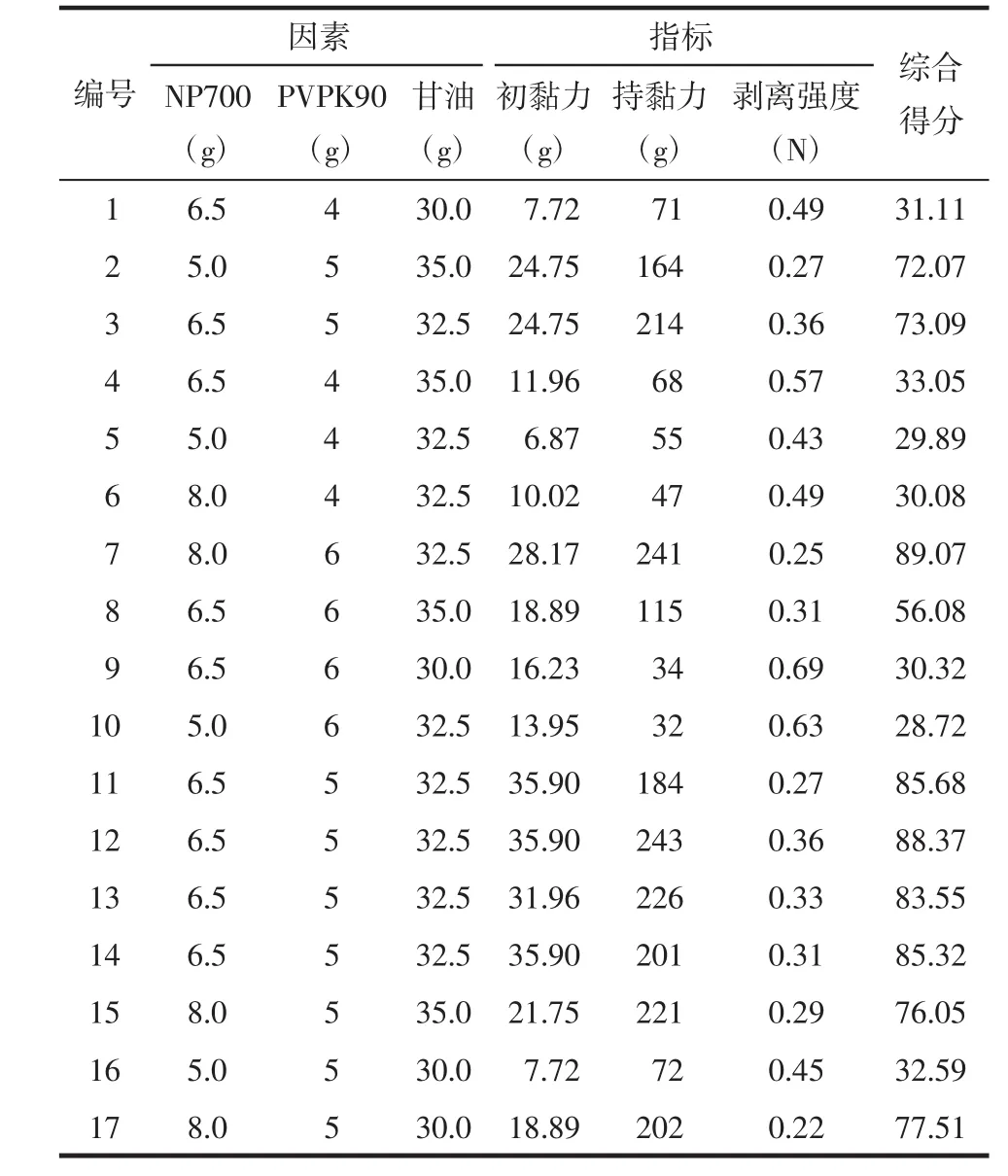
表5 Box-Behnken实验设计及结果

表6 Box-Behnken设计方差分析
由图1可见中响应面的3D曲面图和等高线图,直观地反映各因素的交互作用对响应值的影响以及最优条件下各因素的取值。图1中A、B,A、C响应面曲线较陡,说明A与B、A与C之间具有显著性交互作用,这和方差分析的结果相一致。
2.5.4 最优处方验证实验 根据Box-Behnken实验所得的结果和二次多项回归方程,利用Design Expert 8.0.6软件优选得到,在NP 700 8 g、PVPK90 5.38 g、甘油 32.5 g、酒石酸 0.5 g、甘羟铝 0.5 g的条件下,其最大评价总分为95.39。按照最佳处方条件制备了3批样品进行验证,见表7。结果显示评价总分与模拟值基本接近,表明预测值和真实值之间有很好的拟合性,进一步验证了模型的可靠性。
2.6 京尼平苷酸高效液相色谱(HPLC)方法的建立2.6.1色谱条件色谱柱:InertsilODS-3C18(4.6mm×250 mm,5 μm);流动相为甲醇:0.5%醋酸=8∶92;流速:1.0 mL/min;检测波长:210 nm;柱温:30℃;进样量:10 μL;理论板数按京尼平苷酸峰计算应不低于3 000。
2.6.2 对照品溶液的制备 取京尼平苷酸对照品适量,精密称定,置棕色量瓶中,加60%甲醇制成每1 mL含0.406 mg的对照品溶液,过滤,即得。
2.6.3 供试品溶液的制备 精密称取复方车前凝胶贴膏1.0 g,精密加入40 mL甲醇,称质量,加热回流提取60 min,冷却到室温,再称质量,用甲醇补足失重,摇匀,滤过,取续滤液,即得。
2.6.4 阴性样品溶液的制备 按2.6.3项下制备车前子阴性凝胶贴膏溶液,摇匀,滤过,取续滤液,即得。
2.6.5 专属性、精密度、稳定性考察结果均良好
2.6.6 线性关系考察 按2.6.1项下色谱条件测定。以京尼平苷酸质量浓度为横坐标,峰面积为纵坐标,得回归方程 Y=993 996X-12 878(r2=0.999 9),表明京尼平苷酸在2.032~203.2 μg/mL内与峰面积

图1 Box-Behnken设计3D曲面图及等高线图

表7 最佳处方3批验证实验结果
呈良好线性范围。
2.7 凝胶贴膏中京尼平苷酸的体外释放研究 采用Franz扩散池法[11-12],上室为扩散室,下室为接受室,有效扩散面积3.14 cm2。凝胶膏贴于3.5KD圆形透析膜片上,再将透析膜片固定在两室之间。接收室注满磷酸盐缓冲液(PBS),排出气泡,使液面完全与透析膜片接触。磁搅拌转速设定为300 r/min,控制温度(32±0.1)℃,计时。于设定的时间点 2,4,6,8,10,12,24 h 移取接收液 1mL,同时补加同样体积的新鲜接收液,过滤,测定接收液中京尼平苷酸的含量,计算Qn%。
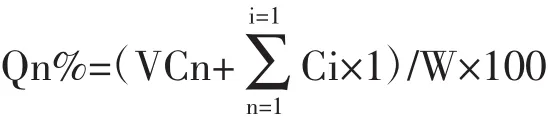
式中Qn%为第n个时间点的累积释放率(%),V为接收室中接收液的体积(mL),Cn为第n个取样点测得的药物质量浓度(mg/mL),1代表取样体积1 mL,W为凝胶膏中所含药物质量(mg)。京尼平苷酸24 h释放率为(81.23±1.52)%。以Qn%对释放时间t作图,绘制累积释放曲线,见图2。
对释放数据以Origin Pro8.0软件进行模型拟合,结果见表8。
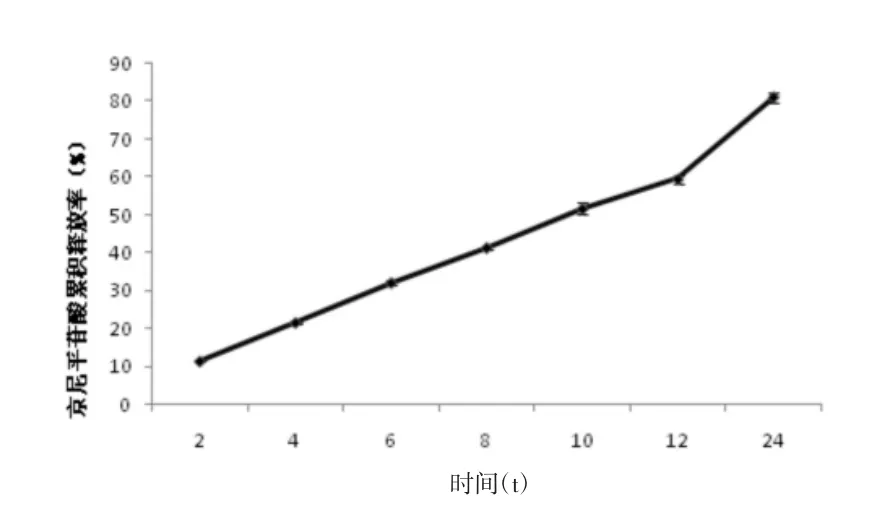
图2 京尼平苷酸24 h累积释放率(n=3)

表8 京尼平苷酸的Qn%-t模型拟合
由表8可知,复方车前凝胶贴膏中京尼平苷酸体外释放零级拟合和一级拟合的相关系数分别0.903 82、0.991 38,说明药物的释放过程符合一级动力学方程,即与浓度有关。
2.8 药效实验 健康KM小鼠(SPF级),适应性饲养3 d后,随机分为模型组、空白组、空白贴膏组、复方车前凝胶贴膏组、临床浸膏组,每组8只。各组小鼠称质量后,腹部剃毛,面积为2 cm×3 cm。除空白组外,其余各组小鼠腹腔注射接种小鼠H22肝癌细胞,细胞接种密度[17-18]为 1×107个/mL,0.2 mL/只。造模第2天起,除模型组外,各组开始给药,临床浸膏组涂抹临床浸膏,涂抹于小鼠腹部,并裹上纱布,以医用胶带固定。复方车前凝胶膏剪为2 cm×3 cm大小,贴于小鼠腹部,以医用胶带固定,空白贴膏组小鼠腹部贴空白凝胶膏,空白组以蒸馏水涂抹,给药8 h后拆除纱布及胶带,浸膏组以蒸馏水清洗干净,连续给药1周,每日称质量并记录。破腹取腹水记录体积。摘取脾脏,滤纸吸干表面液体后,称质量并记录。破胸腔,摘取胸腺,以滤纸吸干表面液体后,称质量并记录。腹水以10 000 r/min,10 min离心,取上清。以酶联免疫吸附法测定腹水中血管内皮生长因子(VEGF)的浓度。
胸腺指数及脾脏指数[19]计算公式如下:
胸腺(脾脏)指数=胸腺质量(mg)×10/体质量(g)
结果以均数±标准差(x±s)表示,数据以 SPPS 18.0统计软件进行分析,组间比较采用单因素方差分析,结果见表9。
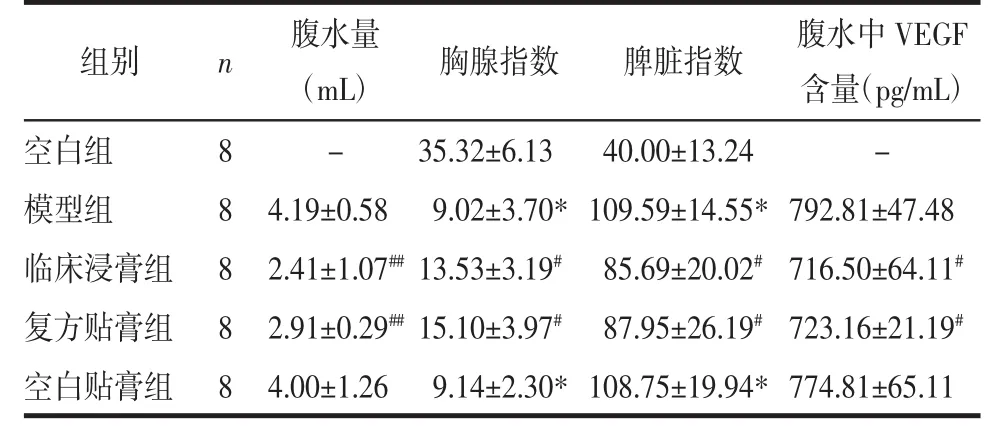
表9 浸膏及复方贴膏对小鼠H22肝癌腹水的影响(x±s)
由表9结果可知,与模型组比较,临床浸膏组和复方车前贴膏组的腹水量均有统计学差异(P<0.01),且复方贴膏组与临床浸膏组无统计学差异(P=0.363)。模型组小鼠与空白组相比,胸腺指数显著降低(P<0.001),脾脏指数显著升高(P<0.001)。临床浸膏组和复方车前贴膏组的胸腺指数有一定的升高而脾脏指数显著降低(P<0.05),且贴膏组与浸膏组无差异(P=0.846)。浸膏组与复方贴膏组的小鼠腹水中VEGF的含量与模型组相比,显著降低(P<0.05),且贴膏组与浸膏组无差异(P=0.857)。以上各指标,空白贴膏组与模型组均无显著差异。
药效实验结果表明,复方车前水浸膏及复方车前凝胶贴膏均能有效减轻H22小鼠肝癌细胞引起的小鼠腹水状况。药效实验中观察发现,给药后,与模型组相比,浸膏组及贴膏组小鼠毛色有光泽,小鼠状态较好,模型组小鼠出现脱毛,毛色暗淡等病态。但浸膏组由于浸膏涂抹,皮毛被污染严重,而贴膏组小鼠皮毛干净,光泽较好,生存状态较佳。因此,复方车前凝胶贴膏剂型改良成功且具有较高的开发意义。
3 讨论
3.1 优化方法的选择 Plackett-Burman设计能用最少实验次数筛选并确定对结果影响比较显著的因素,避免在后期的优化实验中由于部分因子不显著而浪费实验资源,已经被广泛应用于化学、质量控制和食品科学等领域[13]。Box-Behnken中心组合设计采用非线性模型拟,通过对函数响应面和等高中心组合设计采用非线性模型拟,通过对函数响应面和等高线的分析,对影响应值各因素水平及其交互作用进行优化和评价快速有效地确定多因素系统的最佳条件,所得结果更加直地确定多因素系统的最佳条件,所得结果更加直观,便于分析[14-15]。相比正交实验设计及均匀设计,Box-Behnken设计响应面优化更适合处方配比复杂,各因素之间存在交互作用的凝胶贴膏处方设计。因此,本研究选择以Plackett-Burman设计选择显著因子,以Box-Behnken设计响应面优化筛选最佳处方。
3.2 小鼠H22肝癌腹水实验 小鼠(H22)肝癌是最常用的小鼠可移植性肿瘤细胞系之一,广泛应用于小鼠肿瘤动物模型的复制[17]。在本研究中,药效实验结果显示,H22肝癌腹水模型造模成功后,模型组小鼠与空白组相比,腹部积水严重,出现膨胀,胸腺指数显著降低(P<0.001),脾脏指数显著升高(P<0.001)。造模成功后,H22对小鼠的免疫系统造成了严重的伤害,胸腺萎缩,脾脏肿胀,引起水循环障碍,造成腹水不消,临床浸膏及改变剂型后的复方车前凝胶贴膏均能够有效的降低腹水量,提高胸腺指数,改善H22对小鼠免疫系统的伤害。
参考文献:
[1] 杨华生,黎晓丽,吴 璐,等.中药凝胶贴膏质量研究进展与思考[J].中医外治杂志,2016,26(3):3-5.
[2] 贾 伟,高文远,王 涛,等.中药巴布剂的研究现状[J].中国中药杂志,2003,49(1):11-15.
[3] 谢加庭,吴燕红,杨 凡,等.鸦胆子凝胶贴膏配方工艺的研究[J].现代中药研究与实践,2017,31(4):46-48.
[4] 曾照亿,刘 佳,肖 芳,等.挥发油3种加入方式对止痛凝胶贴膏剂基质及体外释放度的影响[J].中国实验方剂学杂志,2017,23(15):20-25.
[5] 朱力阳,马 建,涂 禾,等.丁桂凝胶贴膏镇痛抗炎作用研究[J].中国骨伤,2016,29(6):538-542.
[6] 朱红霞,姚佳玉,曾云芳,等.葎椒凝胶贴膏剂制备工艺及质量标准研究[J].辽宁中医药大学学报,2017,19(1):75-77.
[7]章烨雯.小儿退热凝胶贴膏的制备工艺与评价研究[D].北京:北京中医药大学,2016.
[8] 章烨雯,于竞新,王景雁,等.D-最优混料设计结合多种力学指标优化柴栀凝胶贴膏的基质处方及其体外释放透皮研究[J].中国中药杂志,2016,62(6):1046-1053.
[9] 国家药典委员会.中华人民共和国药典四部[M].北京:中国医药科技出版社,2015,203.
[10]王健松,席 龙,叶伟文,等.Plackett-Burman联用Box-Behnken响应面法优化依那普利非洛地平双层片缓释层处方[J].中国医药工业杂志,2017,48(6):854-860.
[11]白 洁,陆 洋,杜守颖,等.川芎贴膏制备工艺及其体内外评价研究[J].中华中医药杂志,2013,28(5):1259-1266.
[12]朱力阳,马 建,涂 禾,等.二黄凝胶贴膏与软膏的体外释放及透皮性能比较[J].华西医学,2016,31(4):724-727.
[13]黄诗莹,张丽娟,柯龙华,等.Box-Behnken响应面法优选豨桐凝胶贴膏的提取工艺[J].广东药科大学学报,2017,(1):37-42.
[14]张艳军,刘莉莉,胡军华,等.基于Plackett-Burman设计和Box-Behnken响应面法优化鼻鼽颗粒一步制粒工艺[J].中国中药杂志,2015,40(22):4406-4410.
[15]黄信全,莫家鹏,李学杰,等.Plackett-Burman联用Box-Behnken效应面设计优选夜交藤总黄酮提取工艺[J].辽宁中医药大学学报,2014,16(9):67-69.
[16]门颖丽,康巧珍,王小龙,等.MBP在小鼠肝癌H22荷瘤模型中的抗肿瘤作用[J].郑州大学学报:医学版,2016,51(3):313-316.
[17]侯 杰,罗 兰,焦成斌,等.H22昆明鼠肝癌原位模型的建立[J].黑龙江医药科学,2015,38(1):78-79.
[18]武建毅,沈 清,金赟洁,等.黄芪甲苷对BALB/C小鼠肝癌H22腹水瘤抑制作用及机制[J].中国药物警戒,2016,13(3):142-145.
[19]叶绍凡.黄精多糖对力竭运动小鼠胸腺胸腺指数、脾脏指数、T淋巴细胞亚群、巨噬细胞吞噬功能的影响[J].基因组学与应用生物学,2015,34(1):60-65.
[20]徐小娟.山慈菇多糖、牛膝多糖对H22小鼠肝癌抑制作用及其抗肿瘤机制研究[D].长沙:湖南农业大学,2015.
[21]陈 丽,张安文,罗 宇,等.柿叶不同极性部位对H22腹水瘤及H22,S180实体瘤小鼠的抑瘤作用[J].中国实验方剂学杂志,2015,21(1):167-173.
[22]郝 习,赵明耀,杨红艳,等.枸杞多糖对荷H22肝腹水瘤小鼠免疫功能的影响[J].郑州大学学报:医学版,2011,46(2):242-245.
