常规MRI和DKI技术诊断肝豆状核变性疾病的对比研究
2018-05-04卢琦王安琴张春芸武红利徐春生
卢琦, 王安琴, 张春芸, 武红利, 徐春生
肝豆状核变性(hepatolenticular degeneration,HLD)又称Wilson病,是一种常染色体隐性遗传病,系铜转运蛋白障碍而导致过量铜在体内聚集,继而导致大脑和肝脏等组织损伤,患者的主要临床表现为神经精神症状[1-2]。扩散峰度成像(diffusion kurtosis imaging,DKI)是一种新的磁共振成像技术,其采用非高斯扩散模型的方法来观察大脑组织中微观结构的变化,尤其适合于对灰质微观结构的观察[3]。本研究中利用DKI技术来分析肝豆状核变性患者大脑微观结构的变化情况,旨在提高对肝豆状核变性的影像诊断水平。
材料与方法
1.研究对象
搜集本院35例WD患者的病例资料,其中男21例,女14例,年龄18~45岁,平均(26.9±7.0)岁;无其它神经精神系统疾病。此外,选取性别和年龄与患者组相匹配的健康志愿者30例作为对照组,其中男15例,女15例,年龄19~48岁,平均(26.2±5.6)岁。所有受试者签署了知情同意书。
2.数据采集
使用GE Discovery MR750 3.0T超导型磁共振成像仪及8通道相控阵标准头颅线圈。扫描范围自颅顶至枕骨大孔水平,检查序列包括常规T2WI和DKI序列。常规T2WI参数:TR 9000 ms,TE 124 ms,翻转角111°,矩阵256×256,视野250 mm×250 mm,层厚5 mm,无层间距,扫描20层;DKI序列参数:SS-EPI序列,TR 4800 ms,TE Minimum,翻转角12°,矩阵128×128,视野240 mm×240 mm,层厚3 mm,无层间距,扫描45层,采用3个b值(0、1000 和2000 s/mm2),其中b=0 s/mm2时采集6帧图像、共15个方向。
3.数据分析
将受试者DKI序列的图像传输至GE ADW4.6工作站,利用Functool软件包里的DKI软件对数据进行处理,计算DKI参数值:平均扩散峰度(mean kurtosis,MK)、径向扩散峰度(radial kurtosis,RK)、轴向扩散峰度(axial kurtosis,AK)。在双侧豆状核(bilateral lenticular nucleus,LN)和双侧尾状核头(bilateral head of caudate nucleus,HCN)的最大截面上勾画感兴趣区(图1、2),测量各参数值,每个部位测量3次、取平均值。再以同样的方法测量常规T2WI上双侧LN、HCN和侧脑室的T2信号值,以侧脑室为基准计算LN和HCN的T2信号变化率。测量时尽量避开血管、脑脊液等结构以降低误差。
使用SPSS 19.0软件包进行统计学分析。采用校正t检验比较双侧豆状核、双侧尾状核头部的DKI参数值和T2信号变化率在WD组与对照组之间的差异,以P<0.05为差异有统计学意义。再绘制受试者工作特征(receiver operating characteristic curve,ROC)曲线,计算约登指数,判定各个参数值的诊断敏感性和特异性,并计算ROC曲线下面积(area under ROC curve,AUC)。
结 果
在经过图像伪影及头动等因素的筛选后,最终有26例WD患者及25例健康志愿者纳入本研究。所有受试者的基本临床资料见表1。WD组与健康对照组间性别和年龄的差异均无统计学意义(P>0.05)。
两组患者尾状核和豆状核的DKI参数和T2信号变化率见表2~3。与健康对照组相比,WD组双侧豆状核的MK值及T2信号变化率升高且差异具有统计学意义(P<0.05),KA值及KR值的差异无统计学意义(P>0.05);ROC曲线分析结果见表4和图3,其中MK值及T2信号变化率的ROC曲线下面积分别为0.825、0.708,95%置信区间分别为0.710~0.939、0.551~0.864。双侧尾状核头的MK、KA和KR值及T2信号变化率均升高,差异均有统计学意义(P<0.05);ROC曲线分析结果见表5、图4,其中MK值、KA值、KR值及T2信号变化率的ROC曲线下面积分别为0.814、0.822、0.670和0.686,95%置信区间分别为0.684~0.943、0.700~0.944、0.515~0.825和0.533~0.839。

表1 两组的基本临床资料
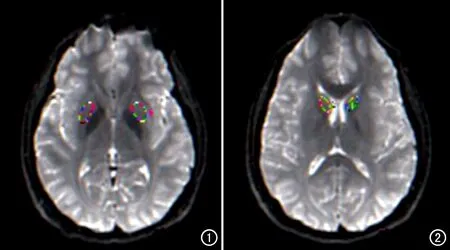
图1 在T2WI上在双侧豆状核勾选感兴趣区,以确定DKI参数测量的ROI。 图2 在T2WI上于双侧尾状核头部选感兴趣区,以确定DKI参数测量的ROI。
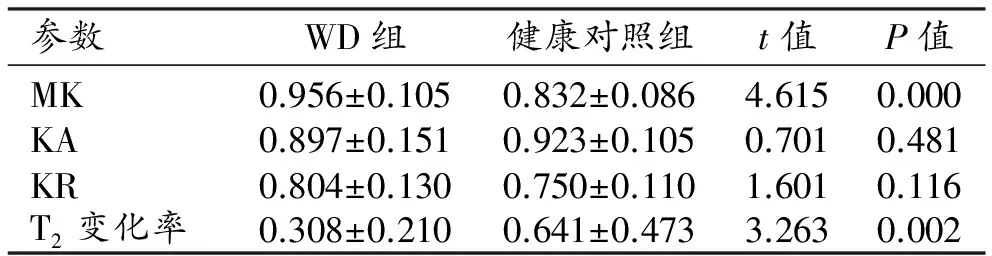
表2 两组中双侧豆状核部位ROI各参数值及比较
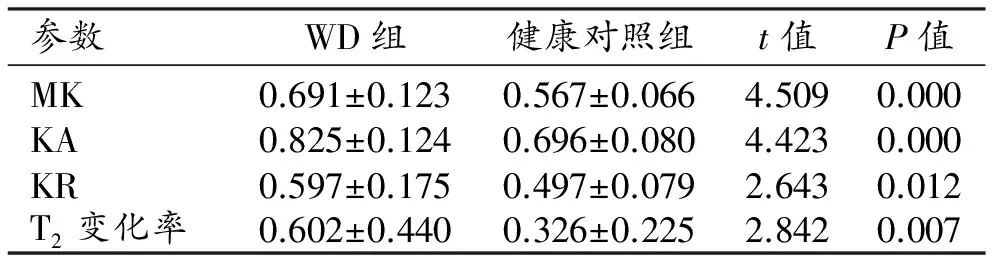
表3 两组中双侧尾状核头部各参数值及比较
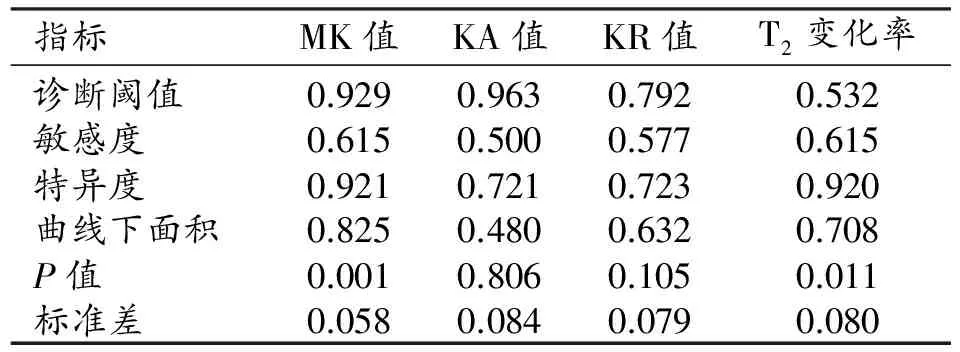
表4 双侧豆状核各参数的诊断效能
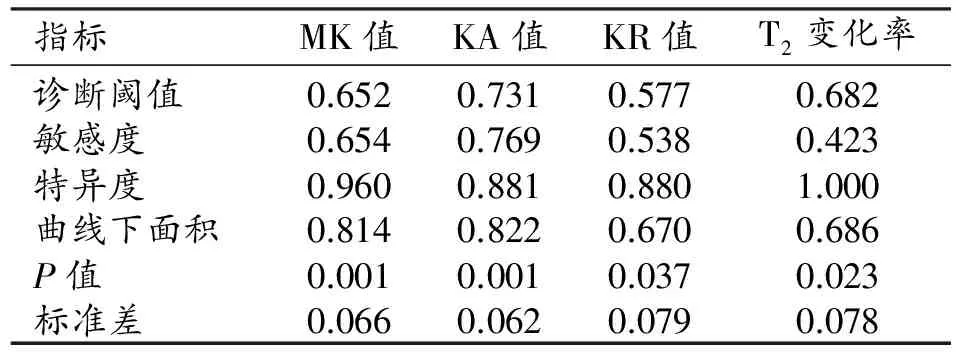
表5 双侧尾状核头部的诊断效能
讨 论
1.肝豆状核变性及其常规影像学表现
WD是一种常染色体隐形遗传性疾病,铜蓝蛋白合成障碍是本病的主要病理机制,肝脏铜蓝蛋白合成减少,排泄减少,肠道对铜吸收增加,导致过量的铜析出并沉积在肝脏、脑组织及角膜等部位而引起损伤。有研究表明WD患者中枢神经系统的损伤主要累及豆状核、尾状核、丘脑及小脑齿状核。因此,本研究中选取双侧豆状核及尾状核头部作为感兴趣区,分析其DKI信号及微观结构的变化[1]。目前,对WD的诊断主要依靠临床表现、铜生化检测、角膜色素环和影像学等辅助检查手段。本项研究中的WD患者主要根据其临床表现及生化检验结果而明确诊断,35例患者均有神经系统症状,包括震颤、肌张力增高、吞咽困难及口齿不清,24h尿铜及铜蓝蛋白检测异常。
WD在常规MRI上的主要表现为双侧基底节区豆状核对称性长T1、长T2信号,俗称“熊猫眼征”[4-5],可能与铜沉积在基底节区导致细胞水肿和坏死、脱髓鞘改变和胶质增生等有关[1]。颜立群等[6]对16例WD患者进行回访性分析,10例患者表现为明显的双侧基底节区长T1长T2信号影,其中3例呈现典型的“熊猫眼”征。刘勇等[7]对52例WD患者进行回顾性分析,发现38例患者表现基底节区不同程度的信号异常,可见常规MRI对WD具有良好的诊断价值。在本项研究中,WD患者出现不同程度的双侧豆状核、丘脑及脑干的信号异常,部分患者有脑萎缩改变。
2.DKI技术的基本原理
DKI技术是在DTI技术基础上发展而来的[8],与其不同的是采集的方向更多、b值更高和更多。DTI技术采用二阶扩散张量模型,而DKI技术将二阶张量转换为四阶张量,能够更好地显示扇形纤维及交叉纤维。另外,DTI技术是假定水分子在人体内的扩散信号呈线性衰减,即呈高斯分布模型。在对人体大脑组织进行成像和分析时,通常将b值设定为1000s/mm2,当b值高于1000s/mm2时,水分子扩散信号的衰减偏离线性,并且在复杂组织中因细胞器、细胞膜及间隔等诸多因素的影响,使得水分子扩散不呈高斯分布,此时采用DTI技术的水分子扩散模型来描述水分子的扩散衰减时将存在较大的误差。在这种情况下,研究水分子扩散不均质性的DKI技术能够更加有效地探测组织微观结构的变化[9]。已有较多学者将DKI技术应用于临床,如肿瘤的良恶性及恶性程度的鉴别诊断[10-11]。
由于采用的水分子扩散模型与DTI不同,DKI技术的评价指标也有所不同。平均峰度值(MK)是最常用的评价指标,通过探测水分子在组织内扩散受限的程度,来衡量感兴趣区组织的复杂程度,组织结构越复杂,水分子在组织内的扩散越偏离高斯分布,MK值越大。MK的绝对值在0~3的范围内,具有正负之分,由于MK值是各b值在各扩散梯度场施加方向上的平均值,当施加的扩散梯度场方向与水分子扩散方向的夹角在90°之内时,MK值为正值,反之,为负值。径向峰度(KR)和轴向峰度(KA)分别反映垂直于轴突方向及平行于轴突方向的水分子扩散信息。在本研究中,双侧豆状核的MK值与对照组间的差异有统计学意义,双侧尾状核头部的MK、KA及KR值与对照组间的差异均有统计学意义。有研究表明这些值的改变能够更敏感地反映细胞骨架崩解、线粒体肿胀所导致的细胞粘度及曲度的改变,可能反映了更加显著的组织结构改变[8,12]。
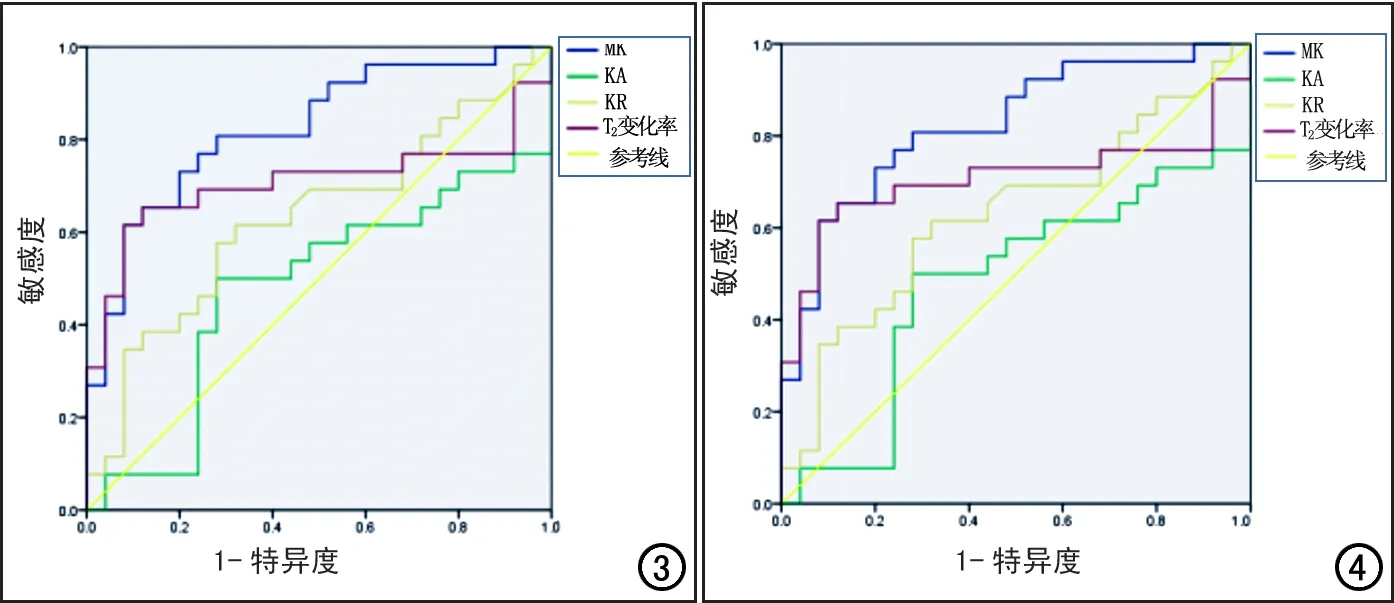
图3 双侧豆状核MK、KA、KR及T2变化率的ROC曲线。 图4 双侧尾状核头MK、KA、KR及T2变化率ROC曲线。
3.常规磁共振与DKI技术的对比分析
有学者曾利用常规MRI技术和DTI技术对WD疾病进行对照研究,如Lawrence等[13]和Jadav等[14]分别采用基于白质骨架的扩散统计分析(Tract-Based Spatial Statistics,TBSS)方法及手工勾画感兴趣区的方法进行分析,Lawrence等发现双侧额枕叶白质、内囊及脑桥FA降低,而这些区域在常规影像学上无明显变化;Jadav等发现部分患者在常规T2加权像上脑白质信号增高,而FA值和MD值的异常不仅出现在脑白质,在双侧内囊及脑桥等部位也可见。
肝豆状核变性是一种可治疗的遗传性疾病,因此早诊断早治疗对疾病的预后具有重要意义。本研究中通过ROC曲线分析发现,双侧豆状核的MK值的曲线下面积明显大于T2信号变化率,双侧尾状核头部的MK值和KA值的曲线下面积均大于T2信号变化率。说明DKI技术在检测肝豆状核变性患者大脑结构变化方面较常规MRI序列具有更高的敏感性及特异性,量化参数值能够更敏感地反映肝豆状核变性患者大脑组织微观结构的改变,为进一步探讨肝豆状核变性疾病脑组织结构的异常提供影像学依据。
本研究存在很多不足:首先,纳入研究的患者病程较长且均出现锥体外系的症状,分级在Ⅱ级以上,未能对疾病早期的大脑改变进行研究;另外,本组WD患者的病情严重程度差异较大、年龄和病程的跨度较大,因此研究结果的可重复性和稳定性尚需进一步研究和验证。在以后的研究中,我们将扩大样本量及搜集更多处于病程早期的患者进行更深入地研究,旨在对本病的诊断提供更加可靠的依据。
参考文献:
[1] Meenakshi-Sundaram S,Mahadevan A,Taly AB,et al.Wilson's disease:a clinico-neuropathological autopsy study[J].J Clin Neurosci,2008,15(4):409-417.
[2] Ala A,Walker AP,Ashkan K,et al.Wilson's disease[J].Lancet,2007,369(9559):397-408.
[3] Yoshida S,Oishi K,Faria AV,et al.Diffusion tensor imaging of normal brain development[J].Pediatr Radiol,2013,43(1):15-27.
[4] 黎规典,徐萍,周香雪,等.肝豆状核变性头部MRI表现及其与临床症状相关性分析[J].中风与神经疾病杂志,2013,30(8):731-733.
[5] Brito JC,Coutinho MA,Almeida HJ,et al.Wilson's disease:clinical diagnosis and "faces of panda" signs in magnetic resonance imaging:case report[J].Arq Neuropsiquiatr,2005,63(1):728-729.
[6] 颜立群,侯亚平,耿左军,等.Wilson病的脑部MRI表现及MRS变化[J].临床放射学杂志,2011,30(06):785-788.
[7] 刘勇,薛鹏,马秀华,等.脑型肝豆状核变性MRI诊断价值[J].中国实用神经疾病杂志,2014,8(1):94-95.
[8] Jensen JH,Helpern JA,Ramani A,et al.Diffusional kurtosis imaging:the quantification of non-gausian water diffusion by means of magnetic resonance imaging[J].Magn Reson Med,2005,53(6):1432-1440.
[9] Wu EX,Cheung MM.MR diffusion kurtosis imaging for neural tissue characterization[J].NMR Biomed,2010,23(7):36-48.
[10] 王莹莹,张焱,程敬亮,等.磁共振扩散峰度成像在乳腺良恶性病变鉴别诊断中的价值[J].放射学实践,2017,31(2):135-138.
[11] 谭朝元,杨晶,严开心,等.扩散峰度成像对高级别胶质瘤及单发脑转移瘤的鉴别诊断价值[J].放射学实践,2017,31(3):218-222.
[12] Jensen JH,Falangola MF,Hu C,et al.Preliminary observations of increased diffusional kurtosis in human brain following recent cerebral infarction[J].NMR Biomed,2011,24(5):452-457.
[13] Lawrence A,J Saini,Sinha S,et al.Improvement of diffusion tensor imaging (DTI) parameters with decoppering treatment in Wilson's disease[J].JIMD Rep,2015,21(1):1-7.
[14] Jadav R,Saini J,Sinha S,et al.Diffusion tensor imaging (DTI) and its clinical correlates in drug naive Wilson's disease[J].Metab Brain Dis,2013,28(3):455-462.
