丝切蛋白1表达水平与原发性肝细胞肝癌患者预后的相关性
2018-05-04张春燕郭奕超王蓓丽潘柏申
赵 瀛, 张春燕, 郭奕超, 戴 谦, 王蓓丽*, 郭 玮, 潘柏申,2
1. 复旦大学附属中山医院检验科,上海 200032 2. 复旦大学附属中山医院厦门医院检验科,厦门 361015
原发性肝细胞肝癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,约占肝癌的80%,恶性程度高,患者生存率较低[1]。2016年的全球数据表明,肝癌发病率在所有恶性肿瘤中排名第4位,死亡率位居第2位[2]。目前HCC最有效的治疗手段仍然是手术。但HCC患者早期症状不典型,确诊时一般处于中晚期,基本丧失了手术机会或手术预后不佳。因此,寻找有效的早期诊断及预后判断生物标志物是HCC临床诊治的关键。
肿瘤转移是肿瘤致死的主要原因,在肿瘤早期就已存在,与肿瘤的基因编码改变有关[3],且在病变极早期就可通过血行转移[4],与肿瘤细胞动力密切相关。丝切蛋白1(cofilin 1)是一种肌动蛋白结合蛋白,能调控细胞伪足的形成过程,是调控细胞动力的重要环节,与胃癌[5]、前列腺癌[6]和乳腺癌[7]等多种肿瘤的预后密切相关。我们的预实验发现HCC患者循环肿瘤细胞(circulating tumor cells,CTC)与HCC组织细胞中cofilin 1蛋白表达存在显著差异,提示cofilin 1蛋白表达与HCC预后相关。因此,本研究进一步探讨HCC组织cofilin 1蛋白表达水平与患者预后的相关性,为HCC的临床诊治提供新的研究靶标,改善患者预后。
1 资料与方法
1.1 一般资料 选取2012年12月至2014年5月确诊为HCC,并于复旦大学附属中山医院接受肝癌切除术的126例患者作为研究对象。其中,男性101例,女性25例;年龄(54±11)岁,>50岁73例、小于或等于50岁53例,患者人口学特征及基线资料详见表1。根据所选病例手术切除标本病理号将其相应的石蜡包埋标本取出,挑选组织完整清晰的部分。本研究通过复旦大学附属中山医院伦理委员会审核批准,所有患者均知情同意并签署知情同意书。
1.2 免疫组织化学染色 HCC组织切片在二甲苯脱蜡、乙醇水化后,置于抗原修复液(50×EDTA 抗原修复液,江苏凯基生物技术股份有限公司)中微波修复9 min,3%过氧化氢溶液中浸泡15 min以抑制内源性过氧化物酶活性;PBS漂洗3次,5%牛血清白蛋白(BSA)室温封闭30 min,加入小鼠抗人cofilin 1单克隆抗体(一抗,OriGene Technologies),4℃孵育过夜。PBS代替一抗,作为空白对照。次日PBS 漂洗3 次,加入辣根过氧化物酶标记的山羊抗小鼠IgG(二抗,工作液体积稀释比例为1∶5 000,OriGene Technologies),室温孵育60 min。DAB显色液(福州迈新生物技术开发有限公司)显色8 min,苏木精对比染色20 s,乙醇脱水,二甲苯透明,中性树胶固封。
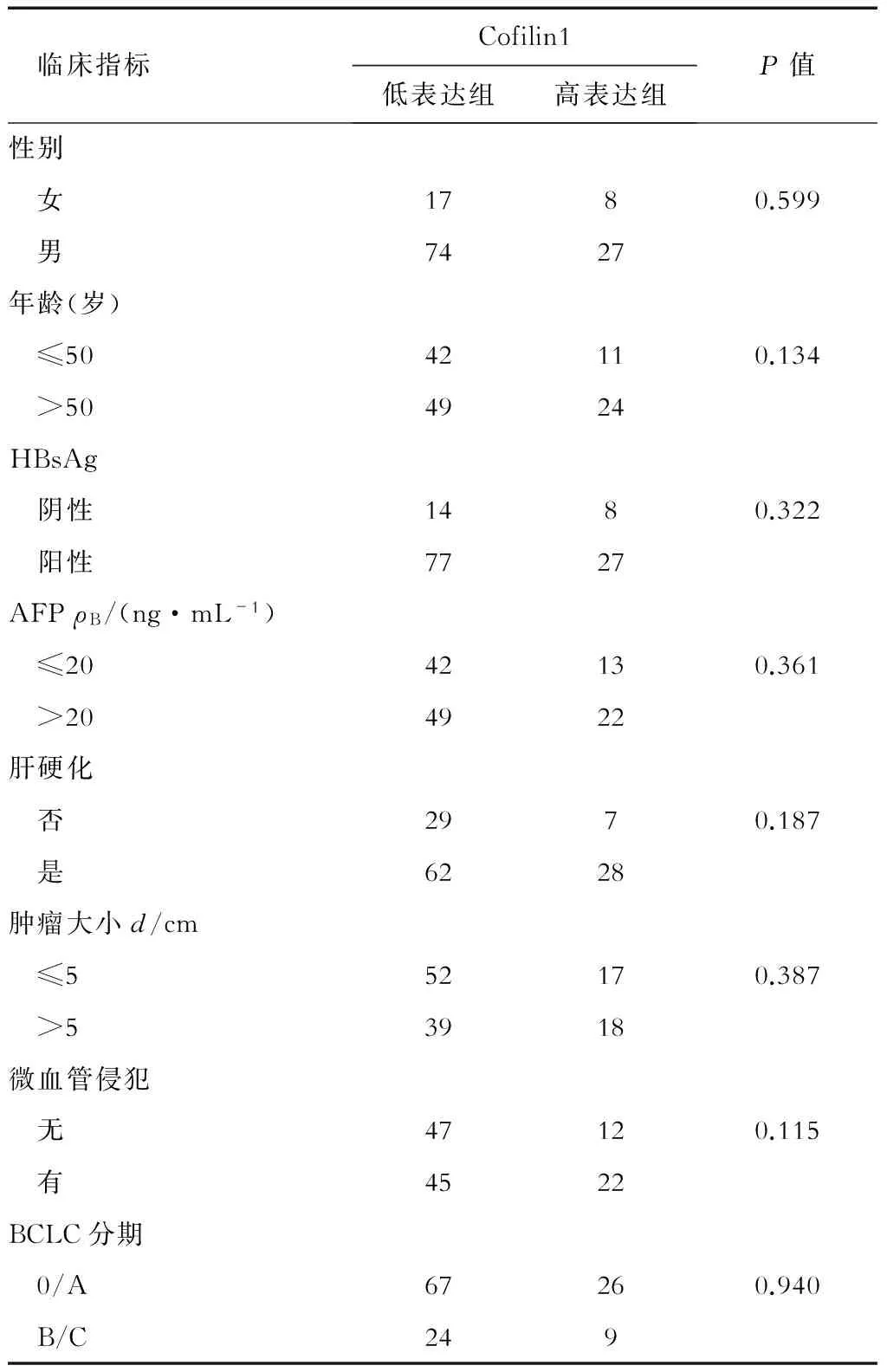
表1 两组患者人口学特征及基线资料比较 n, N=126
AFP:甲胎蛋白;BCLC分期:巴塞罗那临床肝癌分组方案
1.3 染色结果判定标准 采用Pannoramic Viewer软件对细胞染色结果进行检测和半定量评分。细胞质内出现棕黄色颗粒,判断为cofilin 1阳性细胞。根据染色强度(强,3分;中,2分;弱,1分;无,0分)和阳性细胞百分率(4分,>80%;3分,51%~80%;2分,11%~50%;1分,≤10%;0分,无阳性细胞)的乘积计算总评分[8](图1)。总分8分及以上列为cofilin 1高表达组,未达8分则为cofilin 1低表达组。
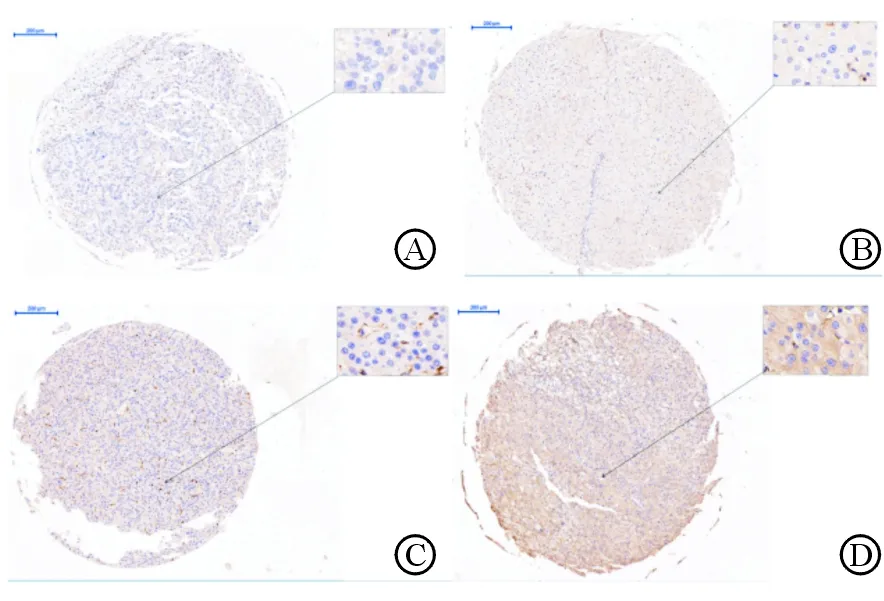
图1 免疫组织化学染色评分标准(DAB染色)
A: 0分; B: 1分; C: 2分; D: 3分. Original magnification: ×160(基础图片), ×1 100(放大部分)
1.4 统计学处理 采用SPSS 19.0和GraphPad prism 6软件进行统计分析。采用Spearman相关分析法分析cofilin 1蛋白表达与HCC患者临床参数的相关性。采用生存分析法绘制无病生存(disease-free survival,DFS)与总生存(overall survival,OS)曲线图,探讨cofilin 1蛋白表达与HCC患者术后复发或生存相关性。采用Cox回归风险比例模型分析影响HCC患者在肿瘤切除术后生存与早期复发的独立危险因素,计算风险比(hazard ratio, HR)和95%可信区间(confidence interval,CI)。检验水准(α)为0.05。
2 结 果
2.1 肝癌组织cofilin 1蛋白的表达 免疫组织化学染色结果(图2)表明:HCC组织cofilin 1高表达组35例;cofilin 1蛋白低表达组91例。
2.2 Cofilin 1蛋白表达与HCC患者临床参数的Spearman相关性 结果(表2)表明:cofilin 1蛋白表达评分与患者术前甲胎蛋白(α-fetoprotein,AFP)水平、肿瘤大小及巴塞罗那临床肝癌分组方案(BCLC分期)正相关,差异有统计学意义(P<0.05);而cofilin 1蛋白表达评分与术后AFP水平、术前术后γ-谷氨酰转肽酶(γ-glutamyltranspeptidase, γ-GT)、谷氨酸氨基转移酶(alanine aminotransferase,ALT)、乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、肿瘤包膜完整性和肝硬化及血管侵犯等临床指标无明显相关性。
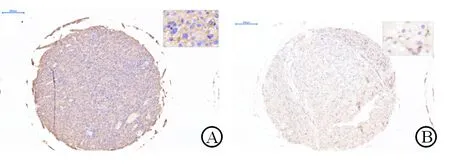
图2 免疫组织化学染色测定肝癌组织cofilin 1蛋白的表达(DAB染色)
A: 肝癌组织cofilin 1蛋白高表达; B:肝癌组织cofilin 1蛋白低表达. Original magnification: ×160(基础图片), ×1 100(放大部分)
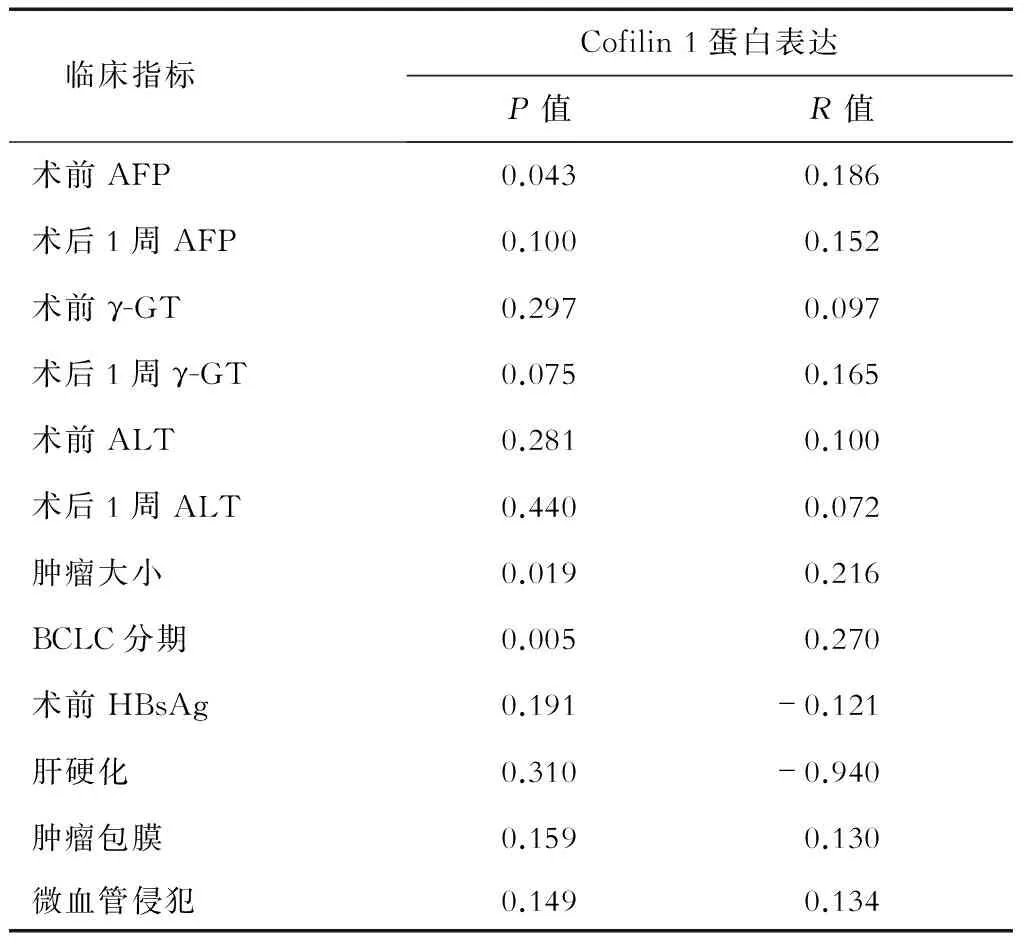
表2 Cofilin 1蛋白表达评分与HCC患者临床参数的Spearman相关性分析 N=126
AFP:甲胎蛋白;γ-GT:γ-谷氨酰转肽酶;ALT:谷丙转氨酶;BCLC分期:巴塞罗那临床肝癌分组方案
2.3 Cofilin 1蛋白表达水平与HCC患者术后复发的相关性 结果(图3)表明:cofilin 1高表达患者术后DFS明显短于低表达组,差异有统计学意义(P=0.000 1)。临床亚组分析结果表明:BCLC分期0/A期亚组(P=0.000 4)和肿瘤直径<5 cm亚组(P=0.000 1)中cofilin 1高表达患者术后DFS明显短于低表达患者;而AFP<20 ng/mL亚组(P=0.050 0)和未侵袭亚组(P=0.179 3)中cofilin 1高低表达患者术后DFS差异无统计学意义。
A:全组(P=0.000 1); B: BCLC分期0/A期亚组(P=0.000 4); C:肿瘤直径<5 cm亚组(P=0.000 1);D:AFP<20 ng/mL亚组(P=0.05); E:未侵袭亚组(P=0.179 3)
2.4 Cofilin 1蛋白表达水平与HCC患者生存情况的相关性 结果(图4)表明:Cofilin 1蛋白低表达组HCC患者术后OS明显长于高表达组患者(P=0.004 1);临床亚组分析结果表明:BCLC分期0/A期亚组(P=0.001 3)和肿瘤直径<5 cm亚组(P=0.006 0)cofilin 1蛋白低表达组HCC患者术后OS时间明显长于高表达组患者(P=0.006 0),而在AFP<20 ng/mL亚组(P=0.324 8)和未侵袭亚组(P=0.075 5)中差异无统计学意义。
2.5 HCC患者术后复发与生存的危险因素分析 Cox回归风险比例模型单因素分析(表3)发现:cofilin 1蛋白表达高低对患者术后复发有预测价值(P=0.025),肝硬化、肿瘤直径大于5 cm、微血管侵犯和CTC高是预后不良的复发因素(P<0.05);cofilin 1蛋白表达高低对患者术后生存也有预测价值(P=0.004),肿瘤直径>5 cm及BCLC分期为B/C是影响术后生存的显著因素(P<0.05)。
多因素分析结果(表3)显示:cofilin 1蛋白高表达(HR=1.647,95%CI 1.015~2.672)、肝硬化(HR=2.044, 95%CI 1.133~3.688)、肿瘤直径大于5 cm(HR=1.989,95%CI 1.235~3.203)和高CTC(HR=1.795,95%CI 1.015~3.173)是导致HCC患者肝癌切除术后复发的独立危险因素;而cofilin 1蛋白高表达(HR=2.412,95%CI 1.696~4.940)和肿瘤直径>5 cm(HR=2.461,95%CI 1.367~4.429)是术后生存的独立危险因素。
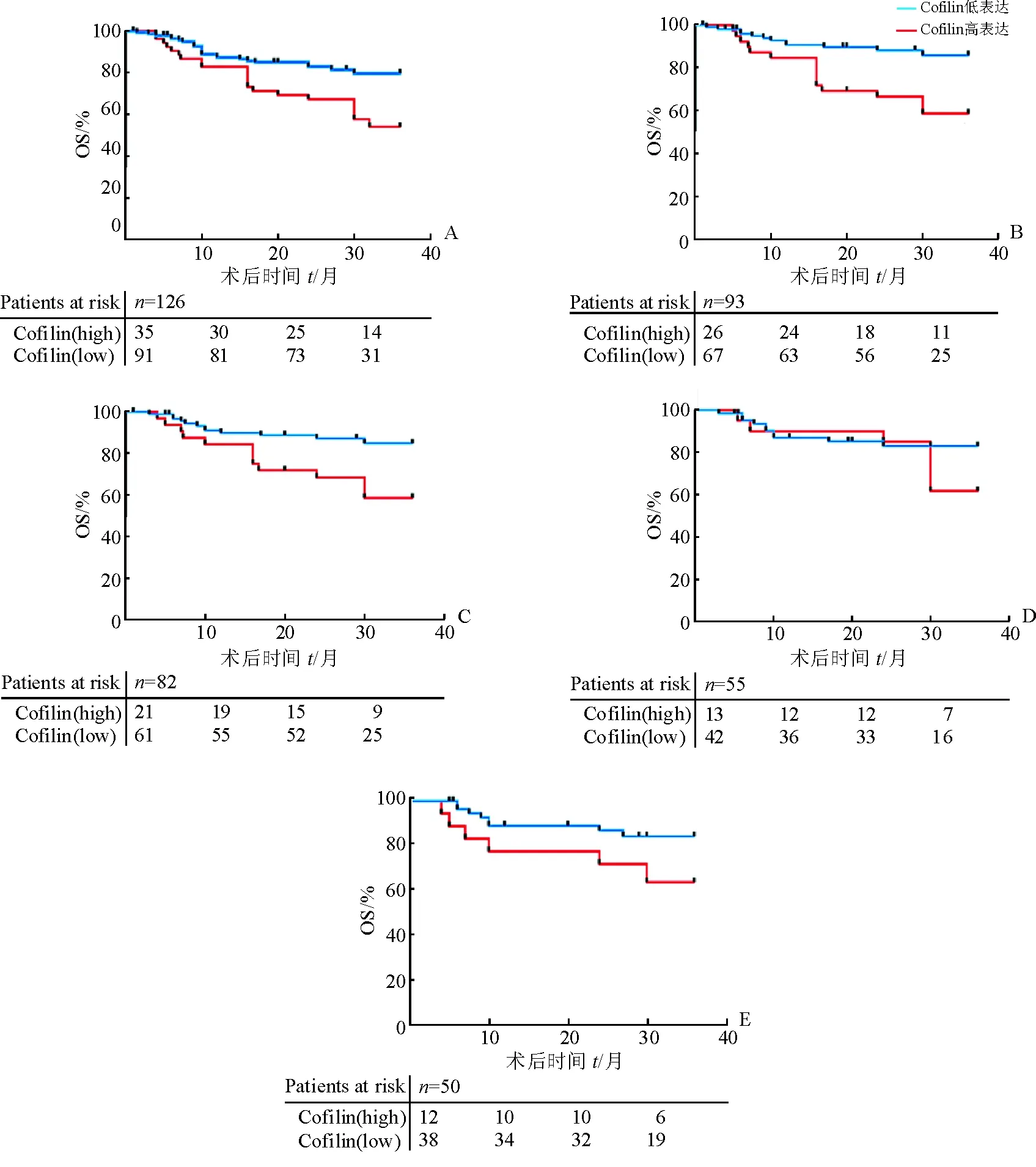
图 4 Cofilin 1蛋白表达水平与各组HCC患者术后生存情况的相关性
A:全组(P=0.004 1); B: BCLC分期0/A期亚组(P=0.001 3); C:肿瘤直径<5 cm亚组(P=0.006 0); D: AFP<20 ng/mL亚组(P=0.324 8); E:未侵袭亚组(P=0.075 5)
3 讨 论
CTC作为肿瘤原发灶播散的“种子”,在肿瘤复发及转移的过程中发挥重要作用[9]。本课题组预实验发现,CTC可作为HCC诊断及预后的标志物;通过对CTC高与CTC低的两组HCC患者原发灶的表达谱芯片进行筛选,发现两组HCC患者cofilin 1表达差异显著,提示cofilin 1可能是导致CTC释放入外周血的关键分子,具有重大的研究价值及意义。因此,本研究旨在验证cofilin 1在HCC根治术后疗效监测和预后评估中的价值。
本研究入组了2012年12月至2014年5月于复旦大学附属中山医院接受肝癌切除术的HCC患者126例,对患者术后的组织芯片进行免疫组织化学染色,并对相关指标进行回顾性分析。结果发现,cofilin 1表达与患者术前AFP、肿瘤大小及BCLC分期相关。进一步利用Cox比例风险模型进行多因素分析发现:cofilin 1是HCC术后复发的独立预后危险因素;在一些低危亚组,如BCLC分期0/A期亚组和肿瘤<5 cm亚组中,cofilin 1高低表达的HCC患者发生肿瘤复发的差异仍有统计学意义(P<0.05)。本研究证实cofilin 1是良好的预后标志物,且在临床上对患者预后进行评估时,比BCLC分期及肿瘤大小更灵敏。
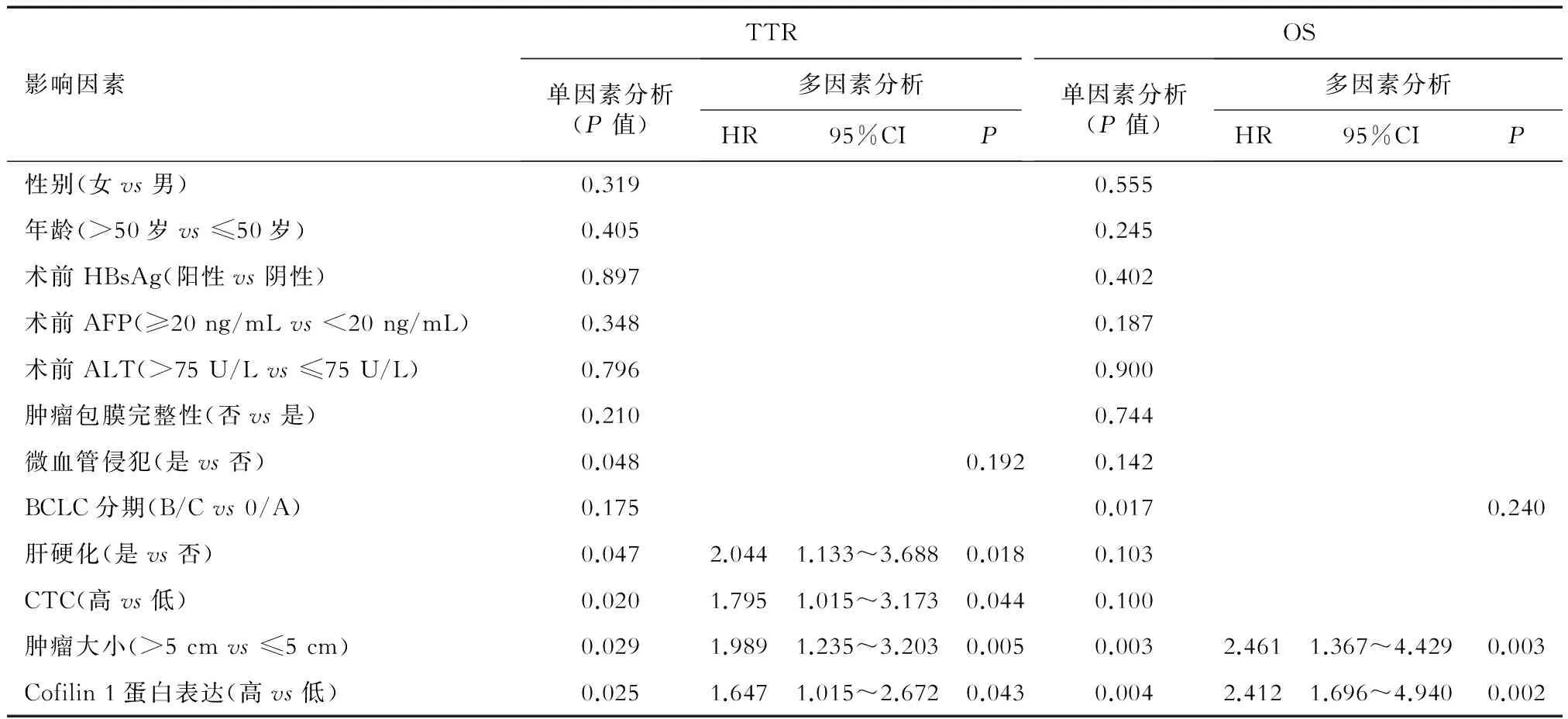
表3 HCC患者术后复发与生存的单因素及多因素风险分析
HR:风险比(hazard ratio);95%CI:95%可信区间;AFP:甲胎蛋白;ALT:谷氨酸氨基转移酶(alanine aminotransferase);HBsAg:乙型肝炎表面抗原(hepatitis B surface antigen);BCLC分期:巴塞罗那临床肝癌分组方案;TTR:复发时间(time to recurrence);OS:总生存时间(overall survival)
Cofilin 1主要通过肿瘤转移过程中细胞动力增强、细胞分裂和细胞转化启动对肿瘤细胞起到调控作用[10]。Wiskott Aldrich综合征蛋白家族、肌动蛋白相关2/3复合体和肌动蛋白单体主导着突触形成的过程[11],而cofilin 1对肌动蛋白单体起到关键的调控作用,提示cofilin 1是使肿瘤细胞从静止状态转变为运动状态的重要因素。
综上所述,在肝癌临床诊治中,cofilin 1可作为一个用来有效筛选具有较高复发风险患者的潜在指标,从而辅助临床采取相应措施,实施不同的治疗策略,制订个体化的医疗方案,实现精准医疗。在后续的研究中,本课题组会针对cofilin 1的上游调控因子及相应通路进行深入探索,并且进一步探讨cofilin 1与细胞运动相关的分子机制。
[ 1 ] FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[ 2 ] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1):7-30.
[ 3 ] WANG W, EDDY R, CONDEELIS J. The cofilin pathway in breast cancer invasion and metastasis[J].Nat Rev Cancer, 2007,7(6):429-440.
[ 4 ] JOYCE J A, POLLARD J W.Microenvironmental regulation of metastasis[J]. Nat Rev Cancer, 2009, 9(4):239-252.
[ 5 ] WANG H, TAO L, JIN F, et al. Cofilin 1 induces the epithelial-mesenchymal transition of gastric cancer cells by promoting cytoskeletal rearrangement[J].Oncotarget,2017,8(24):39131-39142.
[ 6 ] LU L I, FU N I, LUO X U, et al. Overexpression of cofilin 1 in prostate cancer and the corresponding clinical implications[J].Oncol Lett,2015,9(6):2757-2761.
[ 7 ] MAIMAITI Y, LIU Z, TAN J, et al. Dephosphorylated cofilin expression is associated with poor prognosis in cases of human breast cancer: a tissue microarray analysis[J].Onco Targets Ther,2016,9:6461-6466.
[ 8 ] SCHARL A, VIERBUCHEN M, CONRADT B, et al. Immunohistochemical detection of progesterone receptor in formalin-fixed and paraffin-embedded breast cancer tissue using a monoclonal antibody[J].Arch Gynecol Obstet,1990,247(2):63-71.
[ 9 ] VON FELDEN J, SCHULZE K, KRECH T, et al. Circulating tumor cells as liquid biomarker for high HCC recurrence risk after curative liver resection[J].Oncotarget,2017,8(52):89978-89987.
[10] SHISHKIN S, EREMINA L, PASHINTSEVA N, et al. Cofilin-1 and other ADF/Cofilin superfamily members in human malignant cells[J].Int J Mol Sci,2016,18(1). pii: E10.
[11] YANG C, SVITKINA T. Filopodia initiation: focus on the Arp2/3 complex and formins[J]. Cell Adh Migr, 2011, 5(5):402-408.
