高考化学实验题型梳理和解题策略
2018-05-04江西师范大学附属中学刘建阳
■江西师范大学附属中学 刘建阳
高考化学实验题主要以物质制备的基本原理和基本操作,以新物质的制备为主线,对实验基本操作和物质性质、化学原理进行考查,一般包括气体的制备和性质探究、实验探究题和综合性实验题等题型。近几年高考,还以物质制备为载体,明显加大了化工流程题型的考查。所以,在平时练习中要着重加强这些题型的基本内容和解题方法的梳理和巩固。
一、工业制备方法的典型考题
典例1 合成氨工业、硫酸工业的生产工艺流程大致为:

合成塔和接触室中的反应分别为:

(1)写出流程中设备的名称:B为____,X为____。
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是____。
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是____(填序号)。
①硫酸工业 ②合成氨工业
③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是____。
(5)工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是____。
答案:(1)循环压缩机 沸腾炉
(2)逆流换热(或充分利用反应中放出的热量加热反应气)
(3)①②③
(4)由于用稀硫酸或水吸收SO3时易形成酸雾,不利于SO3吸收
(5)(NH4)2SO4
点拨:对于第(3)问,只要在反应过程中使用的且在尾气处理器中还剩余的物质都可以循环利用,故选①②③;第(5)问,氨水吸收SO2后得到亚硫酸铵,用硫酸处理后得到硫酸铵和可循环使用的SO2。
典例2 我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意如下。

表1为部分物质的溶解性(室温)。

表1
(1)粗盐水中主要含有Ca2+、M g2+、SO2-4等杂质离子,工业上常用加入稍过量的Na OH溶液、Na2CO3溶液、Ba Cl2溶液及适量的盐酸等除杂、精制。则加入试剂合理的顺序为____、盐酸(只写一种)。加盐酸的作用是(用化学方程式表示)___、___。
(2)制碱原理:Na Cl+CO2+NH3+H2ONa HCO3↓+NH4Cl。该反应原理可看作是由以下两个反应加合而成,则其反应类型为____。
(3)X的化学式为____。
(4)Y是滤液中的主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为____,Y的化学式为____,写出Y的一种用途:___。
答案:(1)Na OH 溶液、Ba Cl2溶液、Na2CO3溶液 Na OH+HClNa Cl+H2O Na2CO3+2 HCl2 Na Cl+H2O+CO2↑ (2)复分解反应 (3)CO2(4)氨气
NH4Cl 制取氮肥
典例3 硝酸的工业制法是用氨氧化法制取,其法以氨和空气为原料,在催化剂的作用下,最后在吸收塔中用水吸收制取硝酸。其具体的工艺流程如下。

请回答下列问题:
(1)从吸收塔中出来的硝酸浓度大约是50%,不能直接用于军工、染料等工业,必须将其送入蒸馏塔制成98%以上的浓硝酸。某中学实验小组在实验室模拟蒸馏塔中对稀硝酸蒸馏时,应注意选择适宜的条件是____;原因是____。(请用化学方程式进行解释)
(2)在氧化炉中只发生主反应①和副反应②。
①4 NH3(g)+5 O2(g)4 NO(g)+6 H2O(g);ΔH=-905k J·mol-1
②4 NH3(g)+3 O2(g)2 N2(g)+6 H2O(g);ΔH=-1268k J·mol-1
试写出N2氧化为NO的热化学方程式:___。
(3)在氧化炉中催化氧化时,有关物质的产率与温度的关系如图1所示。

图1
据图1可知工业上氨催化氧化生成 NO时,应该控制温度在___左右,该反应所使用的催化剂是____。
温度高于900℃时,NO产率下降的可能原因是____。
(4)从氧化炉中出来的气体为什么不直接进入吸收塔,而是进入热交换器?这样做的优点是____。
(5)下列措施可提高氨催化氧化生成NO的产率的是____。
A.降低反应体系的压强
C.研究开发使用效果更好的催化剂
D.升高反应体系的温度

(2)N2(g)+O2(g)2 NO(g);ΔH=+181.5k J·mol-1
(3)800℃ 铂或铂铑合金
(4)这样做既可以降低NO和O2混合气的温度,又可以预热NH3和空气,达到节约能源的目的
(5)A、B
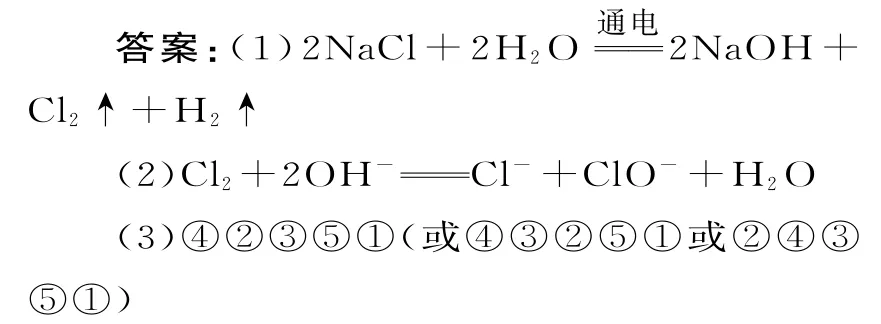
典例4 氯碱工业的流程及产物的部分转化关系如下,其中A、B、C、D、E分别表示一种或多种物质。

请回答下列问题:
(1)离子膜电解槽中发生反应的化学方程式为____。
(2)反应④的离子方程式为____。
(3)粗盐水精制的过程中可能用到①盐酸、②烧碱、③纯碱、④氯化钡、⑤过滤,添加试剂及操作的合理顺序是____(填序号)。
二、海水资源利用的典型考题
典例5 将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是____(填序号)。
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出B r2,并用纯碱吸收。碱吸收溴的主要反应是B r2+Na2CO3+H2O--→Na B r+Na B r O3+Na HCO3(未配平),吸收1molB r2时转移的电子为____mol。
(3)海水提镁的一段工艺流程如下。

浓海水的主要成分如表2。

表2
该工艺过程中,脱硫阶段主要反应的离子方程式为____,产品2的化学式为____,1L浓海水最多可得到产品2的质量为____g。
(4)采用石墨阳极。不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为____,电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式:___。


典例6 海带含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的仪器是____(从下列仪器中选择所需的仪器,把标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿
D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是____;步骤⑥的目的是从含碘苯溶液中分离出碘和回收苯,该步骤的实验操作名称是____。
(3)步骤④反应的离子方程式是____。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是____。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:___。
答案:(1)B、D、E
(2)过滤蒸馏
(3)2 I-+M n O2+4 H+M n2++I2+2 H2O
(4)苯与水互不相溶,碘在苯中的溶解度比在水中大
(5)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘)
三、晶体制备的典型考题
典例7 医疗上绿矾(Fe SO4·7 H2O)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下探究。
【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用图2所示装置制备Fe SO4·7 H2O晶体,步骤如下。

图2
(1)预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是____,然后将废铁屑用水洗涤2~3遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2,N2的作用是____。
(3)再加入足量稀硫酸,控制温度在50℃~80℃,充分反应后,圆底烧瓶中剩余的固体为____。实验室常用铁氰化钾溶液检验反应生成的Fe2+,写出该反应的离子反应方程式:____。
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤,____。滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存。
【测定Fe SO4·7 H2O含量】
(5)称取上述样品10.0g,溶于适量的稀硫酸中,配成100 m L溶液,准确量取25.00m L该液体于锥形瓶中,用0.1000mol·L-1KM n O4标准溶液滴定滴定3次,平均消耗10.00m L标准液,该样品中Fe SO4·7 H2O的质量分数为____。(已知Mr(Fe SO4·7 H2O)=278)
(6)若测量结果偏小,则可能是在定容时____(填“俯视”或“仰视”)读数。
答案:(1)洗去铁屑表面的油污
(2)排除装置中的空气或氧气
(3)Cu Fe2-+2 Fe(C N)36+Fe3[Fe(C N)6]2↓
(4)冷却结晶
(5)55.6% (6)仰视
典例8 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用图3所示装置制备少量无水氯化铝,其反应原理为2 A l+6 HCl(g)2 A l Cl3+3 H2。

图3
完成下列填空:
(1)写出烧瓶中(B处)发生反应的化学方程式:___。
(2)C中盛有的试剂为____。进行实验时应先点燃____(选填“B”或“D”)处酒精灯。
(3)用粗短导管连接D、E的目的是____(选填序号)。
a.防堵塞 b.防倒吸
c.平衡气压 d.冷凝回流
E瓶的作用是____。
(4)F中盛有碱石灰,其目的是____(选填序号)。
a.吸收 HCl b.吸收 Cl2
c.吸收 CO2d.吸收 H2O
(5)将D中固体改为市售氯化铝(A l Cl3·6 H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是____。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为A l2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为____。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变,也能制备无水A l Cl3。事实证明这样做比较危险,请简述理由:___。
答案:(1)Na Cl+H2SO4(浓)Na H SO4+HCl↑
(2)浓硫酸 B
(3)a 使A l Cl3冷凝,收集A l Cl3
(4)a、d
(5)抑制A l Cl3水解 4
(6)制得的Cl2中混有HCl,与A l反应生成H2,H2与Cl2混合加热时会发生爆炸
四、有机物制备的典型考题
典例9 实验室制备硝基苯的主要步骤如下。
①配制一定比例的浓硫酸和浓硝酸的混合酸加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50℃~60℃下发生反应。
④除去混合酸后,粗产品依次用蒸馏水和5%的Na OH溶液洗涤,最后用蒸馏水洗涤。
⑤将用无水氯化钙干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
(1)配制一定比例浓硝酸和浓硫酸混合酸时,操作注意事项是____。
(2)步骤③的加热方式是____。
(3)步骤④中,洗涤、分离粗硝基苯应使用的仪器是____。
(4)步骤④中,粗产品用5%的Na OH溶液洗涤的目的是____。
(5)现有三种实验装置,如图4所示,要制备硝基苯,应选用___。

图4
答案:(1)一定要将浓硫酸沿内壁缓缓注入盛有浓硝酸的烧杯中,并不断搅拌,冷却
(2)50℃~60℃水浴加热
(3)分液漏斗
(4)洗去粗产品中的酸性杂质
(5)C
典例10 制取肥皂的实验有以下步骤:
①在一个干燥的蒸发皿中加入植物油8m L、乙醇8m L、Na OH溶液4m L。
②在不断搅拌下,给蒸发皿中液体微微加热,直到混合物变稠。
③继续加热,直到皂化反应完成。
④把盛混合物的蒸发皿放在冷水浴中冷却。等待片刻,向混合物中加20m L热蒸馏水,再放在冷水中冷却。然后加入25 m L Na Cl饱和溶液充分搅拌。
⑤用纱布滤出固体物质,弃去滤液。把固体物质挤干,压成条状,晾干,即得肥皂。
根据实验,填空:
(1)在制肥皂时加入乙醇是利用了乙醇的什么性质:___。
(2)如何验证皂化反应已完成:____。
(3)在操作④中加入饱和Na Cl溶液的作用是____。
(4)写出硬脂酸甘油酯发生皂化反应的化学方程式:___。
(5)取用蒸发皿用的仪器是____。
(6)工业上大规模生产用水蒸气加热的优点是____。
答案:(1)植物油、Na OH溶液都能与乙醇混溶,加入乙醇可使植物油和Na OH溶液充分接触,有利于反应的进行
(2)取反应液,滴入热水中,若液面上无油滴,则说明水解已完成
(3)盐析,使肥皂析出

(5)坩埚钳
(6)受热均匀,温度便于控制,不易产生结焦现象
