蓝藻多糖的分离、结构表征及抗氧化活性研究
2018-05-03黄依佳
黄依佳
吴剑荣
朱 莉
詹晓北
(江南大学生物工程学院糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
由于工农业生产排放和环境气候的影响,水体的富营养化促使诸多湖泊中蓝藻快速生长,形成严重的蓝藻水华现象[1]。蓝藻又称蓝细菌,是最古老的藻类之一,具有结构简单、分布广泛、生长迅速等特点,是世界上各国湖泊中生长持续时间长和规模大的水华藻类之一[2]。蓝藻水华类主要含有微囊藻属(Microcystis)和鱼腥藻属(Anabaena),共计2属13种,其中微囊藻属是太湖水华的主要优势种类[3]。蓝藻的大规模生长将导致水体溶氧量降低等生态系统失衡,从而导致其他藻类和鱼类等产业的经济损失,也对水源水质形成破坏,造成饮用水危机[2]。目前,治理湖泊水系蓝藻水华的主要措施仍以打捞为主,主要应用包括堆肥和沼气发酵,但还未形成高附加值开发利用。
为有效处理打捞蓝藻以避免出现二次污染,并开发相应的加工工艺同时获得较高附加值产品。已有学者对蓝藻进行应用开发研究,如利用蓝藻厌氧发酵产沼气[4]、用于酵母蛋白生产、水解制备混合氨基酸、提取藻胆蛋白和天然色素[5]等。蓝藻细胞壁、荚膜和黏质组成的外层都含有丰富的多糖[4],其中蛋白质和多糖总量超过干重的70%以上。目前也有将干燥蓝藻粉用做生物塑料原料的专利,但是其中的多糖组分会影响塑料品质,塑料残留有部分臭味。天然多糖具有良好的生物活性和功能,包括抗肿瘤[6]、抗病毒[7]、免疫作用[6]和抗氧化作用[8]等。在对其他藻类如紫球藻[9]、马尾藻[10]、螺旋藻[11]的研究中,通过多种提取方法都得到了具有良好生物活性的藻类多糖。
目前已有包括太湖蓝藻和巢湖蓝藻的多糖提取研究。在蓝藻的多糖提取研究中,热水浸提由于提取过程简单、成本较低仍然是主要的提取方法,但单纯使用热水浸提方法存在提取得率低、原料利用率不足等缺点[12]。同时,对提取得到的蓝藻多糖结构,目前较多研究采用较为常用的方法进行分析[13],但仍需进一步对其单糖的糖苷键连接方式进行描述,以了解蓝藻多糖区别于其他具有生物活性多糖的结构特征。基于上述考虑,本研究主要以提高蓝藻多糖的提取得率和分析蓝藻多糖的结构特征为目标,进一步分析蓝藻多糖的抗氧化活性以明晰其潜在应用价值。
1 材料与方法
1.1 材料
填料DEAE Fast Flow、Sephadex G-100:美国GE公司;
蓝藻粉:无锡德林海公司;
1,1-二苯基-2-三硝基苯肼(DPPH)、1,10-菲咯啉:纯度>99%,美国Sigma公司;
其他试剂均为分析纯。
1.2 仪器与设备
高效液相色谱仪:1100型,美国安捷伦科技有限公司;
气相色谱仪:GC-2010AF型,日本岛津公司;
傅里叶变换红外光谱仪:NEXUS型,美国尼高力仪器公司;
核磁共振仪:Avance III型,德国Bruker公司。
1.3 方法
1.3.1 蓝藻多糖的分离纯化 采用超声波辅助热水浸提的方法[(经试验得出其最佳提取工艺为:超声400 W处理30 min,料液比1∶40 (g/mL),浸提温度80 ℃,浸提时间5 h]得到蓝藻粗多糖;用Savage法去蛋白,其中氯仿∶正丁醇(体积比)=4∶1,Savage试剂∶样液(体积比)=1∶1,处理时间为30 min,处理6次;5倍体积95%乙醇醇沉;冻干复溶,经0.45 μm滤膜过滤后经DEAE Fast Flow离子交换柱纯化,用水和不同浓度NaCl溶液洗脱,收集洗脱液并利用苯酚硫酸法检测多糖含量,收集的多糖于25 ℃下经透析后冷冻干燥,复溶为多糖溶液后由Sephadex G-100凝胶柱纯化,收集并检测多糖含量后,收集多糖主要组分CB-2-1,冻干用于后续结构分析和自由基清能力检测。
1.3.2 蓝藻多糖的单糖组成和相对分子质量测定 称取20 mg 冻干的纯化多糖样品,用2 mL 1 mol/L硫酸在沸水中水解2 h,用碳酸钡将pH调至6.5~7.0,离心(8 000 r/min,10 min)2次去除其中的不溶物,上清液加入1 mL的1 mg/mL 肌醇溶液作为内标,冷冻干燥的水解单糖加入0.5 mL 吡啶和10 mg盐酸羟胺,90 ℃加热30 min,加入0.5 mL 乙酸酐后90 ℃加热30 min,采用GC-MS分析[14],条件:AgiLentDB-5ms毛细柱管(30 m×0.25 mm×0.25 μL),载气He,流量1 mL/min,柱温60~250 ℃,程序升温5 ℃/min,进样量1 μL,进样器温度250 ℃。气-质谱连接通道温度为250 ℃。EI离子源温度200 ℃,电子能量70 eV。
纯化的蓝藻多糖溶于去离子水中(10 mg/mL),于8 000 r/min 离心5 min后,利用高效液相色谱检测多糖的相对分子质量,以相对分子质量为2.700,5.200,9.750,1.305,3.680 kDa 的葡聚糖作为标品进行计算。
1.3.3 红外光谱分析 取冻干的纯化多糖样品和粗多糖样品1~2 mg,分别加入适量溴化钾进行研磨,压片后,利用红外光谱在400~4 000 cm-1内进行检测[15]。
1.3.4 核磁共振(NMR)分析 取蓝藻多糖干燥样品CB-2-1组分50 mg,溶于5 mL D2O(99.8%)中,充分溶解,采用NMR分析获得1H谱和13C谱。
1.3.5 蓝藻多糖的抗氧化活性
(1) DPPH自由基清除率和还原力的测定:参照文献[16]。
(2) 羟自由基清除测定:参照文献[8]。
2 结果与分析
2.1 蓝藻多糖的分离纯化
蓝藻粗多糖首先经过离子交换层析(DEAE Fast Flow)进行分离纯化,结果见图1。蓝藻粗多糖经水和不同浓度NaCl溶液洗脱后得到3个多糖组分,其中由0.1 mol/L NaCl溶液洗脱得到的CB-2组分为主要组分。因此收集CB-2组分,透析,再利用Sephadex G-100凝胶柱进一步纯化。如图1(b) 所示,经凝胶柱分离后得到的CB-2-1组分较为均一,因此收集并冻干后用于后续结构和自由基清除能力的分析。

图1 蓝藻粗多糖的层析分离纯化Figure 1 Chromatographic purification of Cyanobacteria polysaccharide
2.2 蓝藻多糖的单糖组分和相对分子质量
比较蓝藻粗多糖和纯化多糖组分CB-2-1的单糖组成时发现,蓝藻多糖主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,见表1。纯化后,蓝藻多糖CB-2-1中的鼠李糖、葡萄糖的摩尔百分比明显下降,而其他单糖相比粗多糖有明显提高,其中甘露糖摩尔百分比由14.40%提高至51.38%,成为蓝藻多糖CB-2-1中的主要单糖。蓝藻多糖CB-2-1相对分子质量为8.4 kDa,与马尾藻多糖组分SPP-3-1和SPP-3-2相对分子质量相近[17]。不同藻类多糖中单糖组成具有较大差异,如石全见等[9]研究紫球藻多糖时发现,木糖、葡萄糖和半乳糖3种单糖最多;而在小球藻多糖[18]的单糖组成中,葡萄糖和半乳糖组分居多。由于蓝藻多糖是来源于混合微生物,因此其多糖组成也会变化较大。
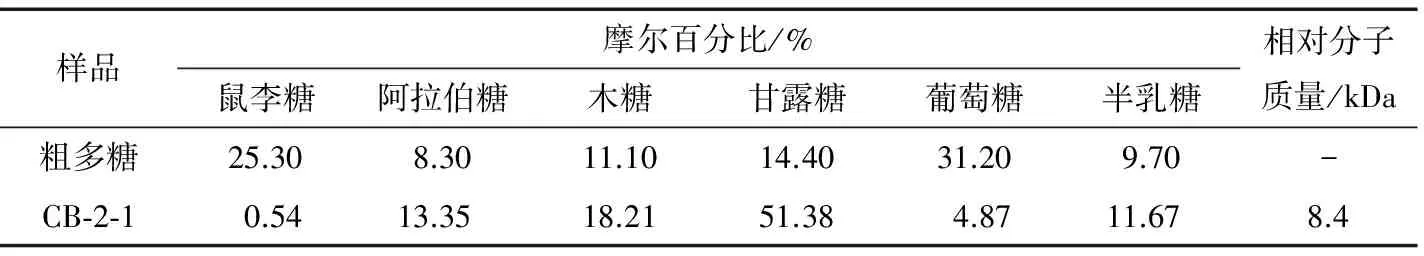
表1 蓝藻粗多糖与纯化多糖CB-2-1的单糖组成和相对分子质量Table 1 Molecular weight and monosaccharide composition of Cyanobacteria polysaccharide and polysaccharide CB-2-1
2.3 蓝藻多糖CB-2-1的红外光谱分析
蓝藻多糖CB-2-1的FTIR光谱分析见图2。吸收峰在3 600~3 000,2 000~2 800,1 400~1 200,1 200~700 cm-1是特征吸收峰。多糖在3 384 cm-1的吸收峰是羟基的拉伸,在2 919 cm-1的吸收峰属于羰基振动,1 388 cm-1的吸收峰代表羧酸和羧基的对称伸缩振动,1 315,1 242 cm-1的吸收峰分别代表羧酸和C—O拉伸,在1 140 cm-1的吸收峰属于糖苷键(C—O—C)拉伸振动,吸收峰在922,759 cm-1属于D-吡喃葡萄糖环的不对称环振动。通过红外光谱分析结果可知,蓝藻多糖CB-2-1具有典型的多糖红外吸收峰[19]。
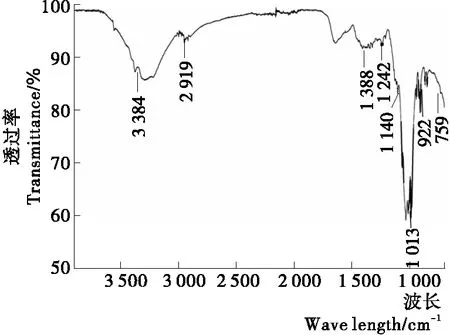
图2 蓝藻多糖CB-2-1的红外光谱图Figure 2 Infrared spectra of Cyanobacteria polysaccharide CB-2-1
2.4 蓝藻多糖CB-2-1的核磁共振分析
采用核磁共振对蓝藻多糖CB-2-1进行结构分析,结果见图3。在1H谱中,异头氢的化学位移出现5.35,5.31,5.17,同时还在4.99,4.59出现化学位移,表明CB-2-1同时含有α-和β-型糖苷键,并且α-型糖苷键的比例要高于β-型糖苷键[20]。在13C谱中,异头碳的化学位移大都小于101,大于101的异头碳信号比较微弱,与1H谱图结果具有相似性,即多糖CB-2-1的连接方式以α-型糖苷键为主,同时含有少量的β-型糖苷键[21]。此外,13C谱图在化学位移78~85时没有出现较强的响应信号,可能是由于在C-2、C-3、C-4位上并未发生取代。由于在化学位移177附近并没有检测到明显的信号,因此CB-2-1中不含有糖醛酸,这一结果与上述CB-2-1单糖组成的结果一致。
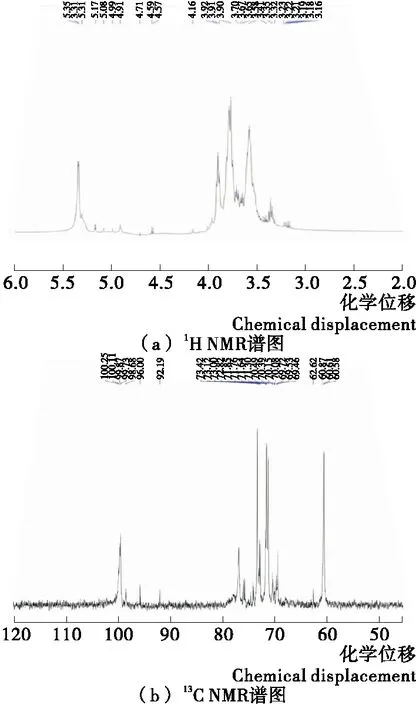
图3 蓝藻多糖CB-2-1的1H NMR谱图和13C NMR谱图Figure 3 1H NMR and 13C NMR spectra of Cyanobacteria polysaccharide CB-2-1
2.5 蓝藻多糖CB-2-1的抗氧化活性
在之前的报道[22]中,天然多糖都具有良好的抗氧化活性,包括体外多种自由基清除能力和还原力。在不同细胞模型试验中,胞内有氧代谢过程中会产生多种活性氧簇(ROS),包括超氧自由基、羟基自由基等[23-24],ROS的存在会造成胞内DNA损伤和影响胞内正常代谢等负面作用。多糖所具有的抗氧化活性尤其是自由基清除能力,可有效减少自由基对细胞造成的损伤。
2.5.1 DPPH自由基清除活性 为了进一步测试提取的蓝藻多糖在食品和饲料添加剂中应用的可行性,对其自由基清除能力进行测定。如图4所示,随着多糖浓度的增加,蓝藻粗多糖(CCB)对DPPH自由基的清除率逐渐增强;相比蓝藻粗多糖,纯化后的蓝藻多糖CB-2-1对DPPH自由基的清除率明显提高。当CB-2-1的浓度达到2 mg/mL时,DPPH自由基清除率达到最高(98.75%),与阳性对照VC的基本相同,而蓝藻粗多糖在相同浓度下清除率为65.30%。其他藻类来源的多糖也具有较好的自由基清除能力,如紫球藻提取的多糖也具有较好的DPPH自由基清除能力,在浓度为0.5 mg/mL 时清除率趋于稳定达到84%[9]。相比紫球藻多糖,蓝藻多糖CB-2-1具有更好的DPPH自由基清除能力。

图4 蓝藻多糖的DPPH自由基清除率测定Figure 4 DPPH scavenging activities of Cyanobacteria polysaccharide
2.5.2 还原力测定 在考察蓝藻多糖CB-2-1还原力的研究中发现,蓝藻粗多糖(CCB)和蓝藻纯化多糖组分CB-2-1总还原力随着浓度的增加而逐渐增强。当CB-2-1的浓度为2 mg/mL 时,其在700 nm 处的吸光值为0.616,而蓝藻粗多糖在相同浓度下吸光值为0.485,VC的吸光值达到1.629(见图5),蓝藻多糖经纯化后明显提高了多糖的总还原力。在相同多糖浓度下,Qiao等[25]从鱼腥草中所提取的HCPS多糖组分的还原力为0.451;Ye等[17]从马尾藻中提取的多糖SPP-1组分和SPP-3还原力为0.785和0.412;米酒多糖[16]和番茄多糖[19]的还原力分别为0.494,0.49。与其他来源多糖相比,蓝藻多糖具有较好的还原力。
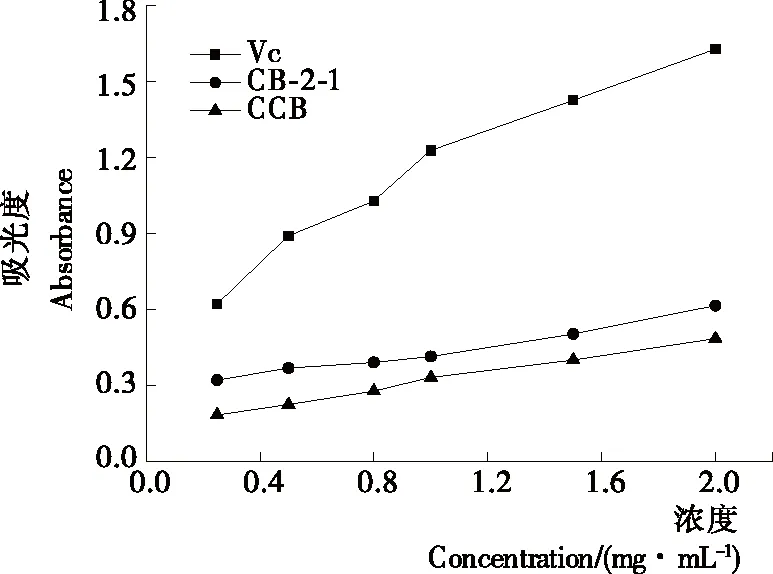
图5 蓝藻多糖的还原力测定Figure 5 Reducing power capacity of Cyanobacteria polysaccharide
2.5.3 羟基自由基清除率 羟基自由基是活性氧的一种,对细胞内的DNA、细胞器和细胞膜具有损伤作用,多种植物多糖都具有良好的羟基自由基清除能力。由图6可知,随着浓度的增加,蓝藻粗多糖(CCB)和蓝藻纯化多糖组分CB-2-1对羟基自由基清除率增强,多糖纯化后对羟基自由基的清除率明显提高。当CB-2-1的浓度为1.6 mg/mL时,羟基自由基的清除率为72.64%,而蓝藻粗多糖在相同条件下清除率为48.45%,VC的自由基清除率则达到98.0%。其他藻类多糖也具有较好的羟基自由基清除能力,如Chen等[26]从蔷薇藻中提取的多糖CEP和DEPS组分在1.6 mg/mL时,羟基自由基清除率分别为40.13%,37.62%。当CB-2-1的浓度为2 mg/mL 时,羟基自由基的清除率为77.9%,而CCB在相同浓度下清除率为60.6%;Qiao等[25]从鱼腥草中所提取的HCPS-3组分和HCPS在浓度为2 mg/mL时,羟基自由基清除率为89.51%,62.99%;此外,裙带菜孢子叶多糖和巴夫藻多糖[27-28]亦有较高的羟基自由基清除能力。太湖蓝藻多糖具有较高的羟基自由基清除率,在未来可应用于相关动物营养领域。

图6 蓝藻多糖的羟基自由基清除率Figure 6 Hydroxyl radicals scavenging activities capacity of Cyanobacteria polysaccharide
3 结论
本试验针对蓝藻多糖建立了超声辅助热水浸提、层析分离纯化得到蓝藻多糖主要组分CB-2-1,在分析该多糖主要单糖和摩尔百分比的基础上,了解单糖间主要连接方式以α-型糖苷键为主。蓝藻多糖组分CB-2-1具有较高的自由基清除能力和还原力,可以作为抗氧化剂应用于动物营养、饲料等领域,显示了蓝藻多糖具有良好的潜在应用价值。在后续工作中,可采用1H-1H、1H-13C和13C-13C等二维核磁质谱方法进一步表征太湖蓝藻多糖的结构特征,探索太湖蓝藻多糖区别于其他多糖的结构。此外,针对蓝藻多糖具有的良好抗氧化活性和自由基清除能力,可进一步考虑开展基于蓝藻多糖的天然防腐剂的相关研究,并在细胞或动物模型上考察蓝藻多糖的安全性和生物活性,为最终实现蓝藻多糖的开发和利用提供依据。
[1] 黄泽波, 刘永定.蓝细菌多糖及其应用研究概况[J].生物技术通报, 1997(4): 26-32.
[2] 李媛, 张家卫, 魏杰, 等.我国蓝藻水华的发生机理、危害及防控利用研究进展[J].微生物学杂志, 2015, 35(4): 93-97.
[3] 胡碧洋, 赵蕾, 周文静, 等.我国水华蓝藻资源化研究现状、问题与对策[J].水生态学杂志, 2012, 33(3): 138-143.
[4] 韩士群, 严少华, 王震宇, 等.太湖蓝藻无害化处理资源化利用[J].自然资源学报, 2009, 24(3): 431-438.
[5] 杨海麟, 李克朗, 张玲, 等.蓝藻资源无害化利用技术的研究[J].生物技术, 2008, 18(6): 95-98.
[6] 谢苗, 钟剑霞, 甘纯玑.海藻多糖的药用功能与展望[J].中国药学杂志, 2001, 36(8): 11-14.
[7] 陈家童, 张斌, 白玉华, 等.红藻多糖抗AIDS病毒作用的体外实验研究[J].南开大学学报: 自然科学版, 1998, 31(4): 22-26.
[8] SUN Li-qin, WANG Chang-hai, SHI Quan-jian, et al.Preparation of different molecular weight polysaccharides fromPorphyridiumcruentumand their antioxidant activities[J].Int J Biol Macromol, 2009, 45(1): 42-47.
[9] 石全见, 孙利芹, 周妍, 等.紫球藻胞外多糖抗氧化和免疫调节活性的研究[J].海洋通报, 2009, 28(5): 85-90.
[10] 叶红, 吴涛, 周春宏.马尾藻多糖提取工艺的优化[J].食品研究与开发, 2006, 27(7): 22-25.
[11] 薛志勇.螺旋藻多糖的研究及应用[J].山东食品科技, 2004, 6(8): 5-6.
[12] 印小燕, 王峰, 崔正刚.水溶性藻多糖的提取分离[J].应用化工, 2011, 40(3): 387-391.
[13] 李志平, 张弛, 周维清, 等.巢湖蓝藻酸性多糖的理化性质及其体外抗氧化作用[J].食品科学, 2015, 36(5): 7-12.
[14] PENG Lin, QIAO Shuang-kui, XU Zheng-hong, et al.Effects of culture conditions on monosaccharide composition ofGanodermalucidumexopolysaccharide and on activities of related enzymes[J].Carbohyd Polym, 2015, 133: 104-109.
[15] ROSS K, SIOW Y, BROWN D, et al.Characterization of water extractable crude polysaccharides from cherry, raspberry, and ginseng berry fruits: chemical composition and bioactivity[J].Int J Food Prop, 2015, 18(3): 670-689.
[16] QUE Fei, MA Lin-chun, PAN Xin, et al.Antioxidant activities of five Chinese rice wines and the involvement of phenolic compounds[J].Food Res Int, 2006, 39(5): 581-587.
[17] YE Hong, WANG Ke-qi, ZHOU Chun-hong, et al.Purification, antitumor and antioxidant activities in vitro of polysaccharides from the brown seaweedSargassumpallidum[J].Food Chem, 2008, 111(2): 428-432.
[18] 刘四光, 李文权, 邓永智, 等.自养小球藻中多糖PCA1的化学结构研究[J].厦门大学学报: 自然版, 2007, 46(5): 679-683.
[19] WU Qiong-ying, QU Hong-sen, JIA Jun-qiang, et al.Characterization, antioxidant and antitumor activities of polysaccha-rides from purple sweet potato[J].Carbohyd Polym, 2015, 132: 31-40.
[20] MARIA L, NAGILA MPSR, FRANK H, et al.Isolation and characterization of polysaccharides fromAgaricusblazeiMurill[J].Carbohyd Polym, 2005, 60(1): 43-49.
[21] KAUSIK C, UTPAL A, PATRICE L, et al.Polysaccharides from Caulerparacemosa: Purification and structural features[J].Carbohyd Polym, 2007, 68(3): 407-415.
[22] 张乔会, 王建中, 逄锦慧, 等.杜香多糖的抗氧化活性及物理性质研究[J].食品与机械, 2015, 31(5): 206-209.
[23] LU Jian-ming, LIN Peter-H, YAO Qi-zhi, et al.Chemical and molecular mechanisms of antioxidants: experimental approaches and model systems[J].J Cell Mol Med, 2010, 14(4): 840-860.
[24] FORMAN H J, TORRES M, FUKUTO J.Redox signaling[J].Mol Cell Biochem, 2002, 234-245(1/2): 49-62.
[25] QIAO De-liang, KE Chun-ling, HU Bing, et al.Antioxidant activities of polysaccharides fromHyriopsiscumingii[J].Carbohyd Polym, 2009, 78(2): 199-204.
[26] CHEN Bi-lian, YOU Wen-lang, HUANG Jian, et al.Isolation and antioxidant property of the extracellular polysaccharide fromRhodellareticulate[J].World J Microbiol Biotechnol, 2010, 26(5): 833-840.
[27] 董秀芳, 李楠, 韩冬, 等.裙带菜孢子叶多糖的超声辅助提取工艺优化及其抗氧化活性研究[J].食品与机械, 2015, 31(4): 162-166.
[28] 王凌, 孙丽芹.绿色巴夫藻多糖及降解产品的抗氧化和保湿性能[J].食品科学, 2012, 33(21): 87-90.
