扁桃果皮熊果酸提取工艺优化及体外抗氧化活性研究
2018-05-03张俊
张 俊
李 进1,2,3
吕海英1,2,3
马 雪1,2,3
(1.新疆特殊环境物种保护与调控生物学实验室,新疆 乌鲁木齐 830054;2.新疆师范大学干旱区植物逆境生物学重点实验室,新疆 乌鲁木齐 830054;3.新疆师范大学生命科学学院,新疆 乌鲁木齐 830054)
扁桃(AmygdaluscommunisL.),蔷薇科(Rosaceae)桃属(AmygdalusL.)乔木,是世界上著名的干果树种[1]。扁桃果仁富含不饱和脂肪酸、人体必需氨基酸、多种维生素、钙、镁、钠、铁、硒、钡、铬等元素[2]。中国扁桃的规模化生产主要集中在新疆的喀什与和田地区[3],作为新疆地区的特色果品。在其加工过程中果皮一般作为废弃物丢弃,或作为牛羊饲料,使资源严重浪费,给环境造成一定污染。
研究[4]表明,扁桃果皮乙醇提取物中含有熊果酸。熊果酸广泛存在于山茱萸、山楂、枇杷叶、女贞子、苦丁茶等多种天然植物中[5],具有抗氧化[6]、保肝[7]、抗炎[8]、抑菌[9]、降血脂[10]、抗肿瘤[11]等多种生物学功能,因而被广泛地用于医药及保健食品等领域[12]。目前,对扁桃果皮熊果酸的相关研究较少,已有研究中,李维霞等[4]对扁桃果皮熊果酸进行超声波提取,采用高效液相色谱测定了熊果酸的含量,但关于扁桃果皮熊果酸乙醇浸提工艺及其抗氧化活性研究还未见报道。本研究拟以扁桃果皮为原料提取熊果酸,在单因素试验基础上,利用正交试验优化提取工艺,并对扁桃果皮熊果酸体外抗氧化活性进行评价,为提高扁桃果皮的开发利用、增加其附加值提供参考。
1 材料与方法
1.1 材料与试剂
扁桃果皮:采自新疆莎车县扁桃种植区;
1,1-苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH):纯度≥99%,美国Sigma公司;
抗坏血酸:纯度≥98%,上海蓝季科技发展有限公司;
熊果酸标准品:纯度≥98%,上海源叶生物科技有限公司;
其他试剂均为分析纯。
1.2 主要仪器设备
旋转蒸发仪:RV10型,德国IKA集团;
真空干燥箱:ZK-82A型,上海市实验仪器总厂;
循环水式真空泵:SHB-III型,上海申胜生物技术有限公司;
台式离心机:TDL-60-B型,长沙湘仪仪器离心机有限公司;
紫外可见分光光度计:UV-2800型,上海龙尼柯仪器有限公司。
1.3 试验方法
1.3.1 提取工艺流程
扁桃果皮→干燥粉碎→过筛(40目)→乙醇浸提→抽虑→浓缩(蒸干乙醇)→加入蒸馏水→静置→离心沉淀(3 000 r/min,10 min)→干燥(50 ℃)→粗熊果酸
1.3.2 扁桃果皮熊果酸含量测定 参考李莹等[13]的方法,准确吸取0.1 mL扁桃果皮熊果酸提取液测定熊果酸含量,根据标准曲线方程y=0.067x-0.003 3(R2=0.997 8),按式(1) 计算扁桃果皮提取液中熊果酸得率。
(1)
式中:
Y——熊果酸得率,%;
C——标熊果酸质量浓度,mg/mL;
V0——移取液定容体积,mL;
V1——提取液定容后的体积,mL;
V2——移取液体积,mL;
m——扁桃果皮干粉的质量,g。
1.3.3 扁桃果皮熊果酸提取单因素试验
(1) 乙醇浓度:准确称取2.0 g扁桃果皮,按料液比1∶20 (g/mL),提取温度75 ℃,提取时间1.5 h,乙醇浓度分别为65%,70%,75%,80%,85%,考察不同乙醇浓度对扁桃果皮熊果酸得率的影响。
(2) 料液比:准确称取2.0 g扁桃果皮,乙醇浓度75%,提取温度75 ℃,提取时间1.5 h,液料比分别为1∶10,1∶15,1∶20,1∶25,1∶30 (g/mL),考察料液比对扁桃果皮熊果酸得率的影响。
(3) 提取温度:准确称取2.0 g扁桃果皮,乙醇浓度75%,按料液比1∶20 (g/mL),提取时间1.5 h,提取温度分别为65,70,75,80,85 ℃,考察提取温度对扁桃果皮熊果酸得率的影响。
(4) 提取时间:准确称取2.0 g扁桃果皮,乙醇浓度75%,液料比1∶20 (g/mL),提取温度75 ℃,提取时间分别为1.0,1.5,2.0,2.5,3.0 h,考察提取时间对扁桃果皮熊果酸得率的影响。
1.3.4 扁桃果皮熊果酸提取正交试验 在单因素试验基础上,设计L9(34)正交试验优化提取条件,分别考察乙醇浓度、液料比、提取温度、提取时间对扁桃果皮熊果酸得率的影响。
1.3.5 扁桃果皮熊果酸体外抗氧化活性测定
(1) 还原能力测定:参考文献[14],再以相同浓度的VC溶液作阳性对照,还原能力计算按式(2):
H=A1-A2,
(2)
式中:
H——还原能力;
A1——样品吸光度;
A2——空白组吸光度。
(2) 清除DPPH·能力:参考文献[15~16],用无水乙醇配制0.2 nmol/L的DPPH溶液。准确吸取2 mL不同浓度的样品溶液,分别加入2 mL DPPH溶液,混匀,室温避光静置30 min,于517 nm处测定吸光度。空白组以DPPH溶液代替样品溶液,对照组用无水乙醇代替DPPH溶液,平行测定3次,取平均值。以相同浓度的VC溶液作阳性对照,按式(3) 计算DPPH·的清除率。
(3)
式中:
R——自由基清除率,%;
A1——样品吸光度;
A2——对照组吸光度;
A0——空白组吸光度。
(3) 清除·OH能力:参考文献[17~18]的方法并略作修改,取1 mL不同浓度的样品溶液,依次加入1 mL 9 mmol/L 硫酸亚铁,1 mL 9 mmol/L水杨酸, 1 mL 8.8 mmol/L 双氧水,37 ℃水浴 15 min 后取出,于510 nm处测吸光度。对照组以蒸馏水代替水杨酸,空白组以蒸馏水代替熊果酸溶液,平行测定3次,取平均值。以相同浓度的VC溶液作阳性对照,按式(3)计算·OH清除率。
(4) 抑制小鼠红细胞氧化溶血的影响:参考文献[19],小鼠眼球取血盛于有抗凝剂的离心管中,以3 000 r/min离心20 min,用冰冷生理盐水洗涤3次, 再以生理盐水配制成体积分数为0.5%的红细胞悬浮液,4 ℃保存备用。取200 μL 不同质量浓度样品溶液,分别加入1.0 mL的红细胞悬浮液,混匀,加入0.1 mL 100 mmol/L H2O2启动反应,37 ℃ 水浴1 h后取出,加入4.8 mL 生理盐水,3 000 r/min 离心10 min,取上清液,于415 nm处测吸光度。空白组以生理盐水代替样品溶液。以相同浓度的VC溶液作阳性对照,抑制率按式(4)计算:
(4)
式中:
E——抑制率,%;
A1——对照吸光度;
A2——样品吸光度。
1.3.6 数据分析 采用Microsoft Excel 2010、SPSS 19.0软件对数据进行分析,所有试验平行测定3次,采用单因素方差分析(ANOVA),P<0.05表示差异显著。
2 结果与分析
2.1 扁桃果皮熊果酸提取单因素试验
2.1.1 乙醇浓度对扁桃果皮熊果酸得率的影响 由图1可知,乙醇浓度在60%~70%时,扁桃果皮熊果酸得率呈现上升趋势,当乙醇浓度为70%时,扁桃果皮熊果酸得率达到最大值,之后随着乙醇浓度的增加扁桃果皮熊果酸得率逐渐下降。其原因根据相似相溶原理解释[20],乙醇浓度为70%时极性与扁桃果皮熊果酸的极性相接近,得率最高,故选择乙醇浓度为70%。

图1 乙醇浓度对扁桃果皮熊果酸得率的影响Figure 1 Effects of ethanol concentration on the yield of ursolic acid from Amygdalus communis L.peel
2.1.2 料液比对扁桃果皮熊果酸得率的影响 如图2所示,随溶剂用量的增加,扁桃果皮熊果酸得率逐渐增大,当料液比为1∶20 (g/mL)时,得率达到最大值,之后随着溶剂用量的增加,扁桃果皮熊果酸得率逐渐下降。可能是溶剂用量过多,浓缩时间较长,熊果酸损失增加[21]。故选择料液比为1∶20 (g/mL)。
2.1.3 提取温度对扁桃果皮熊果酸得率的影响 由图3可知,在65~80 ℃时,随着温度的升高,扁桃果皮熊果酸得率逐渐上升,继续升高温度,扁桃果皮熊果酸得率趋于平稳。因为温度过高,提取液黏度变大,这种高黏液体对固液分离较不利[22],另一方面,温度过高可能会破坏熊果酸结构[23]。
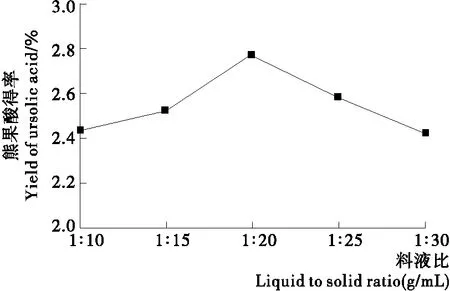
图2 料液比对扁桃果皮熊果酸得率的影响Figure 2 Effects of solid-liquid ratio on the yield of ursolic acid from Amygdalus communis L.peel
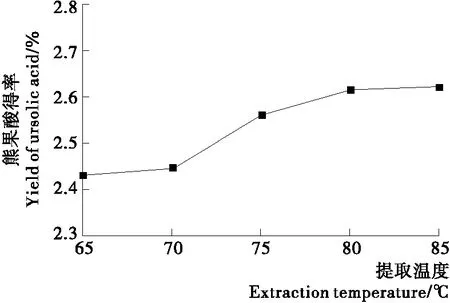
图3 提取温度对扁桃果皮熊果酸提率的影响Figure 3 Effects of extraction temperature on the yield of ursolic acid from Amygdalus communis L.peel
故选择温度为80 ℃。
2.1.4 提取时间对扁桃果皮熊果酸得率的影响 如图4所示,在1.5 h内,扁桃果皮熊果酸得率随提取时间的延长而升高;1.5 h以后,随时间的延长得率逐渐下降。说明在1.5 h后,熊果酸基本溶出,延长时间产生的热量会破坏熊果酸的结构,使扁桃果皮熊果酸得率下降。故选择提取时间为1.5 h。
2.2 扁桃果皮熊果酸提取正交试验
根据单因素试验结果,正交试验因素与水平见表1,正交试验结果见表2,方差分析见表3。由表2可知,最优提取条件为A1B2C2D2,即乙醇浓度65%、浸提温度80 ℃、料液比1∶20 (g/mL)、浸提时间1.5 h。在此条件下验证实验测得扁桃果皮熊果酸得率为2.89%。由表3可知,乙醇浓度,料液比对扁桃果皮熊果酸得率有显著影响。各提取因素对扁桃果皮熊果酸提取得率影响的主次顺序为:乙醇浓度>料液比>提取时间>提取温度。

表1 正交试验因素与水平Table 1 Factors and levels of orthogonal array design

表2 正交试验结果与分析Table 2 Results and analysis of orthogonal array design
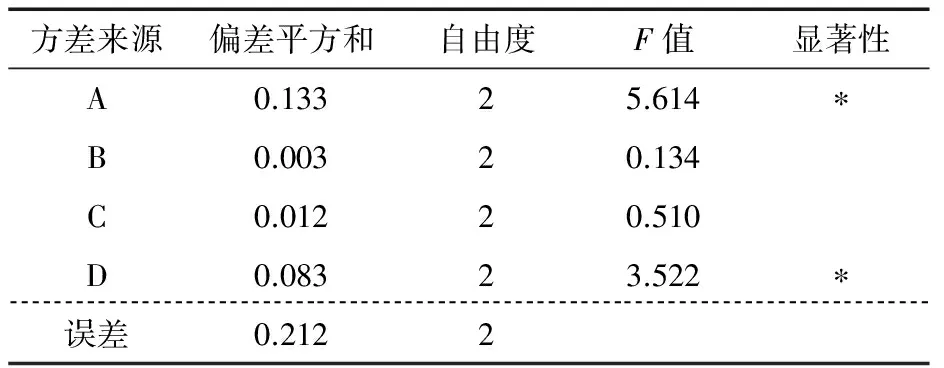
表3 正交试验方差分析†Table 3 Variance analysis of orthogonal test
† *表示差异显著,P<0.05。
2.3 扁桃果皮熊果酸抗氧化活性
2.3.1 扁桃果皮熊果酸还原能力测定 物质的还原能力是评价其抗氧化活性的重要指标。由图5可以看出,扁桃果皮熊果酸和VC都有还原能力。0.06 mg/mL的扁桃果皮熊果酸的还原能力同0.02 mg/mL的VC相当,但在浓度为0.10 mg/mL 时VC吸光度为0.80,而扁桃果皮熊果酸吸光度为0.26。
2.3.2 扁桃果皮熊果酸对DPPH·清除能力 DPPH·乙醇溶液呈紫色,在517 nm波长处有特征吸收[24]。如图6所示,扁桃果皮熊果酸和VC都有清除DPPH·的作用。在0.01~0.03 mg/mL时,随着扁桃果皮熊果酸质量浓度的增加,DPPH·清除率逐渐增大,在0.04~0.10 mg/mL时,扁桃果皮熊果酸对DPPH·清除效果与VC相接近。

图5 扁桃果皮熊果酸的还原能力Figure 5 Reducing powers of ursolic acid from Amygdalus communis L.peel

图6 扁桃果皮熊果酸对DPPH·的清除能力Figure 6 Scavenging effects of ursolic acid from Amygdalus communis L.peel on DPPH
2.3.3 扁桃果皮熊果酸对·OH清除能力 ·OH清除率是抗氧化能力的重要指标,采用Fenton反应检测扁桃果皮熊果酸清除·OH能力,H2O2与Fe2+反应生成活性很高的·OH,·OH与水杨酸产生有色物质,该物质在510 nm波长处有特征吸收[25-26]。由图7可知,扁桃果皮熊果酸和VC都有清除·OH的作用。在0.01~0.10 mg/mL时,随着扁桃果皮熊果酸和VC浓度的增加,·OH清除率逐渐增大最后趋于恒定,当扁桃果皮熊果酸的浓度为0.10 mg/mL时,清除率最大为62.11%。

图7 扁桃果皮熊果酸对·OH的清除能力Figure 7 Scavenging effects of ursolic acid from Amygdalus communis L.peel on hydroxyl
2.3.4 扁桃果皮熊果酸对红细胞氧化溶血抑制能力 由图8 可知,扁桃果皮熊果酸和VC都有抑制红细胞氧化溶血的作用。在0.1~0.6 mg/mL时,红细胞氧化溶血抑制率随着扁桃果皮熊果酸和VC浓度的增加而增大,当扁桃果皮熊果酸的浓度为0.6 mg/mL时,抑制率最大为97.83%,红细胞氧化溶血抑制率明显高于VC。
3 结论
本试验研究了扁桃中熊果酸的提取工艺。试验结果表明:最优提取工艺条件:乙醇浓度65%、浸提温度80 ℃、料液比1∶20 (g/mL)、浸提时间1.5 h。在此条件下测得扁桃果皮熊果酸提取得率为2.89%。

图8 扁桃果皮熊果断抑制红细胞氧化溶血的能力Figure 8 Inhibitions effect of ursolic acid on from Amygdalus communis L.peel hemolysis of erythrocytes
体外抗氧化试验结果表明,扁桃果皮熊果酸表现出较好的抗氧化活性,0.06 mg/mL的扁桃果皮熊果酸的还原能力同0.02 mg/mL的VC相当;在0.04~0.10 mg/mL时,扁桃果皮熊果酸与VC对DPPH自由基清除效果接近;当扁桃果皮熊果酸的浓度为0.1 mg/mL时,对·OH清除率为62.11%,低于同浓度VC的;当扁桃果皮熊果酸的浓度为0.6 mg/mL时,对红细胞氧化溶血抑制率高达97.83%,明显高于同浓度VC的。
本研究仅对扁桃果皮熊果酸的体外抗氧化活性进行评价,后续试验中可对扁桃果皮熊果酸的组织抗氧化和体内小鼠抗氧化作进一步研究。
[1] 孙月娥, 明鸣, 王卫东, 等.巴旦木蛋白提取工艺[J].食品科学, 2011, 32(18): 19-23.
[2] 兰彦平, 吐拉克孜, 郭文英, 等.巴旦杏的研究现状及开发利用前景[J].林业科学研究, 2004, 17(5): 674-679.
[3] 尤努斯江·吐拉洪, 马木提·库尔班, 木妮热·依布拉音.巴旦木的营养保健作用研究进展[J].中国食物与营养, 2008, 14(10): 56-58.
[4] 李维霞, 魏佳, 苏玉红, 等.高效液相色谱法测定巴旦木青皮提取物中齐墩果酸和熊果酸[J].食品科学, 2016, 37(10): 151-157.
[5] 卢静, 张博超, 姜玮, 等.熊果酸抗氧化性能的研究[J].食品工业科技, 2009(4): 126-127.
[6] ANTONIO E, JUNIOR O D R A, ARAJO I S D, et al.Poly (lactic acid) nanoparticles loaded with ursolic acid: Characterization and in vitro, evaluation of radical scavenging activity and cytotoxicity[J].Materials Science & Engineering C, 2016, 71: 156-166.
[7] MENG Fan-yu, NING Hua, SUN Zong-xiang, et al.Ursolic acid protects hepatocytes against lipotoxicity through activating autophagy via an AMPK pathway[J].Journal of Functional Foods, 2015, 17: 172-182.
[8] JAMAL M, IMAM S S, AQIL M, et al.Transdermal potential and anti-arthritic efficacy of ursolic acid from niosomal gel systems[J].International Immunopharmacology, 2015, 29(2): 361-369.
[9] GU Wen, HAO Yun, ZHANG Guang, et al.Synthesis, in vitro antimicrobial and cytotoxic activities of new carbazole derivatives of ursolic acid[J].Bioorganic & Medicinal Chemistry Letters, 2015, 25(3): 554-557.
[10] 林科, 张太平, 张鹤云.山楂中熊果酸的提取及其对小鼠的降血脂作用[J].天然产物研究与开发, 2007, 19(6): 1 052-1 054.
[11] YOON Y, LIM J W, KIM J, et al.Discovery of ursolic acid prodrug (NX-201): Pharmacokinetics and in vivo antitumor effects in PANC-1 pancreatic cancer[J].Bioorganic & Medicinal Chemistry Letters, 2016, 26(22): 5 524-5 527.
[12] 石瑞, 张宁, 李志英, 等.β-环糊精超声辅助提取山楂中熊果酸的研究[J].食品研究与开发, 2016, 37(15): 95-99.
[13] 李莹, 陈新梅.分光光度法测定大山楂丸中熊果酸含量[J].食品与药品, 2013, 15(3): 200-201.
[14] 梁俊, 李建科, 赵伟, 等.石榴皮多酚体外抗脂质过氧化作用研究[J].食品与生物技术学报, 2012, 31(2): 159-165.
[15] 江岩, 聂文静.新疆药桑椹营养成分分析及其体外抗氧化作用[J].食品科学, 2014, 35(22): 126-129.
[16] 刘玥, 刘晓兰, 郑喜群, 等.复合蛋白酶水解玉米谷蛋白产物的抗氧化活性研究[J].食品与机械, 2015, 31(1): 141-145.
[17] 李志平, 张弛, 周维清, 等.巢湖蓝藻酸性多糖的理化性质及其体外抗氧化作用[J].食品科学, 2015, 36(5): 7-12.
[18] 陈慧, 盛丹丹, 王文君.黄金茶醇提取物成分及抗氧化活性的研究[J].现代食品科技, 2017(1): 26-32.
[19] 仇燕, 赵爽, 杜占强, 等.菜芙蓉花体外抗氧化活性部位的研究[J].精细化工, 2016, 33(8): 890-895.
[20] 杨艳, 任亚梅, 马婷, 等.响应面优化超声波提取猕猴桃根熊果酸工艺[J].食品科学, 2014, 35(4): 44-49.
[21] 邵金华, 马永强, 何福林, 等.虎舌红多糖超声波辅助提取工艺优化及其抗氧化活性评价[J].食品与机械, 2016, 32(12): 166-169.
[22] 郭军, 王丽丽, 吴小说, 等.西山焦枣中熊果酸超声法提取工艺研究[J].中国农学通报, 2016, 32(19): 175-181.
[23] 齐娜, 李涵, 张志宇, 等.新疆红肉苹果多酚的超声波辅助提取工艺优化[J].食品与机械, 2016, 32(9): 177-182.
[24] 游玉明, 周敏, 王倩倩, 等.花椒麻素的抗氧化活性[J].食品科学, 2015, 36(13): 27-31.
[25] 王金华, 杜超, 梁晨, 等.贵长猕猴桃多糖提取工艺及体外抗氧化功能[J].食品科学, 2016, 37(20): 19-23.
[26] 张津鸣, 钟筱婷, 盛德乔, 等.资木瓜总黄酮的体内外抗氧化活性研究[J].天然产物研究与开发, 2016, 28(10): 1 602-1 606.
