木质纤维素预处理与浆料脱毒研究进展
2018-05-03胡倍国曾柏全朱光冕章旖旎
胡倍国, 曾柏全*, 邹 辉, 朱光冕, 章旖旎
(中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
随着石油和煤炭的开采,化石资源储量日益减少,环境污染问题也日益凸显,利用生物质作为原料生产可再生能源和化学品具有很大的发展前景[1]。木质纤维素生物质主要包括农业和工业废弃物、森林工业剩余物、能源作物、城市固体废物等,这些生物质原料极其丰富[2]。但木质纤维素主要成分之间紧密结合,且很难被微生物直接利用,在生物炼制之前需要进行预处理。预处理过程的实质是通过增加纤维素的可及度和溶解半纤维素或木质素,使纤维素更容易被微生物利用消耗酶解,对原料进行预处理的目的,就是要改变木质纤维素的这些结构性质使其能够被酶降解[3]。影响木质纤维素生物降解速率的主要因素有:纤维素的结晶度、可及度、木质素和半纤维素的包裹、纤维素聚合度和半纤维素的乙酰化程度。常见的预处理方法有物理法、化学法和生物法,以及上述两种或两种以上方法组合。选择合适的预处理方法,能够有效提高酶解速率降低生物炼制成本,由于大多数预处理需要在强酸强碱或高温高压下进行,产生较多对后续酶解和微生物发酵有抑制作用的副产物。这些副产物的浓度高低将直接影响到微生物的生长代谢,以及目标产物的得率[4]。
本文综述了近年来,木质纤维素的预处理方法、副产物生成途径和危害、以及脱除的策略,以期提高木质纤维素利用效率。
1 木质纤维素
1.1 木质纤维素组成结构
木质纤维素由纤维素、半纤维素、木质素、提取物和无机成分组成[5]。木质纤维素通过水解提供后获得单糖,用于微生物发酵生产生物燃料或化工产品。
纤维素是由β-D-葡萄糖通过β-1,4-糖苷键结合起来形成的链状高聚物,性质比较稳定。葡萄糖单体通过重复单元形成纤维二糖结构[6],大约30~50个葡聚糖长链通过氢键连接,聚合在一起形成直径为3 nm~5 nm的纤维素微原纤维结构[7],并以束状的形式相连接,这种特殊而复杂的结构使得纤维素对生物和化学处理有着顽固的抵抗力。
半纤维素是由己糖、戊糖残基组成的支链杂多糖,可以携带乙酰基[8],水解后产物有己糖、戊糖和少量糖醛酸。与纤维素相比,半纤维素的结晶度更低更不稳定,支链结构对水解稍微有一些抵抗力,并且它们更容易在酸碱介质中水解成它们的单体成分[9]。
木质素是由苯基丙烷通过醚键和碳-碳键以非线性和随机的方式,连接形成的三维空间结构,属于芳香族类聚合物,通过化学键与半纤维素和纤维素相连[10],木质素能够为植物提供结构支撑作用,这也是植物细胞壁中最顽抗的部分。木质素比例越高,对化学和酶降解的抗性就越强,软木比硬木和大多数农业废弃物的木质素含量更高。
1.2 木质纤维素预处理方法
木质纤维素经过预处理能够降低纤维素的结晶度,去除部分木质素,溶解半纤维素,提高纤维素的可接触表面积,使纤维素更容易进行酶解转化为可发酵糖,生产各种化工产品。表1中列举了用于木质纤维素常用的预处理类型。
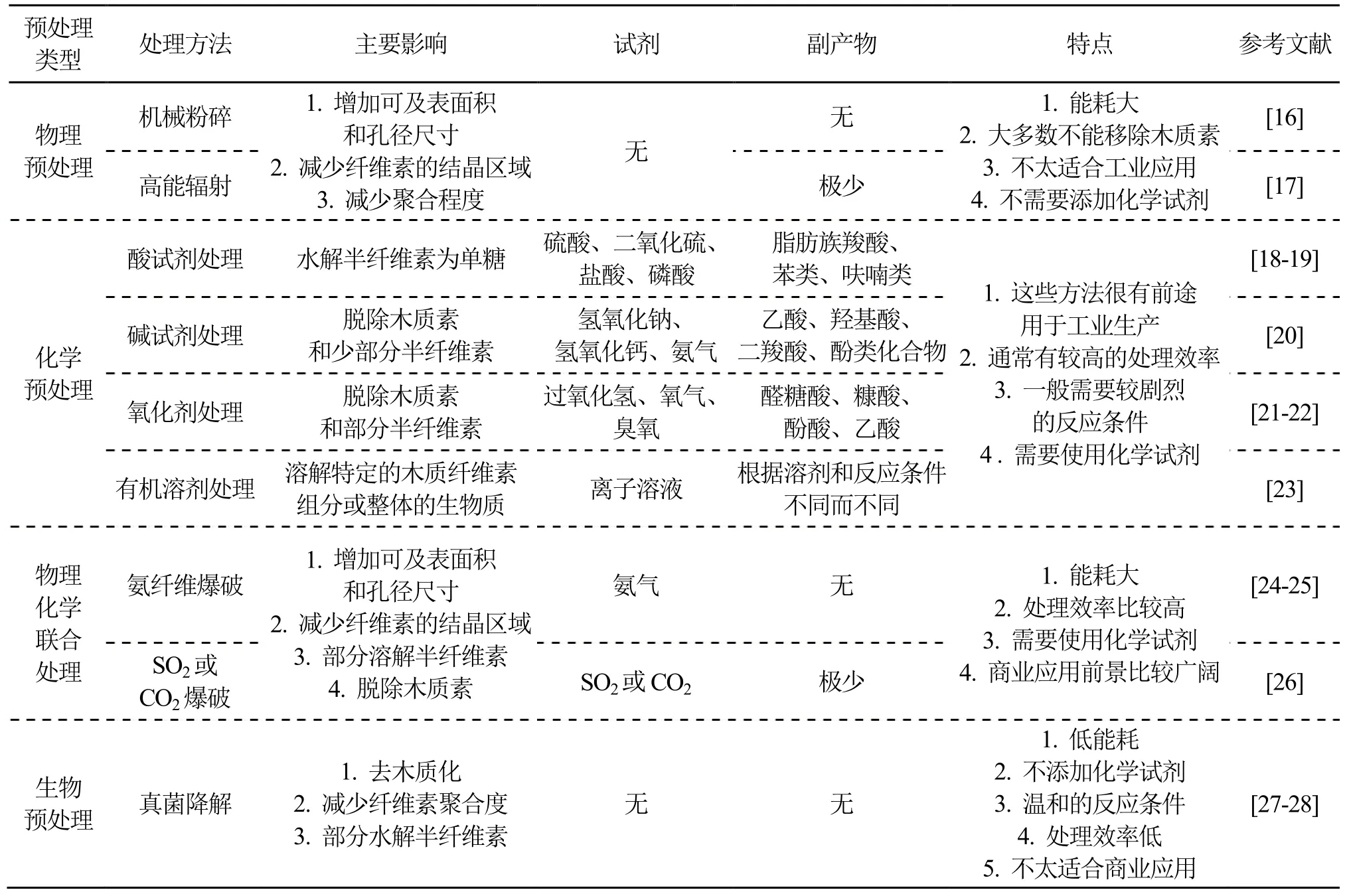
表1 常见的预处理方法及其特点
这些类型大致分为物理预处理、化学预处理、物理-化学组合预处理和生物预处理[11]。除了常见的预处理方法外,一些不太常用但有着很大潜力的预处理方法也值得关注。包括电预处理和反刍动物仿生模拟预处理。电预处理通过使用脉冲电场、电子流、外电场等方式对木质纤维素处理,达到增加表面积、渗透率和改变生物质化学键的效果,从而提高木质纤维素酶解效率[12-13]。反刍动物仿生模拟预处理是从仿生学的角度,结合物理法(反刍动物咀嚼)、化学法(胃液酸处理)和生物法(瘤胃微生物群和酶分解)进行预处理,达到极高的消解率[14]。Ozbayram 等[15]用小麦秸秆作底物,接种绵羊瘤胃菌群厌氧发酵,甲烷的产量增加了27%。这些预处理方法各有优缺点,根据不同的生物质种类的特点选择对应的预处理方法尤为重要。
2 抑制物的形成、影响及脱除策略
木质纤维素通过预处理可以降低纤维素的结晶度,去除部分或全部木质素,溶解半纤维素,提高纤维素的可接触表面积,使生物质更容易进行酶解转化为可发酵糖,发酵生产各类产品。但由于大多数预处理需要在剧烈的条件下进行,如强酸强碱、高温高压等,不可避免的产生了一些对微生物发酵有抑制作用的产物,抑制微生物的生长代谢,降低了目标产品的产量,使得对预处理的研究成为高效利用木质纤维素的难点之一,对抑制物类型、产生及脱除策略的研究是提高木质纤维素利用效率,提高微生物发酵目标产物得率的关键。抑制物通常分为三类分别是:脂肪酸、呋喃衍生物和芳香族化合物,这些副产物抑制物的生成过程如图1所示。

图1 木质纤维素预处理后降解产物形成示意图
2.1 抑制物的形成
脂肪酸主要包括甲酸、乙酸和乙酰丙酸。其中,乙酸主要由半纤维素的乙酰基断裂形成,甲酸和乙酰丙酸主要由半纤维素和纤维素降解形成的己糖和戊糖脱水,形成呋喃甲醛和 5-羟甲基糠醛(HMF),继续降解形成甲酸和乙酰丙酸[29]。例如,由于硬木比软木乙酰化碳水化合物含量更高,导致其预处理后水解产物中脂肪酸的含量也更高[30]。
糠醛和5-羟甲基糠醛是五碳糖和六碳糖的呋喃衍生物,它是存在于木质纤维素预处理浆料中含量最高毒性最大的副产物,化学性质活泼。对乙醇发酵的酶以及微生物细胞生长具有抑制作用。芳香族化合物一般由木质素经预处理释放出来[31]。一些酚类化合物来自水解后糖的衍生合成物[32]。木质纤维素原料的部分提取物也是酚类化合物来源之一。此外,无机离子(K+、Na+、Cl-)也是一类不可忽视的抑制物,它来自木质纤维素原料的水解产物和添加的化学物质[33],如果离子不能穿过细胞膜,则会导致细胞处于高渗透压环境中脱水死亡[34]。
除了上述提到的有机酸、芳香族化合物和呋喃化合物以外,木质纤维素的预处理中还存在少量其它的副产物,可以通过使用各种溶剂从浆液中提取出来。这些产物包括单宁和萜烯酸,如己酸、辛酸、壬酸和棕榈酸,其类型和浓度很大程度上取决于原料种类、水解温度、酸浓度以及预处理的总体剧烈程度。
2.2 抑制物对酶解和微生物的影响
脂肪酸对微生物的抑制作用主要体现在三个方面:一、未解离的脂肪酸以扩散方式通过细胞膜进入细胞,然后在细胞内解离,使细胞内pH降低,影响微生物的正常代谢,甚至可能导致细胞死亡[35];二、脂肪酸的电离释放出大量的质子,为了维持恒定的细胞内pH值,细胞通过位于质膜上的ATP酶泵出质子,结果导致微生物的生物量下降[36];三、部分芳香族羧酸可以作为解偶联剂,破坏线粒体膜上的质子梯度,切断呼吸链与氧化磷酸化之间的联系,抑制线粒体上ATP的再生[37]。
糠醛和HMF抑制酵母的生长并降低乙醇产量和生产效率[38],影响细胞内呼吸作用和糖酵解途径的正常代谢。当在厌氧条件下,酿酒酵母可将糠醛转化成糠醇[39],将HMF转化为2,5-二羟甲基呋喃[40]。糠醛的还原与辅因子NADH有关,而HMF的降低与NADPH的消耗有关。Wahlbom等[41]通过具有利用木糖能力作为碳源的酿酒酵母重组菌株试验,往培养基中添加适量糠醛,研究发现,乙醇的产量反而增加了,这证实该酿酒酵母菌株具备将糠醛转化为糠醇的能力。
芳香族化合物能够影响微生物生长和目标产物产量,不同的芳香族化合物对微生物抑制作用效果不同,存在很大的差异性和可变性,这可能与其特定的官能团有关。一种假说认为,酚类物质主要通过对微生物细胞膜的功能和蛋白质与脂质的比例产生干扰,从而抑制微生物的生长和产物合成。此外,研究表明,酚类能够诱导蛋白质沉淀,从而对纤维素酶水解有抑制作用。
2.3 抑制物的脱毒方法
对预处理后浆料进行脱毒方式通常划分为三种类型,分别是物理法、化学法和生物法,如表2所示为常见的预处理浆料脱毒方法和特点。根据抑制物类型、浓度、微生物耐受性等差异,选择相匹配的脱毒方法显得尤为重要。
2.3.1 物理法
物理法是对预处理后浆料脱毒最简便的方法,通过一些简单的处理,如旋转蒸发或烘干、吸附、薄膜过滤等方法,达到去除抑制物的效果。该方法具有操作简单、成本低、不添加其他化学品等优点[42]。旋转蒸发或烘干是利用加热浆料使其中易挥发低沸点的副产物(如有机酸)去除。吸附法通常将活性炭加到预处理后的浆料中,使活性炭与抑制物结合并沉淀,达到去除抑制物的效果。李允超等[43]研究了竹炭对糠醛的吸附特性,在糠醛10 g/L的浓度下,竹炭添加量与糠醛吸附脱除率成相关,糠醛脱除率可达95%以上。Keshav等[44]通过活性炭吸附预处理后的棉花茎水解液中的副产物,能够减少水解产物中总糠醛59.12%,酚醛树脂 78.44%。此外,楼宏铭等[45]利用酶解木质素粉碎后作为吸附剂,对预处理液中糠醛和 5-羟甲基糠醛进行吸附试验,能够将糠醛和5-HMF的浓度降低到微生物能够耐受的水平。
2.3.2 化学法
化学法主要是指通过往木质纤维素预处理浆料中添加化学品,使有毒物质发生沉淀,达到脱毒的效果。最常见的是添加碱性试剂(如氨水、熟石灰、氢氧化钠),使预处理浆料中的副产物沉淀。Ariksson等[46]对云杉稀酸水解产物进行脱毒,比较了添加NH4OH、Ca(OH)2、Mg(OH)2、Ba(OH)2和NaOH对抑制物的脱除效果,结果表明,当pH 10.0时,使用NH4OH进行处理可以显著降低糠醛和5-羟甲基糠醛的浓度,大大提高酿酒酵母的发酵能力。通过使用还原剂进行浆料脱毒,可以在适合微生物生长的条件下直接向发酵容器中添加化学药品,操作简便,却能使发酵效果得到显著提高而不消耗浆料中的还原糖。Ariksson等[47]向云杉或甘蔗渣预处理浆液中添加连二亚硫酸盐和亚硫酸盐,进行 SHF发酵实验,结果表明用连二亚硫酸盐处理能够使云杉水解液发酵乙醇产率从0.2 g/(L·h)-1提高到2.5 g/(L·h)-1,甘蔗渣发酵乙醇产率从0.9 g/(L·h)-1提高到 3.9 g/(L·h)-1。
2.3.3 生物法
生物法主要是利用微生物或酶去降解消除抑制物。包括三个方面:一是在发酵前添加能降解抑制物的外源微生物;二是对发酵微生物进行选育驯化,包括运用基因工程技术,对发酵微生物进行基因重组,提高对抑制物的耐受性,甚至具有降解抑制物的能力;三是添加生物酶进行脱毒处理。Nichols等[48]研究了玉米秸秆稀酸水解液中接种真菌Coniochaeta ligniaria NRRL30616,对培养后的水解液中成分定量分析,发现多种芳香族化合物、脂肪酸、糠醛等抑制物都显著降低,优化了乙醇发酵中对木糖的利用能力。王旭等[49]对毕赤酵母基因组的研究中,成功鉴定出了对木质纤维素水解醛类具有脱毒能力的基因,以及对糠醛和5-羟甲基糠醛的转录应答反应作了深入研究。Saravanakumar T等[50]通过将漆酶固定在纳米纤维上,40℃反应36 h能够完全脱除木质纤维素水解产物中的糠醛、乙酰丁香酮和松柏醛。对于副产物的脱除有很好的借鉴作用。
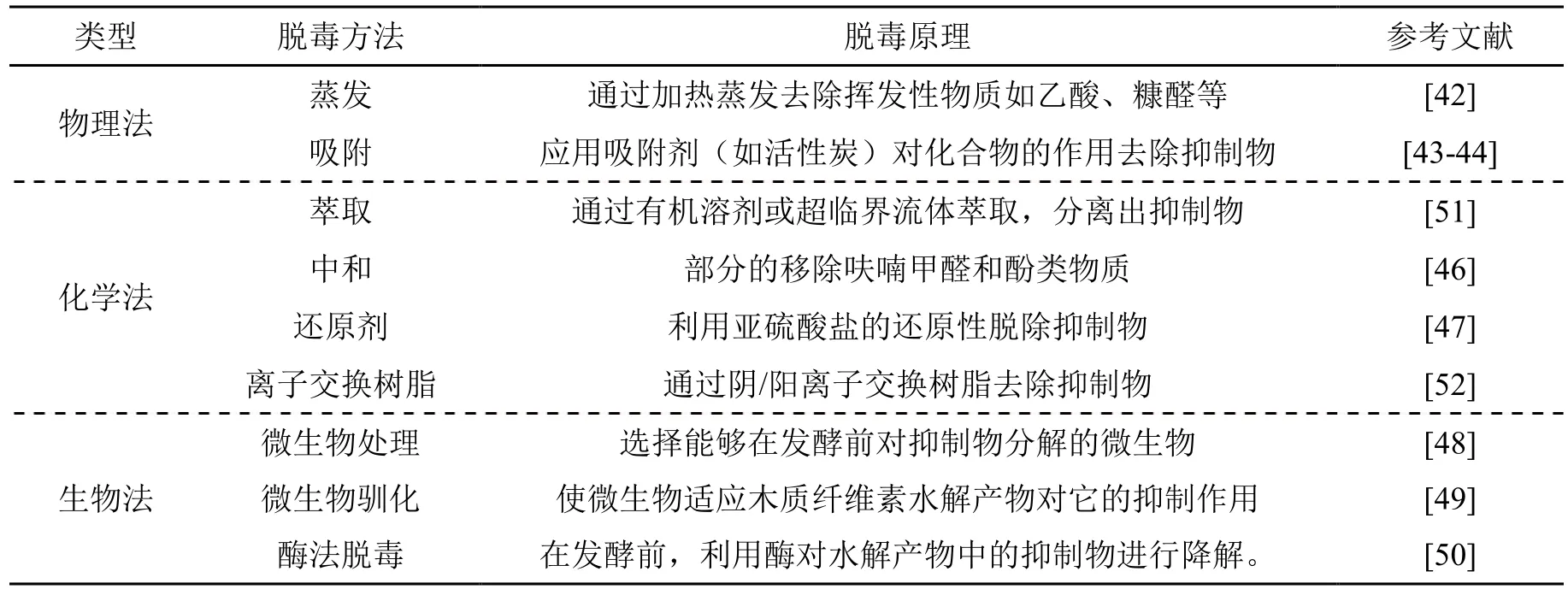
表2 木质纤维素浆料常见脱毒方法
3 结论与展望
随着对以木质纤维素为原料生产生物燃料和工业产品的深入研究,寻找木质纤维素有效的预处理方法及处理后浆料脱毒策略,解决预处理过程中暴露的问题,成为提高木质纤维素高效利用的重要环节。为了提高对天然木质纤维素的利用效率,可以从以下几个方面进行研究。
一是不同种类的木质纤维素原料组分和结构特征差别较大,深入对不同种类的木质纤维素的组分结构进行分析,探索对不同种类来源的木质纤维素相适应的预处理方法,是降低预处理成本,提高效率的有效途径。
二是从自然界或通过基因工程技术选育出具有高效脱毒能力的菌株,是降低预处理后发酵浆料中抑制物含量的研究方向。
三是通过对预处理后浆料中抑制物成分的分析,摸索出有效的提取工艺流程,对抑制物进行分离纯化转为多种化学产品,达到变废为宝的处理效果。
尽管木质纤维素的生物利用还存在很多问题需要攻克,但是它作为各种生产工业产品(如生物乙醇、甲烷、PHA等)的丰富廉价原料,具有很大的发展空间。合理有效的利用生物质资源,可以减少对石油煤炭等化石燃料的依赖,促进可持续发展战略的实施。
参考文献:
[1] FitzPatrick M, Champagne P, Cunningham M F, et al. A biorefinery processing perspective: treatment of lignocellulosic materials for the production of value-added products[J]. Bioresour Technol, 2010, 101(23): 8915-8922.
[2] Ragauskas A J, Williams C K, Davison B H, et al. The path forward for biofuels and biomaterials[J]. Science, 2006, 311(5760):484-489.
[3]马泽林, 刘家亨, 黄序, 等. 微生物利用木质纤维素的研究进展[J]. 中国生物工程杂志, 2017, 37(6): 124-133.
[4] Jakyong K, Youngsoon U, Yongcheol P, et al. Compounds inhibiting the bioconversion of hydrothermally pretreated lignocellulose[J]. Appl Microbiol Biotechnol, 2015, 99(10): 4201-4212.
[5] Rowell R M: Handbook of wood chemistry and wood composites[M]2nd edition. Boca Raton FL: CRC Press, 2012.
[6] Abdelaziz O Y, Hulteberg C P. Physicochemical characterisation of technical lignins for their potential valorisation[J]. Waste Biomass Valorization, 2017, 8(3): 859-869.
[7] Ding S Y, Himmel M E. The maize primary cell wall microfibril: A new model derived from direct visualization[J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 597-606.
[8] Cullis I F, Mansfield S D. Optimized delignification of wood-derived lignocellulosics for improved enzymatic hydrolysis[J].Biotechnology&Bioengineering, 2010, 106(6): 884-893.
[9] Emmel A, Mathias A L, Wypych F, et al. Fractionation of Eucalyptus grandis chips by dilute acid- catalysed steam explosion[J].Bioresource Technol, 2003, 86(2), 105-115.
[10] Arantes V, Saddler J N. Cellulose accessibility limits the effectiveness of minimum cellulase loading on the efficient hydrolysis of pretreated lignocellulosic substrates[J]. Biotechnology for Biofuels, 2011, 4(1): 1-17.
[11] Karimi K, Kheradmandinia S, Taherzadeh M J. Conversion of rice straw to sugars by dilute-acid hydrolysis[J]. Biomass Bioenergy, 2006, 30(3): 247-253.
[12] Safavi S M, Unnthorsson R. Methane yield enhancement via electroporation of organic waste[J]. Waste Management.2017, 66:61-69.
[13] Singh R, Krishna, B B, Kumar J, et al. Opportunities for utilization of non-conventional energy sources for biomass pretreatment[J]. Bioresource Technology, 2016, 199: 398-407.
[14] Shukra R P, Sushant P B, Oh K C, et al. Pretreatment of agricultural biomass for anaerobic digestion: Current state andchallenges[J]. Bioresource Technology, 2017, 245: 1194-1205.
[15] Ozbayram E G, Kleinsteuber S, Nikolausz M, et al. Effect of bioaugmentation by cellulolytic bacteria enriched from sheep rumen on methane production from wheat straw[J]. Anaerobe, 2017, 46: 122-130.
[16] Zeng M, Mosier N S, Huang C P, et al. Microscopic examination of changes of plant cell structure in corn stover due to hot water pretreatment and enzymatic hydrolysis[J]. Biotechnol Bioeng, 2007, 97(2): 265-278.
[17]黄子美, 卿青, 胡蓉, 等. 木质纤维素微波强化预处理方法的初步研究[J]. 现代化工, 2016, 36(9): 75-80.
[18] Emmel A, Mathias A L, Wypych F, et al. Fractionation of Eucalyptus grandis chips by dilute acid-catalysed steam explosion[J].Bioresource Technol, 2003, 86(2): 105-115.
[19] Karapatsia A, Pappas I, Penloglou G, et al. Optimization of dilute acid pretreatment and enzymatic hydrolysis of phalaris aquatica L. Lignocellulosic biomass in batch and fed-batch processes[J]. Bioenergy Reasearch, 2017, 10(1):225-236.
[20] Silverstein R A, Chen Y, Sharmashivappa R R, et al. A comparison of chemical pretreatment methods for improving saccharification of cotton stalks[J]. Bioresource Technology, 2007, 98(16): 3000-3011.
[21]李诚, 王莉, 李永富, 等. 臭氧预处理对玉米秸秆酶解性能的影响[J]. 林产化学与工业, 2015, 35(6): 58-62.
[22] Saha B C, Cotta M A. Ethanol production from alkaline peroxide pretreated enzymatically saccharified wheat straw[J].Biotechnol Progress, 2006, 22(2): 449-453.
[23] Chandra R P, Bura R, Mabee W E, et al. Substrate pretreatment: The key to effective enzymatic hydrolysis of lignocellulosics?[J]. Adv Biochem Eng Biotechnol, 2007, 108: 67-93.
[24] Holtzapple M T, Jun J H, Ashok G, et al. The ammonia freeze explosion (AFEX) process[J]. Applied Biochemistry Biotechnology, 1991, 28-29(1): 59-74.
[25] Eggeman T, Elander R T. Process and economic analysis of pretreatment technologies[J]. Bioresource Technology, 2005,96(18): 2019-2025.
[26] Chang Y P, Ryu Y W, Kim C. Kinetics and rate of enzymatic hydrolysis of cellulose in supercritical carbon dioxide[J]. Korean Journal of Chemical Engineering, 2001, 18(4): 475-478.
[27] Taniguchi M, Suzuki H, Watanabe D, et al. Evaluation of pretreatment with Pleurotus ostreatus for enzymatic hydrolysis of rice straw[J]. Journal of Bioscience Bioengineering, 2005, 100(6): 637-643.
[28] Kurakake M, Ide N, Komaki T. Biological pretreatment with two bacterial strains for enzymatic hydrolysis of office paper[J].Current Microbiology, 2007, 54(6): 424-428.
[29] Parawira W, Telete M. Biotechnological strategies to overcome inhibitors in lignocellulose hydrolysates for ethanol production:Review[J]. Critical. Reviews in Biotechnology, 2011, 31(1): 20-30.
[30] Obruca S, Benesova P, Marsalek L, et al. Use of lignocellulosic materials for PHA production[J]. Chemical Biochemical Engineering Quarterly, 2015, 29(2): 133-144.
[31] Martín C, Galbe M, Nilvebrant N O, et al. Comparison of the fermentability of enzymatic hydrolysates of sugarcane bagasse pretreated by steam explosion using different impregnating agents[J]. Applied Biochemistry Biotechnology, 2002, 98-100(1-9):699-716.
[32] Alriksson B. Ethanol from lignocellulose: Alkali detoxification of dilute-acid spruce hydrolysates[D]. Sweden: Karlstad University, 2006.
[33] Mizamoto K. Renewable biological systems for alternative sustainable energy production[J]. Fao Agricultural Services Bulletin,1997, 12(14): 129-135.
[34] Chandel A K, Silva S S D, Singh O V. Detoxification of lignocellulosic hydrolysates for improved bioethanol production[J].Biofuel Production-Recent Developments and Prospects In-Tech, 2011, 225-246.
[35] Pampulha M E, Loureirodias M C. Combined effect of acetic acid, pH and ethanol on intracellular pH of fermenting yeast[J].Applied Microbiology Biotechnology, 1989, 31(5-6): 547-550.
[36] Viegas C A, Sácorreia I. Activation of plasma membrane ATPase of Saccharomyces cerevisiae by octanoic acid[J]. Journal of Genneral Microbiology, 1991, 137(3): 645-651.
[37] Norman C, Howell K A, Millar A H, et al. Salicylic acid is an uncoupler and inhibitor of Mitochondrial electron transport[J].Plant Physiology, 2004, 134(1): 492-501.
[38] Chung I S, Lee Y Y. Ethanol fermentation of crude acid hydrolyzate of cellulose using high-level yeast inocula[J].Biotechnology Bioengineering, 1985, 27(3): 308-315.
[39] Sárvári H I, Franzén C J, Taherzadeh M J, et al. Effects of furfural on the respiratory metabolism of Saccharomyces cerevisiae in glucose-limited chemostats[J]. Applied Environmental Microbiology, 2003, 69(7): 4076-4086.
[40] Taherzadeh M J, Gustafsson L, Niklasson C, et al. Physiological effects of 5-hydroxymethylfurfural on Saccharomyces cerevisiae[J]. Applied Microbiology Biotechnology, 2000, 53(6): 701-708.
[41] Wahlbom C F, HahnHägerdal B. Furfural, 5-hydroxymethyl furfural, and acetoin act as external electron acceptors during anaerobic fermentation of xylose in recombinant Saccharomyces cerevisiae[J]. Biotech Bioeng, 2002,78(2):172-178.
[42] Llano T, Quijorna N, Coz A. Detoxification of a lignocellulosic waste from a pulp mill to enhance its fermentation prospects[J].Energies, 2017, 10(3): 348.
[43]李允超, 王贤华, 杨海平, 等. 竹炭表面结构及其对糠醛的吸附特性[J]. 农业工程学报, 2012, 28(12): 257-263.
[44] Keshav P K, Shaik N, Koti S, et al. Bioconversion of alkali delignified cotton stalk using two-stage dilute acid hydrolysis and fermentation of detoxified hydrolysate into ethanol[J]. Industrial Crops Products, 2016, 91: 323-331.
[45]楼宏铭, 刘红艳, 吴舜, 等. 酶解木质素吸附脱除糠醛和 5-羟甲基糠醛等发酵抑制物[J]. 精细化工, 2014, 31(6):711-718.
[46] Alriksson B, Horváth I S, Sjöde A, et al. Ammonium hydroxide detoxification of spruce acid hydrolysates[J]. Applied Biochemistry Biotechnology, 2005, 124(1-3): 911-922.
[47] Alriksson B, Cavka A, Jönsson L J. Improving the fermentability of enzymatic hydrolysates of lignocellulose through chemical in-situ detoxification with reducing agents[J]. Bioresource Technology, 2011, 102(2): 1254-1263.
[48] Nichols N N, Sharma L N, Mowery R A, et al. Fungal metabolism of fermentation inhibitors present in corn stover dilute acid hydrolysate[J]. Enzyme Microbial Technology, 2008, 42(7): 624-630.
[49]王旭. 树干毕赤酵母中参与木质纤维素水解液中醛类抑制物脱毒相关酶基因的克隆、表达及活性分析[D]. 成都: 四川农业大学, 2016.
[50] Saravanakumar T, Park H S, Mo A Y, et al. Detoxification of furanic and phenolic lignocellulose derived inhibitors of yeast using laccase immobilized on bacterial cellulosic nanofibers[J]. Journal of Molecular Catalysis B Enzymatic, 2016, 134:196-205.
[51]荣春光. 糠醛生产工艺研究及糠醛废渣的综合利用[D]. 长春: 吉林大学, 2012.
[52]焦磊. 糠醛废液净化及其稀酸糖蜜发酵酒精的研究[D]. 南宁: 广西大学, 2014.
