超声向量血流标测技术评价Graves病患者快速射血期左心室腔内血流动力学改变*
2018-05-03谢苓尹立雪周秘王斯佳李益萍徐芸任丽
谢苓 尹立雪 周秘 王斯佳 李益萍 徐芸 任丽
(1. 川北医学院,四川 南充 637000;2.四川省医学科学院·四川省人民医院超声医学研究所超声心脏电生理学与生物力学四川省重点实验室,四川 成都 610072;3.温江区人民医院,四川 成都 611130)
Graves病(GD)又称弥漫性毒性甲状腺肿,甲状腺功能亢进症80%以上是由GD引起[1]。血液循环中甲状腺激素过多可通过分子与细胞机制作用于心血管系统[2-3],导致心动过速、心脏排出量增加、心房颤动[1,4]、心力衰竭[5-7]以及自身免疫性心肌炎等[8-9]。本文通过运用超声向量血流标测(Vector Flow Mapping, VFM)技术全面评价GD快速射血期左心室的高血流动力学状态,以及HR、SBP、FT3、FT4、LVEF与血流动力学的状态的相关性,探索相关观测指标评价左心室收缩功能的可能性。
1 资料与方法
1.1 研究对象 病例组:收集四川省人民医院2016年11月~2017年3月内分泌科门诊初次确诊或停药后复发的GD患者83例(男性32例,女性51例),年龄18~57岁,平均年龄(31.6±1.9)岁为病例组。并根据《黄宛临床心电图学》对正常心率范围的定义将病例组分为:HT1组(40例):HR 100次/分,平均年龄(35.2±11.0)岁;HT2组(43例):HR≥100次/分,平均年龄(32.2±10.7)岁。对照组:选取经体格检查、实验室检查、心电图及超声心动图检查无异常的健康志愿者40例(男性18例,女性22例),年龄24~55岁,平均年龄(33.7±1.5)岁。纳入标准:①高代谢症状;②血清激素:TSH降低,FT3、FT4升高;③甲状腺弥漫性肿大;④凸眼或其它浸润性眼征。确诊为GD患者。排除标准:多结节性毒性甲状腺肿、甲状腺高功能腺瘤、桥本甲亢、高血压、糖尿病、先天性心脏病、肺源性心脏病、瓣膜病、心律失常、肾功能不全以及肝硬化等。所有实验对象均记录个人一般信息(身高、体重、HR、血压等)及甲状腺激素水平。
1.2 仪器与方法 采用Aloka Prosound F75彩色多普勒超声诊断仪,探头为UST-52105相控阵探头,频率2~5MHz。受检者左侧卧位,平静呼吸,同步记录心电图。采集左室长轴、短轴切面以及心尖四腔、三腔、两腔的二维动态图像,并存储三个完整心动周期的心尖三腔彩色动态血流图像,彩色帧频调至66帧/秒以上,调节彩色多普勒脉冲重复频率,尽量使其无混叠。在机测量LAD、LVDD、E、A、e ,计算出E/A以及E/e,Simpsonn双平面法测出LVEF。
1.3 图像分析 将图像导入DAS-RS1工作站,选定一个完整的心动周期,逐帧勾画心尖三腔心心内膜边界,系统将自动对左心室内膜进行追踪。
根据时间流量曲线(time-flow curve,T-F curve)确定快速射血期。与左心室腔基底段、中间段及心尖段分别放置三条取样线,获取各节段的T-F curve、血流量曲线(flow profile)、综合向量速度曲线(vector profile,VP),记录各节段收缩期峰值流量( peak systolic flow,Fs)、收缩期负向总流量(total systolic negative flow, SQ)、收缩期峰值流速(peak systolic velocity,Vs)。分析组间及组内指标的变化,将各指标的均值与HR、SBP、DP、TSH、FT3、FT4、LVEF进行相关性分析。
1.4 重复性检验 间隔一个月同一检查者随机从入选对象中选择15例重新勾画心内膜,将各参数进行组内重复性检验,计算组内相关系数(intraclass correlation coefficient,ICC)及变异系数(coefficient of variation,COV)。由另一名经验相当的医师对入选对象再次勾画对各参数再次计算,并进行组间重复性检验。

2 结果
2.1 一般资料 与对照组比较,病例组SBP、DP、TSH、FT3、FT4均高于对照组,且HT2组HR、SBP、FT4高于HT1组,差异有统计学意义(P<0.01);年龄、BSA、BMI比较差异无统计学意义(P>0.05),见表1。

表1 对照组与病例组一般临床资料比较Table 1 the comparison of basic clinical data
注:与对照组比较,①P<0.01;HT2与HT1比较,②P<0.01
2.2 常规超声心动图 三组间LAD、LVEDD、E/A、E/e比较差异无统计学意义(P>0.05);病例组E、A均高于对照组,HT2组LVEF、A高于HT1组与对照组,差异有统计学意义(P<0.01),见表2。

表2 病例组与对照组常规超声心动图检测指标比较Table 2 The comparison of Conventional ultrasonic measurement
注:与对照组比较,①P<0.05;与对照组比较,②P<0.01;HT2与HT1比较,③P<0.05;HT2与HT1比较,④P<0.01
2.3 快速射血期血流流量与流速变化特征
2.3.1 组内比较 病例组与对照组组内基底段、中间段、心尖段Fs、SQ、Vs均呈递减趋势,且差异有统计学意义(P<0.01),见表3。
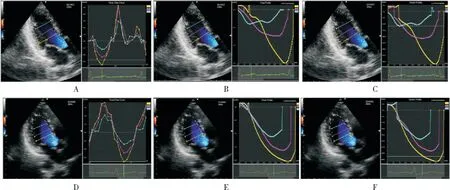
图1 对照组各节段快速射血期时间流量曲线Figure 1 The control group of each segment of rapid ejection time flow curve
注:Fs(A)、流量曲线及SQ(B)、速度向量曲线及Vs(C);病例组各节段快速射血期时间流量曲线及Fs(D)、流量曲线及SQ(E)、速度向量曲线及Vs(F);病例组Fs、SQ、Vs均高于对照组。(黄线、紫线、蓝线分别表示基底段、中间段、心尖段)
2.3.2 组间比较 与对照组相比,病例组基底段、中间段、心尖段的Fs、SQ、Vs均增高,差异有统计学意义(P<0.05),且HT2组高于HT1组(P<0.05),见表3。

表3 病例组与对照组左心室心腔内Fs、SQ、Vs比较Table 3 The comparison of Fs, SQ and Vs in left ventric
注:与对照组比较①P<0.05;与对照组比较,②P<0.01;HT2与HT1比较,③P<0.05;HT2与HT1比较,④P<0.01
2.4 相关性分析 Fs、SQ、Vs与TSH无相关性,与FT3、FT4、LVEF均呈正相关,Fs、SQ、Vs与FT3相关系数分别为0.390、0.381、0.390(P<0.01),与FT4相关系数分别为0.421、0.484、0.470(P<0.01),与LVEF相关系数分别为:0.385、0.416、0.464(P<0.01),见表4,图2。

表4 病例组 Fs、SQ、Vs与临床资料的相关性Table 4 Correlation among Fs, SQ, Vs and clinical data in case group

图2 病例组各指标相关性分析Figure 2 The correlation among Fs, SQ and Vs with FT3 FT4 and LVEF in case group注:A-C、FS、SQ、Vs与FT3的相关性;D-F、Fs、SQ、Vs与FT4的相关性;G-I、Fs、FQ、Vs与LVEF的相关性
2.5 重复性检验 同一检查者组内重复性检验,ICC 0.91~0.96,COV 0.18~0.32;不同检查者间重复性检验ICC 0.87~0.94,COV 0.19~0.34。检查者内与检查者间重复性良好,见表5。
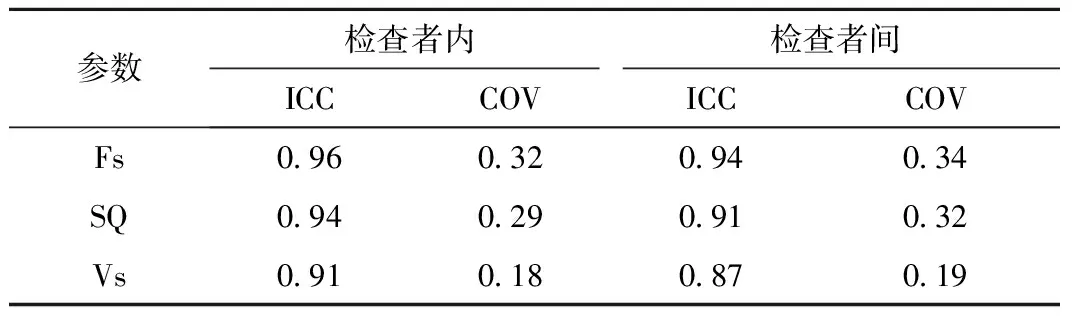
表5 重复性检验结果Table 5 Repeatability test results
3 讨论
以往的研究表明长期高水平FT3、FT4会引起心肌重构、心腔增大、心肌损害,甚至心衰等心脏结构与功能的改变。然而,许多GD患者无明显心悸症状,或者有的患者由于长期的快心率而逐渐耐受,从而导致心率在正常范围内时即使心率增快患者亦不会察觉。因此,怎样评估这部分患者的血流动力学改变及心功能极其重要,以便能早期进行干预,提高患者生活质量。长期以来,精确可靠的心脏功能评价一直是心脏病学基础和临床研究的热点和难点,建立具有创新价值和实用可靠的系统性流场和流体力学可视化观察量化评价技术方法对心脏功能状态进行更为精密准确的判断,将为心脏疾病的类型和严重程度评价以及治疗效果监测提供可靠的流体力学证据,为心脏疾病的精确诊断和高度选择内外科治疗提供全新可视化的技术保障[10]。常规多普勒是测量光束平行方向的速度分量,而不能获得与光束方向垂直的速度信息,VFM技术是基于从光束方向的速度分布推断出垂直于光束方向的速度分量,并通过复杂的血流动力学计算出血流速度、流变率(flow rate,FR)、以及流量(flow volume,FV)等详细的流变信息,能够让临床医生更好的了解到生理和病理条件下心腔内血流流体学的特点[11],评价左心室的能量损耗[12],为心脏疾病的类型与严重程度评价以及治疗效果监测提供更多的流体力学可靠证据[13]。
本临床研究是通过VFM技术探讨不同心率GD患者快速射血期左心室腔内血流动力学改变以及Fs、SQ、Vs与HR、SBP、FT3、FT4、LVEF的相关性。结果显示,HT1组与HT2组的Fs、SQ、Vs均高于对照组(P<0.05),表明GD患者在心率正常时已有血流动力学改变。GD患者甲状腺激素分泌过多引起代谢亢进、机体耗氧量增加、产热过多,血流动力学随之发生改变以适应高代谢状态;同时外周血管阻力降低,皮肤毛细血管扩张,全身循环血容量增加10%以上,血流速度加快[14],GD患者由于全身总血容量增加,心肌收缩例增强,外周血管扩张,心率增快,从而到引起心输出量增加。而快速射血期相当于整个收缩期的三分之一左右,其心室射血量却占整个收缩期的射血量的70%以上[15],这一系列病理生理改变是导致病例组Fs、Vs、SQ明显高于对照组主要原因。病例组与对照组组内基底段、中间段、心尖段Fs、SQ、Vs均呈递减趋势,这和以往的研究结果一致[16-17],这是由于随着左心室室壁收缩,左心室腔内压力增高,左心室腔内血流束由左心室基底部向主动脉方向流出导致的[18]。
Fs、SQ、Vs与FT3、FT4呈正相关,这和甲状腺激素引起心血管系统改变的机制相符合:①静息状态下窦性心率增快主要与甲状腺激素兴奋窦房结肌细胞f-通道蛋白质基因的转录,细胞浆f-通道的电导性增加有关[19];②甲状腺激素直接作用于心肌收缩蛋白,发挥正性肌力的作用,并能增强心脏受体对儿茶酚胺的敏感性[1];③甲状腺激素导致外周血管扩张,阻力下降,心脏输出量代偿性增加[1]。此外,微小RNA将介导或调节甲状腺激素信号,使其表达增加,从而使心肌舒张速度增快[20]。
传统超声心动图可通过LVEF、左室短轴缩短率(LVFS)、左室收缩末期容积(LVESV)、SV、CO等参数反应左心室收缩功能。LVEF与Fs、SQ、Vs呈正相关,提示心功能状态在一定程度上可通过心腔内血流动力学来评估。本研究表明:①VFM技术可直观定量评价GD患者快速射血期左心室腔内血流动力学变化,GD患者心率正常时左心室腔内血流量与血流速度已经增快,此时应进行干预减轻心脏负荷,采用VFM技术在一定程度上能检测GD患者左心室整体收缩功能。②GD患者血流状态变化由FT3、FT4、LVEF共同作用引起,通过甲状腺激素的改变可评估心脏血流动力学改变。但此实验仍然存在很多不足之处:①样本量相对较少;②由于GD患者心率较快,血流速度偏快,常常通过调高彩色血流速度标尺,避免混叠的产生,这将造成部分低速血流信号无法显示;③心腔是一个三维空间结构,而目前的VFM技术观察心腔血流流场状态通过二维单平面的多普勒频移信息,这是否能反应真实的三维血流流场还需要更多的实验研究来证明;④患者起病时间不能准确获得,无法准确评价病程对血流动力学的影响。⑤此实验未进行心率校正,无法完全排除单纯心率因素对心脏血流动力学状态的影响。
4 结论
VFM技术可直观定量评价GD患者快速射血期左心室腔内血流动力学变化,GD患者心率正常时左心室腔内血流量与血流速度已经增快,此时应进行干预减轻心脏容量负荷;左心室腔内血流量以及血流速度与FT3、FT4和LVEF正相关。
【参考文献】
[1]葛均波,徐永健.内科学[M].人民卫生出版社.2013,8版:685-687.
[2]Ertek S, Cicero AF. Hyperthyroidism and cardiovascular complications: a narrative review on the basis of pathophysiology[J]. Archives of Medical Science Ams, 2013, 9(5):944-952.
[3]Kahaly GJ,Dillmann WH.Thyroid hormone action in the heart[J].Endocr Rev, 2005,26:704-728.
[4]Patricia MO,Maja U,Morali D,etal.Hyperthyroidism and the Heart[J].Methodist Debakey Cardiovasc,2017,13(2):60-63.
[5]Gencer B, Collet TH, Virgini V,etal. Subclinical thyroid dysfunction and the risk of heart failure events: an individual participant data analysis from 6 prospective cohorts.[J]. Circulation, 2012, 126(9):1040-1049.
[6]Ning N, Gao D, Triggiani V,etal. Prognostic Role of Hypothyroidism in Heart Failure[J]. Medicine, 2015, 94(30):C209-C209.
[7]Vargas-Uricoechea H, Bonelo-Perdomo A. Thyroid Dysfunction and Heart Failure: Mechanisms and Associations[J]. Current Heart Failure Reports, 2017, 14(1):48-58.
[8]Fatourechi V, Edwards WD. Graves' disease and low-output cardiac dysfunction: implications for autoimmune disease in endomyocardial biopsy tissue from eleven patients[J]. Thyroid, 2000, 10(7):601-605.
[9]Mavrogeni S, Markussis V, Bratis K,etal. Hyperthyroidism induced autoimmune myocarditis. Evaluation by cardiovascular magnetic resonance and endomyocardial biopsy.[J]. International Journal of Cardiology, 2012, 158(1):166-168.
[10] 尹立雪.心腔内血液流场及流体力学状态的可视化观察及量化评价[J].中华医学超声杂志,电子版, 2009, 6(3):3-5.
[11] Li C, Zhang JQ, Li XQ,etal. Quantification of chronic aortic regurgitation by vector flow mapping: a novel echocardiographic method[J]. European Journal of Echocardiography, 2010, 11(2):119-124.
[12] Akiyama K, Maeda S, Matsuyama T,etal. Vector flow mapping analysis of left ventricular energetic performance in healthy adult volunteers:[J]. Bmc Cardiovascular Disorders, 2017, 17(1):21-30.
[13] 尹立雪,李文华,陆景,等.单点双极选择性心脏起搏犬左心室腔内流场状态的超声观察[J]. 中华医学超声杂志,电子版,2010,7(2):3-7.
[14] 刘新民.实用内分泌学[M].人民军医出版社.2004,3版:620-621.
[15] 刘大为.临床血流动力学[M].人民卫生出版社.2013,17-18.
[16] 宿阳, 田家玮, 姜双全,等.应用VFM技术评价扩张型心肌病收缩期左心室心腔内血流动力学变化[J]. 中国医学影像技术, 2011, 27(6):1164-1167.
[17] Zhou BY, Wang J,Xie MX,etal. Left ventricular systolic intraventricular flow field assessment in hyperthyroidism patients using vector flow mapping[J]. Huazhong Univ Sci technol[Med Sci], 2015, 35(4):574-578.
[18] 张丽,谢明星,王新房,等.VFM评价正常成人左室心腔血流流场运动状态的初步研究[J].临床心血管病杂志, 2009, 25(12):889-892.
[19] Renaudon B, Lenfant J, Decressac S,etal. Thyroid hormone increases the conductance density of f-channels in rabbit sino-atrial node cells.[J]. Receptors & Channels, 2000, 7(1):1-8.
[20] Zhang D, Li Y, Liu S,etal. microRNA and thyroid hormone signaling in cardiac and skeletal muscle:[J]. Cell & Bioscience, 2017, 7(1):14-21.
